本文作者:杉杉
导读
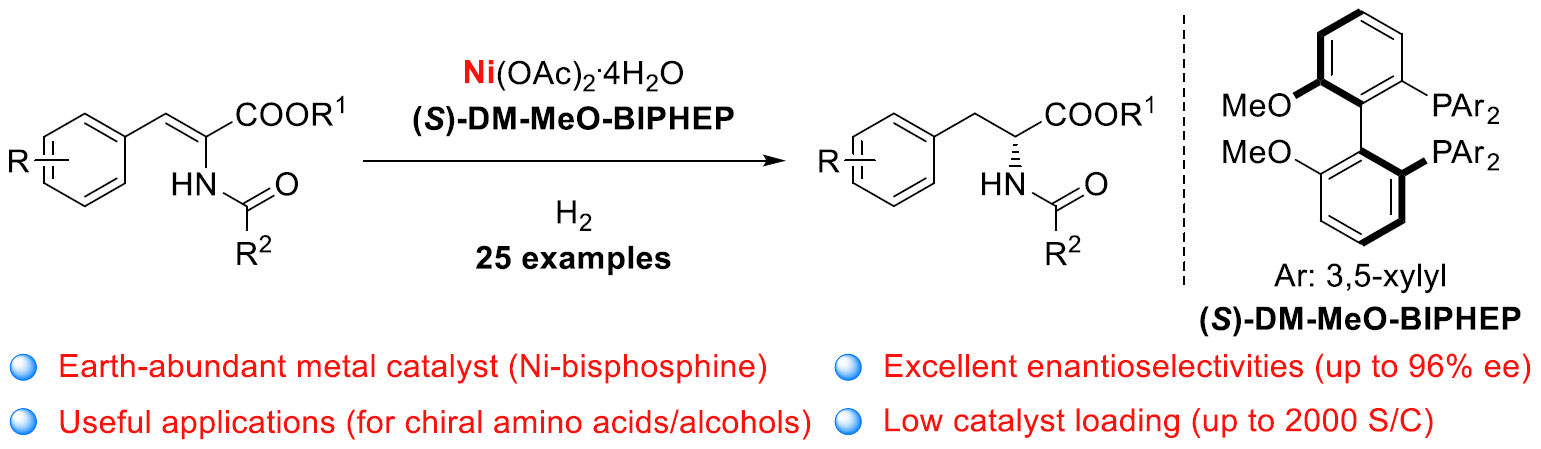
近日,上海交通大学张万斌教授课题在Angew发表论文,报道了通过镍与手性双膦配体的结合,实现2-酰胺基丙烯酸酯不对称氢化反应,以高收率和高对映选择性获得手性α-氨基酸酯衍生物。此外,可将催化剂载量降至S/C=2000,从而实现高效的催化效率。同时,获得的目标产物可进一步转化为手性α-氨基酸,β-氨基醇等一些生物活性衍生物。文章链接DOI:10.1002/anie.201916534
(图片来源:Angew. Chem. Int. Ed.)
正文
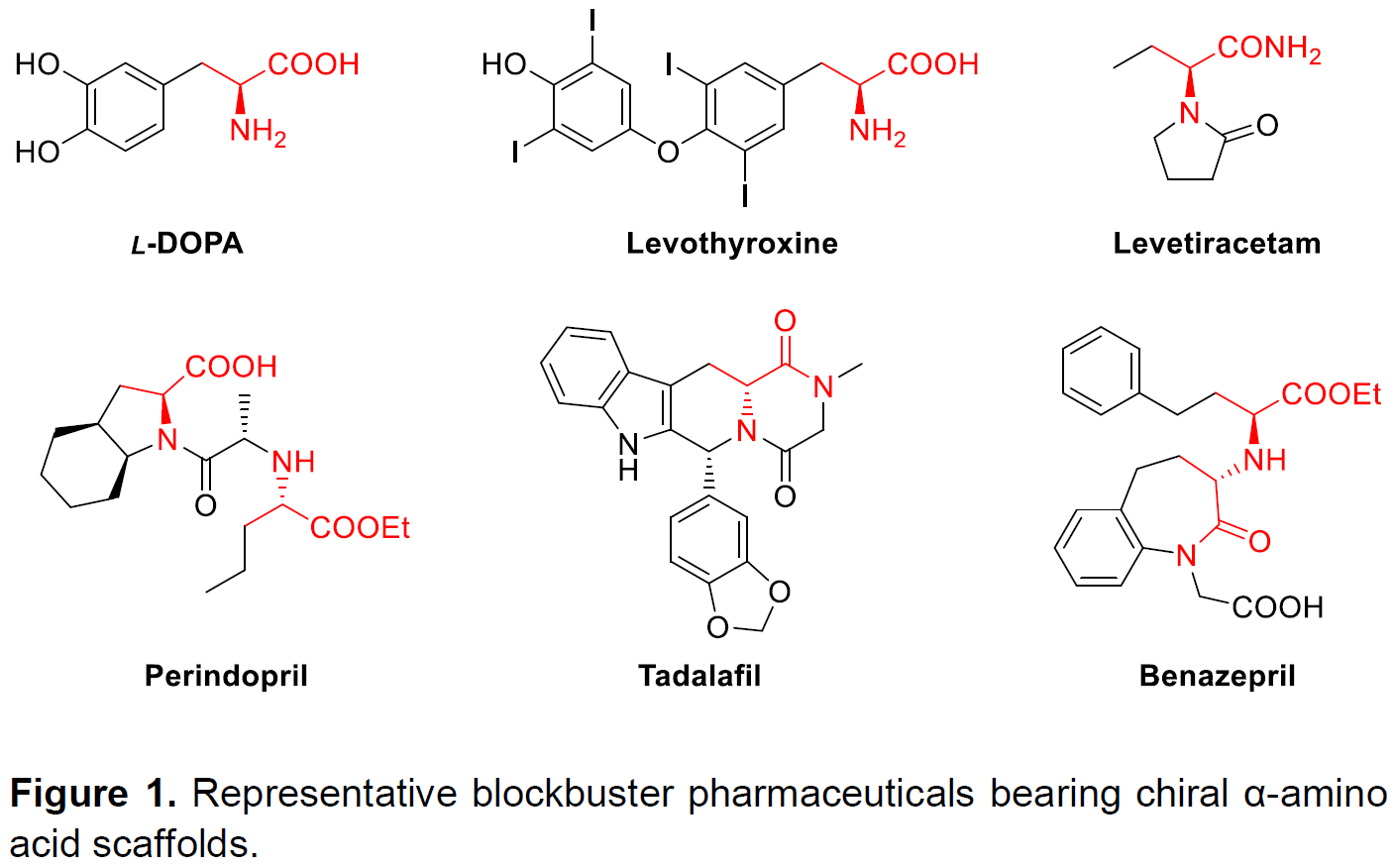
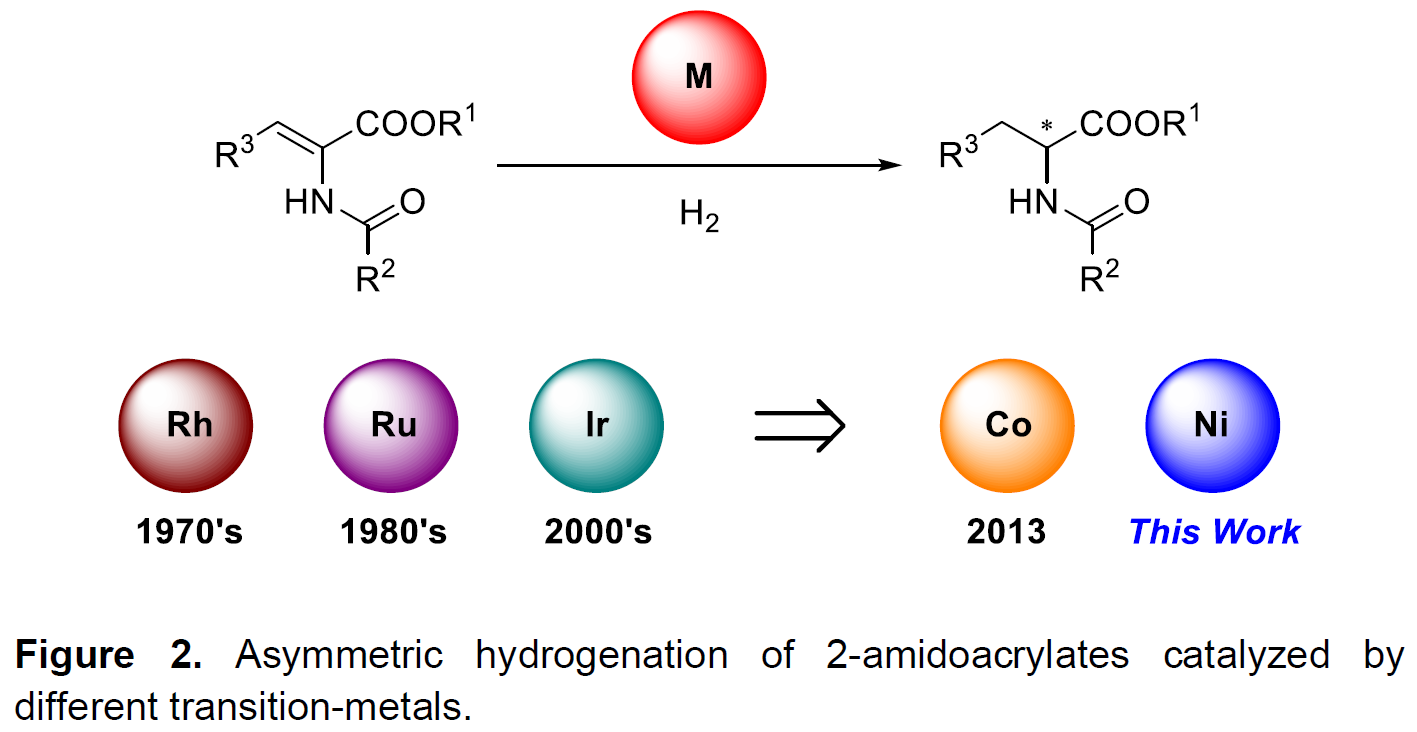
手性α-氨基酸作为化学和生物学中最重要的骨架之一(Figure 1)。因此,手性α-氨基酸及其衍生物的不对称合成受到广泛的关注,数以万计的文献已报道了数十种方法,而过渡金属催化2-酰胺基丙烯酸酯的不对称氢化反应是其中最高效的方法。在过去数十年中,提高该方法的效率和实用性一直是该领域研究的重点,一些由Rh、Ru和Ir组成的催化剂已被报道(Figure 2)。2001年,当Knowles通过Rh催化不对称氢化反应实现L-DOPA的工业合成,从而获得诺贝尔化学奖,使该领域变得更为重要。然而,贵金属催化剂的高成本和高毒性阻碍了该技术的广泛应用。
(图片来源:Angew. Chem. Int. Ed.)
与贵金属催化剂相比,一些Mn、Fe、Co、Ni、Cu等过渡金属催化剂也可实现不对称氢化反应,同时具有成本低、毒性低等优点。目前为止,只有钴配合物实现2-酰胺基丙烯酸酯的不对称氢化反应,合成手性α-氨基酸或酰胺衍生物(Figure 2)。但是,其他过渡金属具有各自的配位模式,无法利用酰胺基团的活化策略,从而阻碍了2-酰胺基丙烯酸酯不对称氢化反应的尝试。最近,Chirik和Zhang课题组报道了Ni催化烯烃的不对称加氢反应,同时还开发了一个Ni催化亚胺的不对称氢化反应。在此实验中,作者发现,底物和催化剂之间存在一定的相互作用可提高催化活性(适当的金属/配体比可提高催化效率)。因此,作者设想,是否可以通过上述类似的策略,实现第一个Ni催化2-酰胺基丙烯酸酯的不对称氢化反应,合成手性α-氨基酸衍生物(Figure 2)。
(图片来源:Angew. Chem. Int. Ed.)
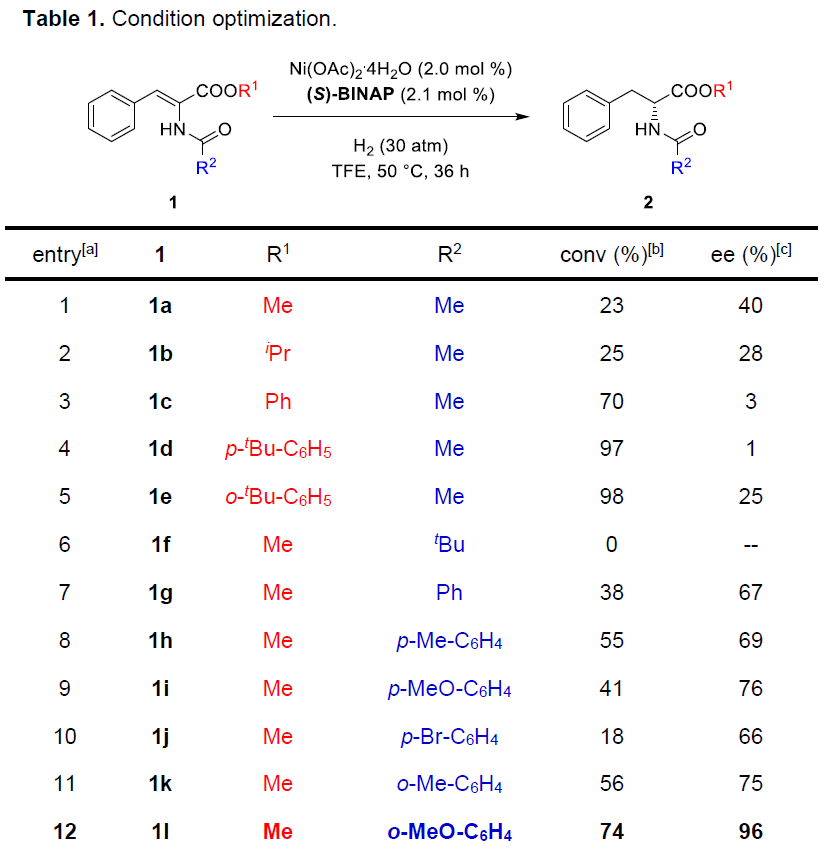
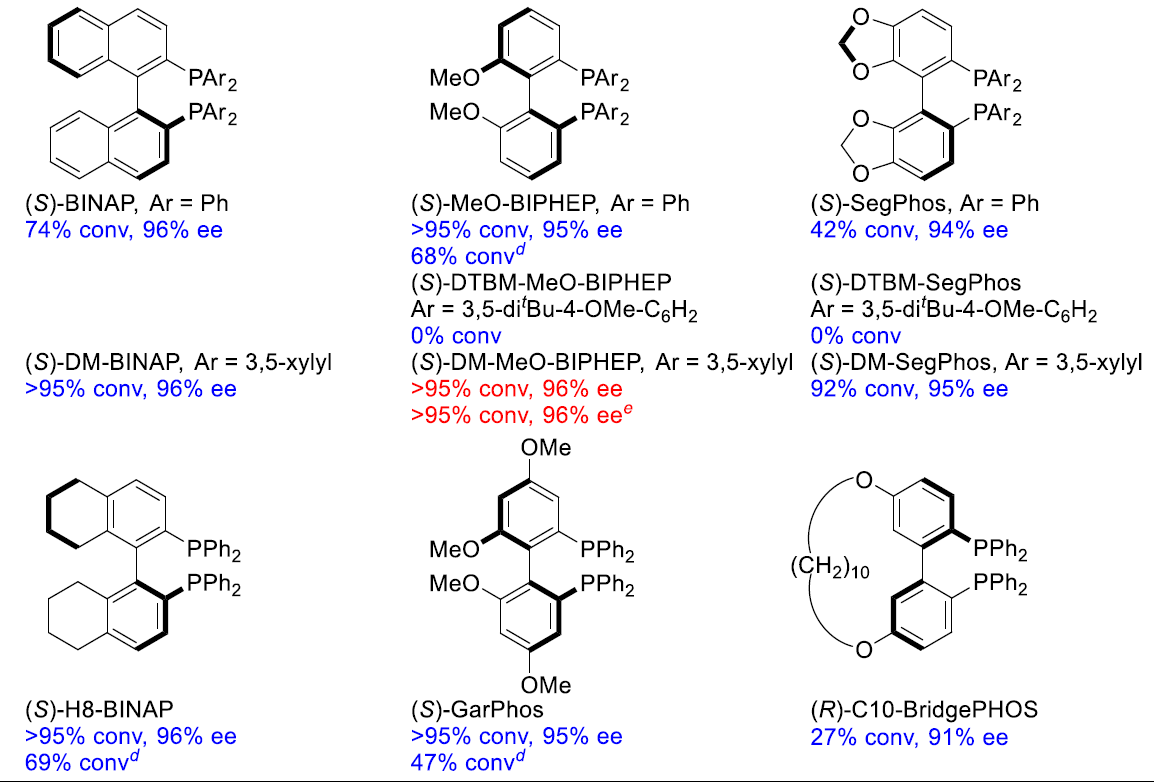
首先,作者对不同取代的底物1进行了大量的反应研究(Table 1)。当以1a作为底物,以Ni(OAc)2·4H2O作为催化剂,(S)-BINAP为配体,仅获得23%转化率和40%ee的产物2a(entry 1)。随后,作者研究了不同取代的R1和R2基团看是否可以获得更好的结果,反应结果表明,不同取代的R1和R2基团对反应具有一定的影响(entries 2-12),当R2基团为o-MeO-C6H4时,可获得最佳结果(产率74%、96%ee)。接下来,作者也对各类Ni催化剂和溶剂进行了筛选,反应结果表明,Ni(OAc)2·4H2O作为最佳催化剂,TFE作为最佳溶剂。此外,作者也对多种手性双膦配体进行了筛选,其中轴向手性配体表现出较好的结果。使用(S)-MeO-BIPHEP、(S)-H8-BINAP、(S)-GarPhos时可以获得较好的结果,同时作者发现,空间效应是影响不同配体性能的关键因素。因此,作者研究了其他三个具有中等二面角的轴向手性配体,(S)-DM-BINAP,(S)-DM-MeO-BIPHEP和(S)-DM-SegPhos,当(S)-DM-MeO-BIPHEP用作配体,可将反应时间可以缩短到24h,并获得95%转换率和95-96%ee的相应产物。
(图片来源:Angew. Chem. Int. Ed.)
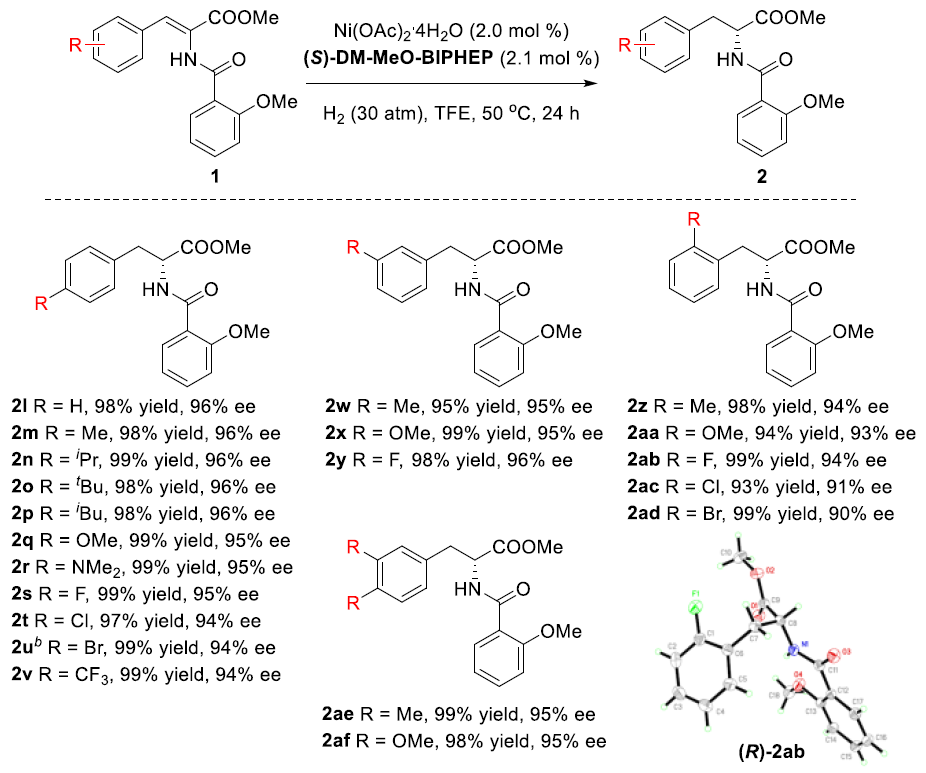
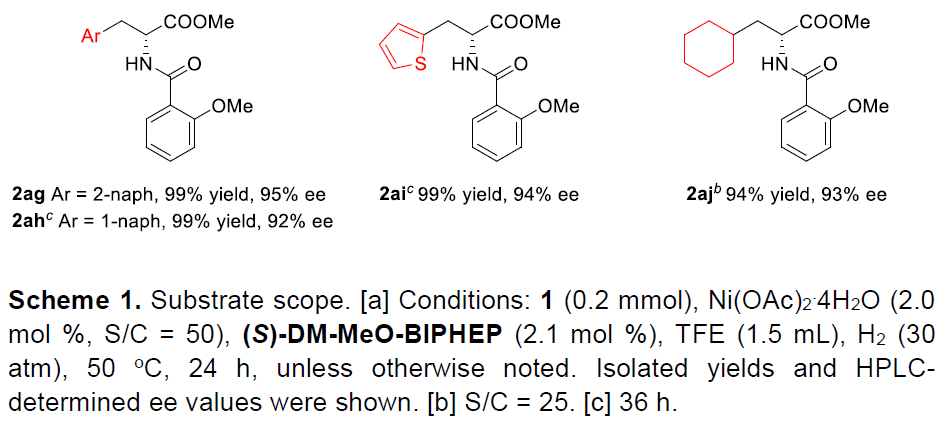
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Scheme 1)。在芳基的2,3,4位上具有供电子和吸电子取代基时均可获得相应的目标产物2l–2ad(收率93-99%,90-96%ee)。同时,二取代(1ae–1af)、萘基(1ag–1ah)和噻吩基底物(1ai)同样获得较好的结果。此外,当芳基改变为环己基时,氢化反应也能够顺利进行,获得93%ee的相应产物2aj,但催化剂量需增加。
(图片来源:Angew. Chem. Int. Ed.)
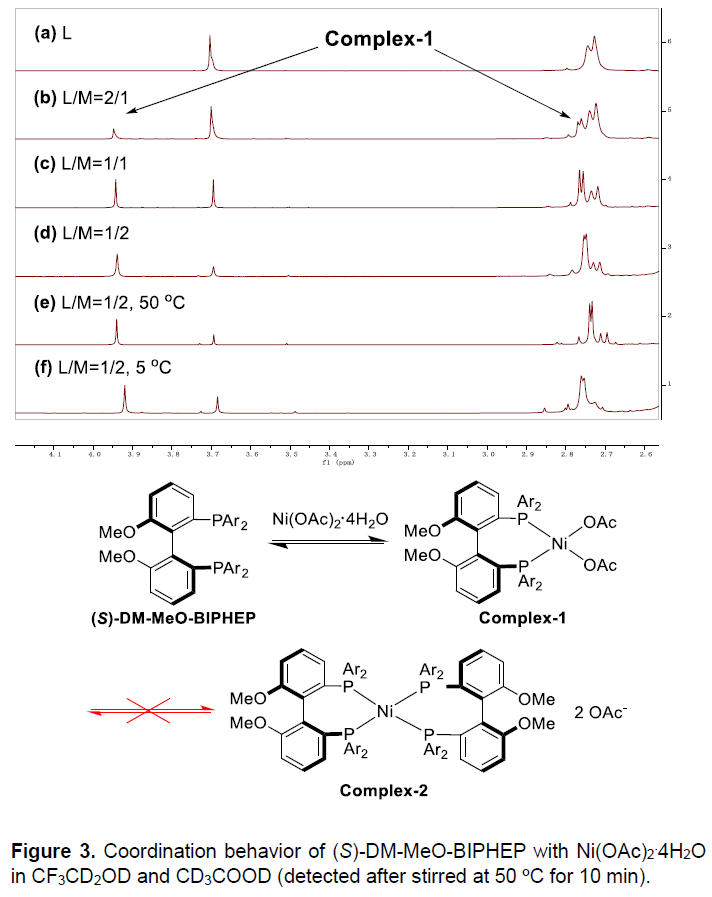
随后,作者进一步对催化效率继续进行研究。起初,当S/C=500时,即使长时间反应也未能完全转化,为了进一步提高效率,作者试图在反应体系中增加添加剂。反应结果表明,尽管产物的对映选择性从96%略降至93%,但加入AcOH后可大大提高反应速度,可能是由于对质子分解步骤促进作用以及促进配体溶解导致。另一方面,提高金属/配体的比例可进一步提高催化剂效率。作者通过1H NMR光谱分析,研究了(S)-DM-MeO-BIPHEP与Ni(OAc)2·4H2O在不同配比和温度下的相关配位关系(Figure 3)。当L/M为1/1时,Complex-1的含量约为50%,而当L/M比为2/1或1/2时,Complex-1的含量分别增加至65%和68%。因此,过量的镍盐或配体可以促进活性Complex-1的形成,从而提高氢化效率。此外, NMR变温实验的结果表明,在Complex-1和(S)-DM-MeO-BIPHEP/Ni(OAc)2之间存在配位和解离平衡关系。
(图片来源:Angew. Chem. Int. Ed.)
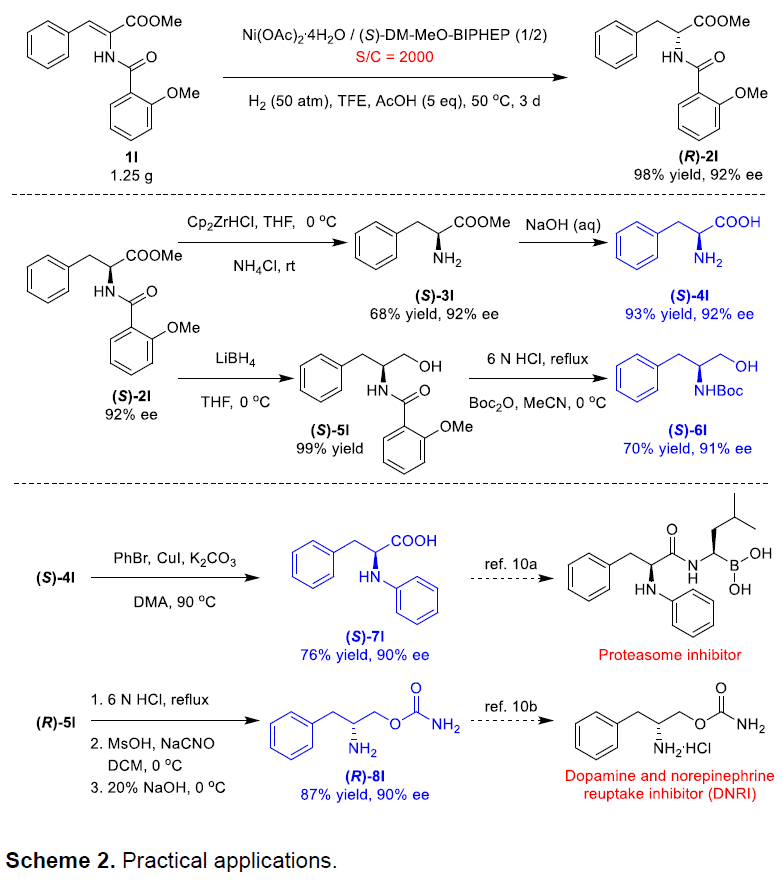
紧接着,作者对反应的实用性也进行了相关的研究(Scheme 2)。当使用5当量的AcOH和L/S=2/1,即使在S/C=2000下也可完成氢化反应,该结果代表了Ni催化C=C键不对称氢化的最高效率。此外,将获得的产物进一步修饰可获得更具有价值的产品。当1l与配体(R)-DM-MeO-BIPHEP发生氢化反应时,可获得92%ee的对映体产物(S)-2l。通过用Schwartz试剂处理,然后水解(S)-3l,可获得手性α-氨基酸(S)-4l。(S)-2l经还原与Boc基团的交换,可获得91%ee的(S)-6l。(S)-4l和 (R)-5l还可以继续转化为(S)-7l和(R)-8l(它们分别是蛋白酶体抑制剂和多巴胺/去甲肾上腺素再摄取抑制剂的前体)。
(图片来源:Angew. Chem. Int. Ed.)
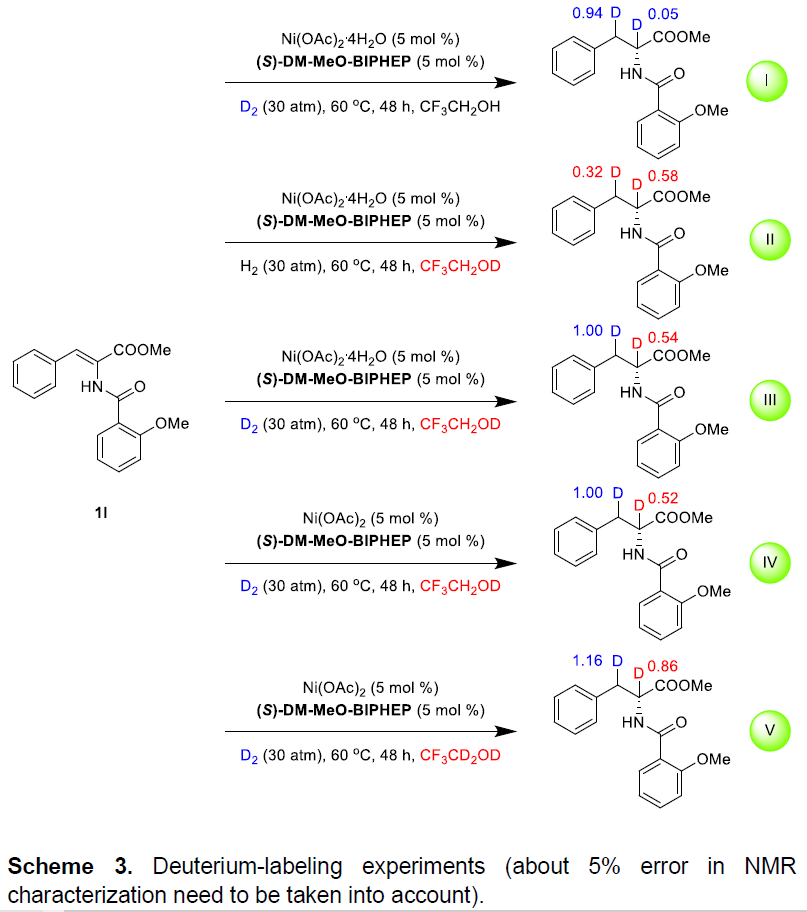
为了进一步了解反应的机理,作者进行了相关的氘代实验(Scheme 3)。在D2气体下,氘主要位于β-位置(Scheme 3-I)。而在CF3CH2OD的H2气体下反应,获得α-和β-位都掺有氘的产物(Scheme 3-II)。当同时使用D2和CF3CH2OD反应时,β-位置完全氘化而α-位置部分氘化(Scheme 3-III)。而使用无水Ni(OAc)2反应时,结果与Ni(OAc)2·4H2O相同(Scheme 3-IV)。使用CF3CD2OD和D2将β-位置氘化至1.16 D,还将α-位置部分氘化(0.86 D)(Scheme 3-V)。如果不存在H2或D2条件下反应,则不会检测到任何产物,这表明该还原反应是氢化反应,而不是转移氢化反应。根据氘标记实验,可以推断出β-H/D主要源自H2/D2,而α-H/D来自中间体中的H+/D+。
(图片来源:Angew. Chem. Int. Ed.)
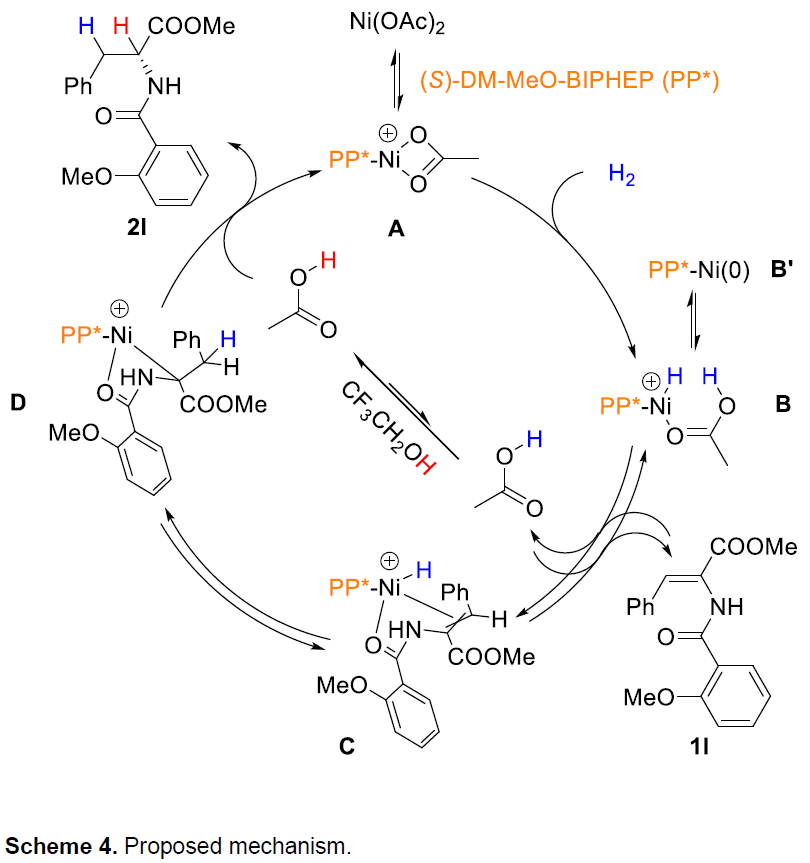
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 4)。首先,H2与A进行异质裂解形成Ni(II)-H络合物B,B再与底物1l配位,活化乙烯基,形成中间体C。然后,Ni-H插入乙烯基的β-位,生成C-Ni中间体D。最后,D经质子分解后释放获得目标产物2l。
(图片来源:Angew. Chem. Int. Ed.)
总结
上海交通大学张万斌教授课题报道,通过镍与手性双膦配体的结合,实现2-酰胺基丙烯酸酯不对称氢化反应,以高收率(高达99%)和高对映选择性(高达96%ee)获得手性α-氨基酸酯衍生物。此外,可将催化剂载量降至S/C=2000,从而实现高催化效率,这也代表了Ni催化烯烃的不对称氢化的最高催化效率。同时,获得的目标产物可进一步转化为手性α-氨基酸,β-氨基醇及其生物活性衍生物。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.