作者:石油醚
导读:
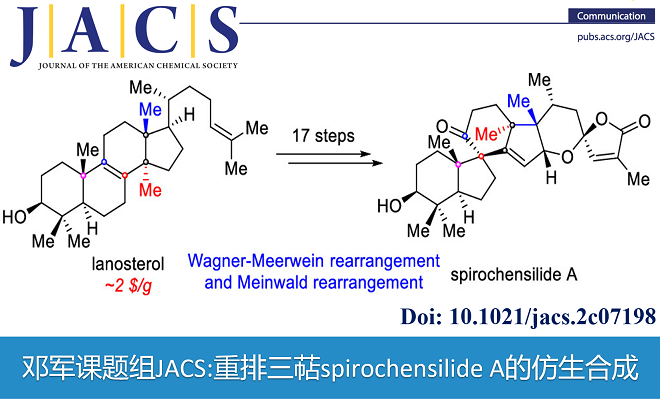
近日,南开大学化学院邓军研究员课题组通过生源分析及理性的合成设计,实现了从羊毛甾醇到重排三萜spirochensilide A的高效仿生合成。以选择性惰性C-H键氧化及Wagner-Meerwein/Meinwald串联重排、光照顺反异构化串联螺缩酮成环等反应为关键步,17步实现了从廉价易得的羊毛甾醇到spirochensilide A的高效仿生转化,为该类天然可能的生物合成途径解析及高效合成提供了线索。南开大学化学院邓军研究员为本文通讯作者;龙先文博士和李俊博士研究生为共同第一作者。
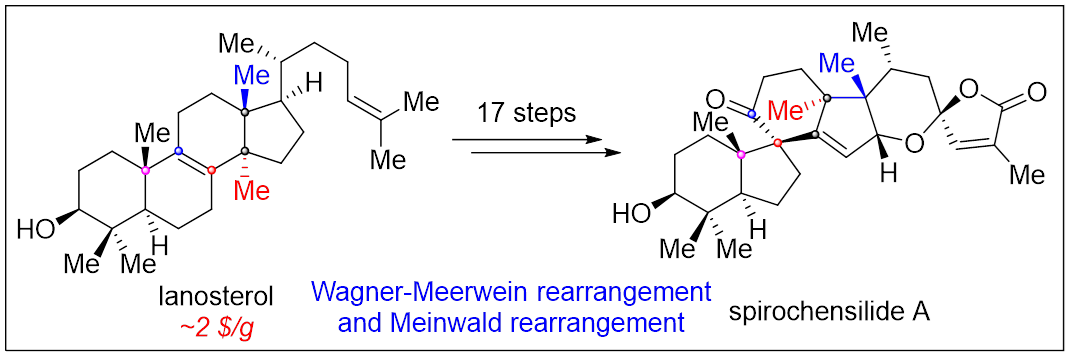
Bioinspired Synthesis of Spirochensilide A from Lanosterol
Xianwen Long, Jun Li, Feng Gao, Hai Wu, Jun Deng
J. Am. Chem. Soc. 2022, ASAP, doi: 10.1021/jacs.2c07198
正文:
结构丰富多样,生物活性显著的三萜天然产物都是众多传统中药的重要组成成分之一,如羊毛甾烷型三萜天然产物凭借其出色的抗炎镇痛、抗病毒、抗植物病原菌、以及抗肿瘤等活性成为药物化学家关注的重点。Spirochensilides A-B是2015年兰州大学高坤课题组(Org. Lett. 2015, 17, 2760−2763)从秦岭冷杉的枝叶中分离得到了一类结构新颖的羊毛甾烷型三萜天然产物(图1A)。结构上,它们具有螺[4.5]癸烷(B,C环)模块组成的6/5/6/5独特的四环全碳骨架,以及两对相邻的全碳手性中心(C8/C10和C13/C17)。生物活性方面,其对NO的产生有中等抑制作用,可作为炎症研究的潜在探针分子。与此同时,他们还推测Spirochensilide A是由环氧化合物5经Meinwald重排、酶催化的C17C-H氧化及两步Wagner-Meerwein重排反应来得到的(图1B)。其独特的骨架结构和生物活性吸引国内外合成化学家的关注。2020年北京大学的杨震课题组(J. Am. Chem. Soc. 2020, 142, 8116−8121)以半频哪醇重排、钨介导的环丙烯Pauson-Khand反应以及单线态氧促进的氧化环化反应为关键反应以22步,2.2%总收率完成spirochensilide A的首次不对称全合成。
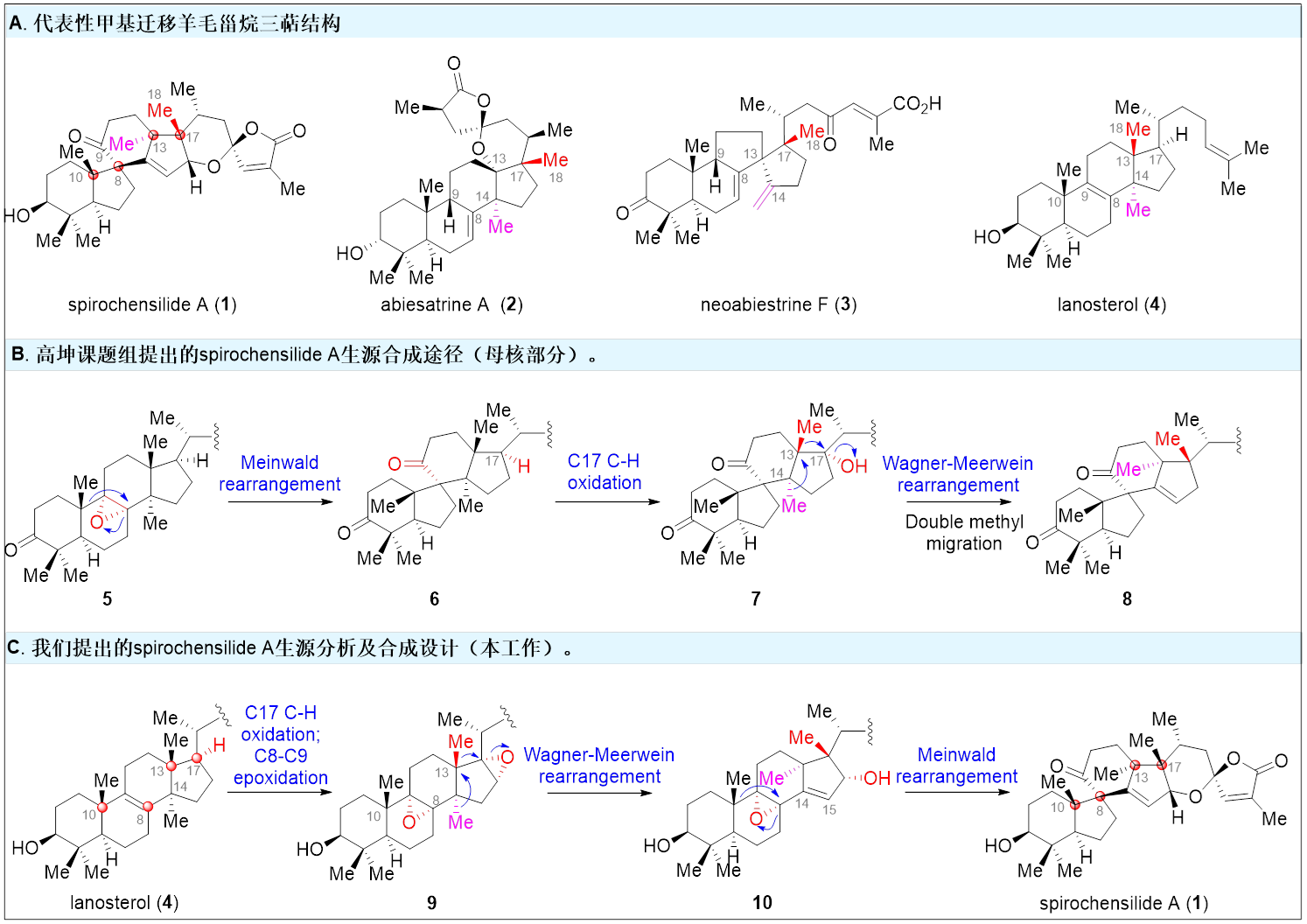
图1 Spirochensilide A 的结构及生源分析
近日南开大学邓军课题组利用生源网络分析方法(Bioinspired Structure Network Analysis)对spirochensilide A开展了生源分析,并提出了spirochensilide A的可能生源合成途径(图1C)。作者认为,羊毛甾醇(4)在一系列酶催化下首先在C17位进行选择性C-H氧化、四取代双键环氧化后,发生两步Wagner-Meerwein甲基迁移重排,形成关键中间体10,接着发生Meinwald重排得到6/5/6/5四环骨架,进一步关上螺缩酮环最终的得到Spirochensilides A。该合成的难点主要在于:如何通过化学手段实现C17位的立体选择性惰性C-H键氧化,调控Wagner-Meerwein双甲基迁移重排以及Meinwald重排反应的选择性。
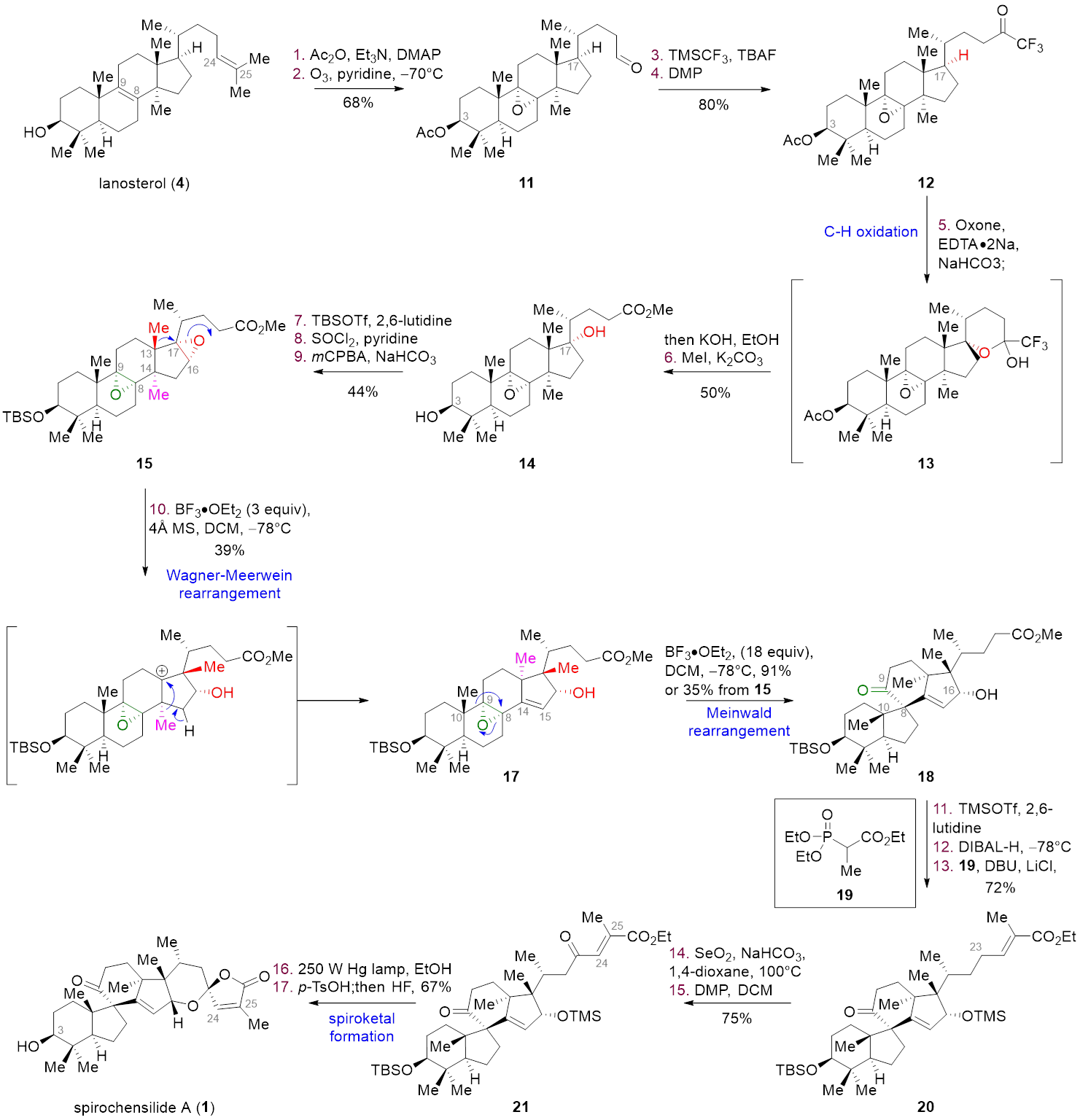
图2 Spirochensilide A 的仿生合成
如图2所示,基于以上的合成设想,作者从商业可得的羊毛甾醇(4)出发,历经17步实现了三萜天然产物spirochensilide A的仿生合成。具体转化过程请见全文,在这里我们详细解析一下几步关键反应的设计及优化过程:
C17位立体选择性氧化
为了引发后续的Wagner–Meerwein重排反应,需要首先在C17位预装能够引发碳正离子的官能团,如羟基、卤素、环氧等等。尽管目前惰性C-H键活化反应取得了飞速发展,在复杂底物如羊毛甾醇lanosterol的骨架上实现立体专一性的3级C-H氧化还是非常困难的,作者曾尝试如Breslow所发展的导向氯代等策略都没有取得成功(详见Supporting Information)。幸运的是,现在西湖大学的杨丹教授所开创的C-H键氧化方法(以三氟甲基酮作为导向基团,过氧丙酮(DMDO)作为氧化剂,J. Am. Chem. Soc. 1998, 120, 6611– 6612.),可高效实现C17位立体选择性氧化,这也是首次将该化学应用于复杂天然产物的合成中。
Wagner–Meerwein重排条件优化
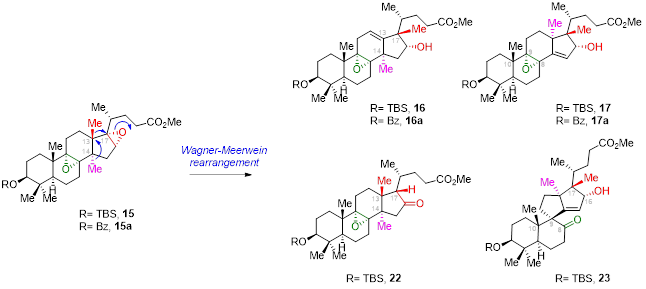
图3 Wagner–Meerwein重排条件优化
Wagner–Meerwein重排反应在萜类天然产物的生物合成中是一个比较常见的反应,然而目前所能实现的Wagner–Meerwein重排反应大多为单个甲基的迁移,连续两个甲基的串联迁移难度非常大,这也可以从Heretsch课题组的合成中得到印证(J. Am. Chem. Soc. 2022, 144, 11574.)。经过一系列条件筛选(图3),以双环氧化合物15为底物,最终在BF3·OEt2条件下,作者可以优先活化三取代环氧,引发两步连续的Wagner–Meerwein重排反应得到中间体17,同时近一步增加BF3·OEt2当量可在相同条件下继续反应得到Meinwald重排产物18,完成了核心四环骨架的构建。值得注意的是,作者以双环氧化合物15为Wagner–Meerwein重排反应底物是基于几方面考虑:第一,可以通过控制BF3·OEt2当量和反应温度实现依次启动Wagner–Meerwein重排反应和后续的Meinwald重排反应;第二,C16-C17环氧开环后保留的C16位羟基可以为后续螺缩酮环系的高效构建提供助力;最后,C17羟基化合物14由于其反应活性较低,在Lewis酸催化下优先发生四取代环氧的开环反应,从而难以引发Wagner–Meerwein重排反应。
螺缩酮环系的构建
得到四环中间体18之后,只需完成螺缩酮环系的构建即可完成spirochensilide A的仿生合成。作者认为在安装侧链碳骨架和调整氧化态之后,可以通过一步环化缩合直接构建右侧螺缩酮环系。将18中C16位的羟基用TMS保护基保护,将侧链的酯用DIBAL-H还原至醛,通过HWE反应增碳,得到中间体20。将C23位用SeO2进行烯丙位氧化得到烯丙醇,并用DMP将其氧化为酮,得到中间体21。至此,侧链碳数和氧化态调整完毕,在光照条件下将双键顺反异构化之后,在酸性条件下一步脱出16-OH的TMS保护并完成螺缩酮结构的构建。最后氢氟酸脱出3-OH的TBS保护,得到天然产物spirochensilide A。
总结:
南开大学邓军课题组通过生源分析及理性的合成设计,以选择性C-H氧化及Wagner-Meerwein/Meinwald重排、光照顺反异构化串联螺缩酮成环等反应为关键步,17步实现了从廉价易得的羊毛甾醇到spirochensilide A的高效仿生转化,为该类天然可能的生物合成途径解析及高效合成提供了线索。
(邓军研究员供稿)
作者简介:
邓军 研究员

邓军,南开大学化学院及元素有机国家重点实验室特聘研究员,主要从事复杂活性天然产物的合成研究,致力于通过发展新型仿生合成策略来实现复杂活性天然产物的高效合成。2009年在兰州大学化学院获学士学位,2014年在中国科学院上海有机化学研究所获博士学位(导师:李昂研究员),2014年至2016年在美国哈佛大学化学与化学生物学系从事博士后研究(导师:Prof. Andrew Myers)。2017-2020年在中国科学院昆明植物研究所,植物化学与西部植物资源持续利用国家重点实验室开展独立研究工作;2021年全职加入南开大学化学院元素有机化学国家重点实验室,任特聘研究员、博士生导师。先后获得中科院百人计划择优支持,Thieme Chemistry Journals Award,国家优秀青年项目等奖项。近年来,以通讯作者在国际高水平学术期刊Chem,J. Am. Chem. Soc.,Angew. Chem. Int. Ed.等发表多篇学术论文。
课题组提出了基于生源启发的分子网络分析方法(Bioinspired Structure Network Analysis),并将其应用于细胞松弛素家族天然产物的生源分析,建立了该家族通用合成策略,实现了该家族集群式高效合成(Chem. 2021, 7, 212–223; Angew. Chem. Int. Ed. 2021, 60, 15963–15971.)。已完成7类40余个复杂活性天然产物的仿生合成工作,其中35个为首次全合成,(Angew. Chem. Int. Ed. 2018, 57, 14221–14224;Angew. Chem. Int. Ed. 2019, 58, 17552–17557; Org. Lett. 2020, 22, 9421–9426.),课题组主页:http://www.dengjunclub.com/。团队诚招硕士生、博士生、博士后,欢迎有志从事天然产物合成及药物化学研究的同学加盟课题组,共同实现科研梦想和人生梦想!详见团队网站“加入我们”。
课题组主页:http://www.dengjunclub.com/
全文链接:https://pubs.acs.org/doi/10.1021/jacs.2c07198
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载













No comments yet.