本文作者:杉杉
导读
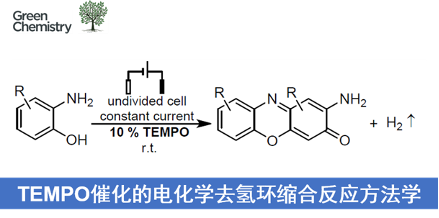
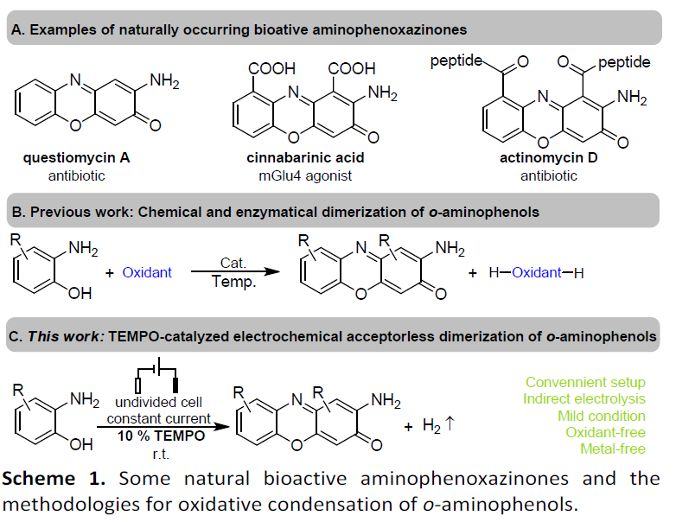
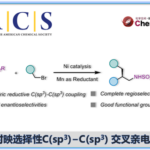
近日,温州医科大学的蔡云瑞课题组在Green Chem.中发表论文,报道一种全新的采用TEMPO催化剂促进的通过一系列邻氨基苯酚类底物参与的电化学去氢环缩合反应 (dehydrogenative cyclocondensation)方法学。这一全新的电化学去氢环缩合反应策略具有温和的反应条件、无需选择化学计量的氧化剂以及催化剂廉价易得等优势。
TEMPO-Catalyzed Electrochemical Dehydrogenative Cyclocondensation of o-Aminophenols: Synthesis of Aminophenoxazinones as Antiproliferative Agents
Zhou, Z. Ma, C. Shonhe, S. Ji, Y. Cai, Green Chem. 2021, 23, 8566. doi: 10.1039/D1GC02908H.
正文
2-氨基吩噁嗪酮 (2-aminophenoxazinone)骨架单元广泛存在于各类生理活性天然产物分子中。因此,对于构建氨基吩噁嗪酮类骨架相关的合成策略研究已经开始受到诸多研究团队的广泛关注 (Scheme 1)[1]-[2]。这里,受到近年来对于有机电化学合成[3]策略中通过氧化还原媒介 (redox mediator)实现间接电解的相关研究报道[4]的启发,温州医科大学的蔡云瑞团队成功设计出一种全新的通过TEMPO催化剂促进的采用邻氨基苯酚类底物参与的电化学去氢环缩合反应方法学,进而顺利完成一系列2-氨基吩噁嗪-3-酮类分子的构建 (Scheme 1C)。
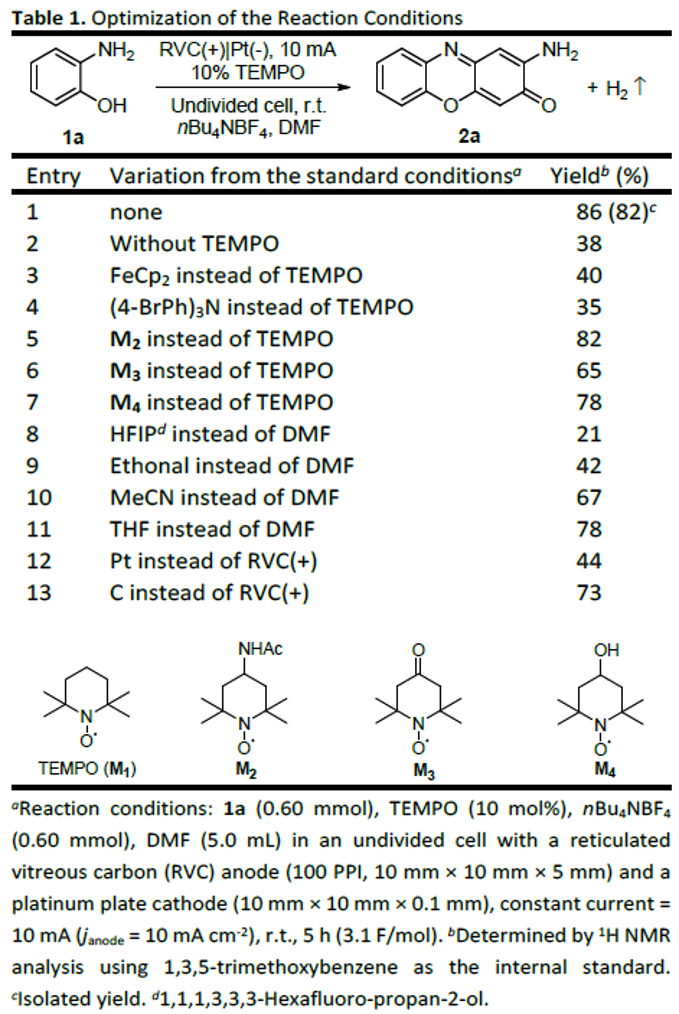
首先,作者采用邻氨基苯酚1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用TEMPO作为催化剂,nBu4NBF4作为支持电解质,在无隔膜电解槽中,采用RVC (reticulated vitreous carbon)作为阳极,Pt板 (Pt plate)作为阴极,DMF作为反应溶剂,反应温度为室温,最终获得86%收率的去氢环缩合产物2a。
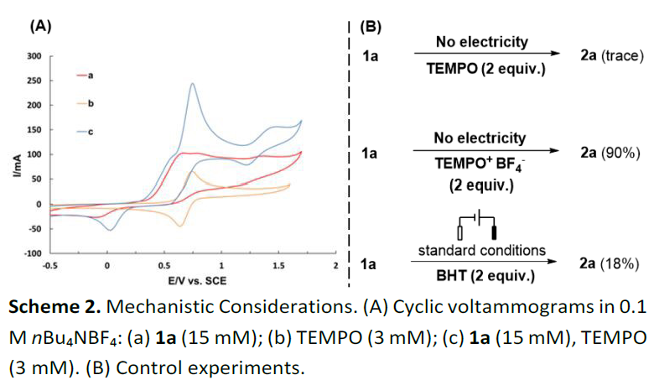
同时,作者通过相关的CV实验 (Scheme 2A)研究表明,上述的电化学去氢环缩合过程中可能涉及TEMPO+中间体的参与。之后,该小组通过一系列控制实验 (Scheme 2B)的相关研究进一步证实,反应过程中涉及自由基中间体的参与。
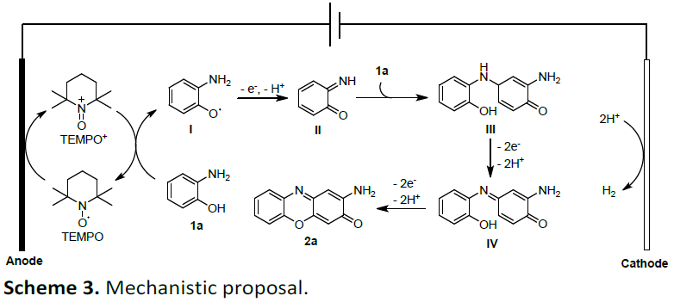
基于上述的实验研究以及前期的文献报道[5],作者提出如下合理的反应机理 (Scheme 3)。
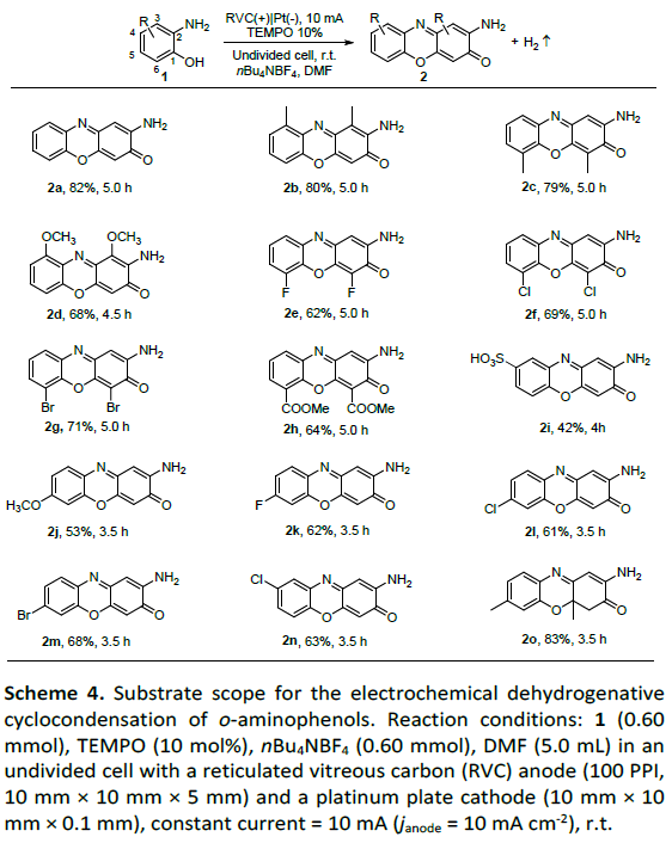
之后,在上述的最佳反应条件下,作者对一系列邻氨基苯酚底物的应用范围进行考察 (Scheme 4)。研究表明,在苯环的C3-或C6-位置带有不同供电子与吸电子基团取代的邻氨基苯酚底物,均能够较好地与上述的标准反应条件兼容,并以中等至良好的反应收率,获得相应的去氢环缩合产物2a–2h。同时,研究发现,上述的最佳反应条件对于在苯环的C4-或C5-位置带有卤素以及磺酸基离去基团的邻氨基苯酚底物以及在苯环的C5-位置具有甲基取代的邻氨基苯酚底物,同样能够有效地兼容。
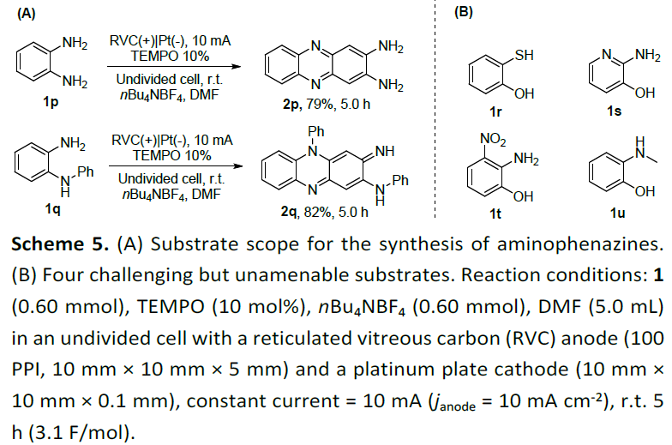
同时,作者进一步研究发现,上述的电化学去氢环缩合策略同样能够有效地应用于邻苯二胺 (1p)以及2-苯基氨基苯胺 (1q)底物 (Scheme 5)。 然而,对于2-氨基苯硫醇(1r)、2-氨基吡啶-3-醇(1s)、2-氨基-3-硝基苯酚(1t)以及2-(甲氨基)苯酚(1u) 底物,则均未能获得预期的目标产物 (ESI, Fig. S3-S6)。
之后,该小组通过如下的实验装置,对于上述的去氢环缩合策略的克级规模反应进行进一步研究,进而表明,这一全新的去氢环缩合策略具有潜在的合成应用价值 (Fig. S7)。
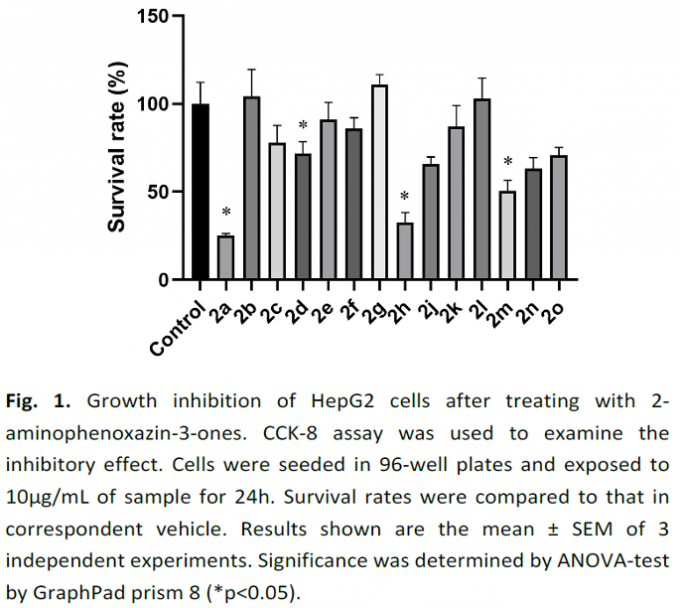
同时,该小组进一步研究发现,通过上述的去氢环缩合策略获得的目标产物2h表现出优良的抗肿瘤活性(Fig. 1)。
总结
温州医科大学的蔡云瑞课题组成功设计出一种全新的采用TEMPO催化剂促进的通过一系列邻氨基苯酚类底物参与的电化学去氢环缩合反应方法学。这一全新的电化学去氢环缩合反应策略具有温和的反应条件、无需选择化学计量的氧化剂以及催化剂廉价易得以及良好的合成应用价值等优势。
参考文献
- [1] S. Y. Jabri, L. E. Overman, J. Am. Chem. Soc. 2013, 135, 4231. doi: 10.1021/ja401423j.
- [2] (a) F. Ferlin, P. M. L. Navarro, Y. Gu, D. Lanari, L. Vaccaro, Green Chem. 2020, 22, 397. doi: 10.1039/C9GC02961C.
- (b) A. Das, S. Goswami, R. Sen, A. Ghosh, Inorg. Chem. 2019, 58, 5787. doi: 10.1021/acs.inorgchem.9b00121.
- (c) A. C. Sousa, M. C. Oliveira, L. O. Martins, M. P. Robalo, Green Chem. 2014, 16, 4127. doi: 10.1039/C4GC00901K.
- [3] (a) S. B. Beil, D. Pollok, S. R. Waldvogel, Angew. Chem. Int. Ed. 2021, 60, 14750. doi: 10.1002/anie.202014544.
- (b) C. Kingston, M. D. Palkowitz, Y. Takahira, J. C. Vantourout, B. K. Peters, Y. Kawamata, P. S. Baran, Acc. Chem. Res.2020, 53, 72. doi: 10.1021/acs.accounts.9b00539.
- (c) F. Wang, S. S. Stahl, Acc. Chem. Res. 2020, 53, 561. doi: 10.1021/acs.accounts.9b00544.
- (d) Y. Jiang, K. Xu, C. Zeng, Chem. Rev. 2018, 118, 4485. doi: 10.1021/acs.chemrev.7b00271.
- [4] (a) R. Francke, R. D. Little, Chem. Soc. Rev. 2014, 43, 2492. doi: 10.1039/C3CS60464K.
- (b) J. C. Siu, N. Fu, S. Lin, Acc. Chem. Res. 2020, 53, 547. doi: 10.1021/acs.accounts.9b00529.
- (c) J. E. Nutting, M. Rafiee, S. S. Stahl, Chem. Rev. 2018, 118, 4834. doi: 10.1021/acs.chemrev.7b00763.
- [5] J. E. Nutting, M. Rafiee, S. S. Stahl, Chem. Rev. 2018, 118, 4834. doi: 10.1021/acs.chemrev.7b00763.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载














No comments yet.