本文作者 杉杉
导读
近日,兰州大学许鹏飞教授在德国应化发表论文,报道了在有机仲胺催化条件下,通过亚甲基环丙烷和α,β-不饱和醛构建较高环张力的螺[2,3]己烷骨架,涉及迈克尔加成反应、亚甲基环丙烷的环扩张、烯胺的亲核进攻等过程。该方法关键之处在于使用缺电子的二氟取代仲胺作为催化剂,同时以具有反应活性的亚甲基环丙烷作为底物。
Highly Enantioselective Construction of Strained Spiro[2,3]hexanes via Michael‐Ring Expansion‐Cyclization Cascade Strategy
Chuan-Gang Zhao, Zhi-Tao Feng, Guo-Qiang Xu, Ang Gao, Jing-Wei Chen, Zhu-Yin Wang, Peng-Fei Xu*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.201912834
正文
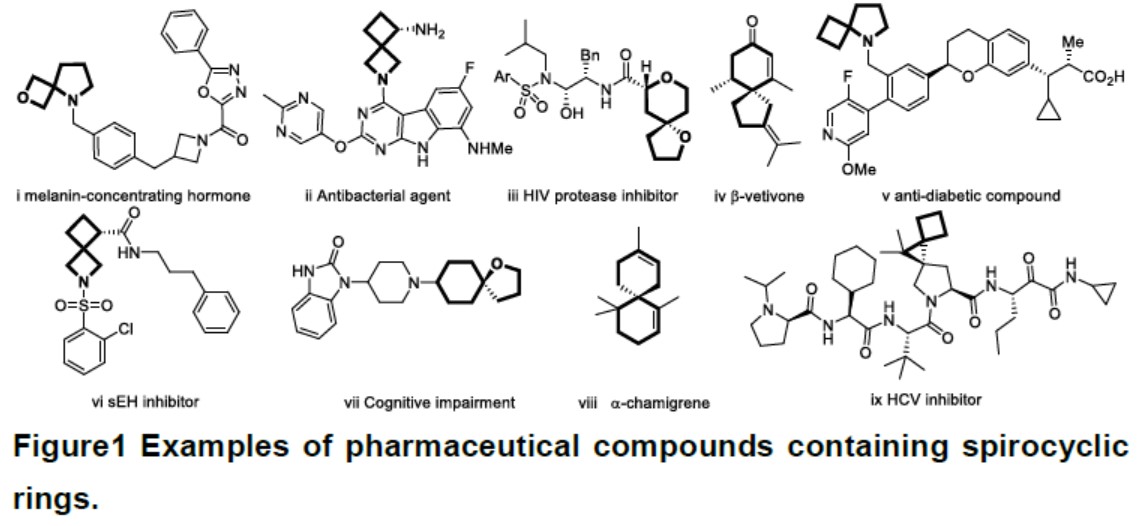
在过去的几年中,螺环烃骨架(尤其是含有环丁烷或环丙烷结构单元)的合成已成为研究的热点,由于该骨架常存在一些具有生物活性天然产物中(Figure 1)。与常见的环状分子相比,螺环化合物在某些方面具有明显的优势:a)螺环的紧密性导致亲脂性降低;b)通过异构化可进一步促进螺环化合物空间的多样化;c)螺环化合物sp3/sp2的比值较高有助于设计新型生物活性分子。一些尚未开发的骨架在生物活性方面具有潜在的价值,使得螺环化合物在药物研发中比普通环状化合物更具吸引力。
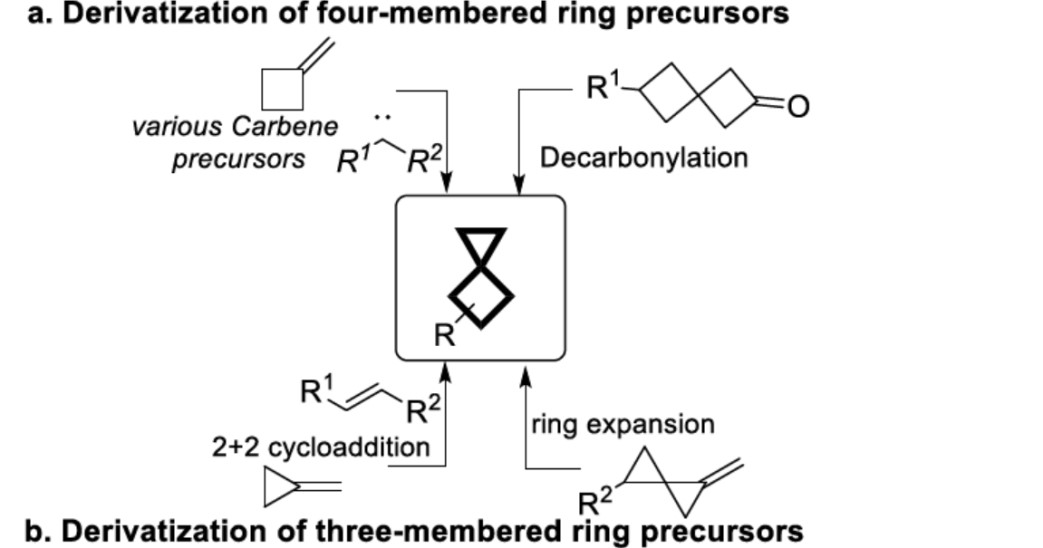
然而,由于常见连接两个相邻环的碳原子为季碳原子,导致合成含有小环的螺环烃骨架更具挑战性。在过去的几年中,一些制备螺环化合物的方案已被报道,特别是含有一个环的中间体。传统上,螺[2,3]己烷的合成仅限于三元或四元环衍生的前体:a)亚甲基环丁烷衍生物的环丙烷化或[3,3]庚-2-酮及其衍生物的脱羰反应(Scheme 1-a)。b)亚甲基环丙烷衍生物的[2+2]环加成或相应螺环前体的扩环(Scheme 1-b)。该类反应起始原料均包含一个小环,且反应后保留。据文献查阅,螺[2,3]己烷衍生物的不对称合成尚未报道。因此,开发一种温和而有效的方法,构建不对称螺[2,3]己烷衍生物,仍作为一项重要的研究课题。
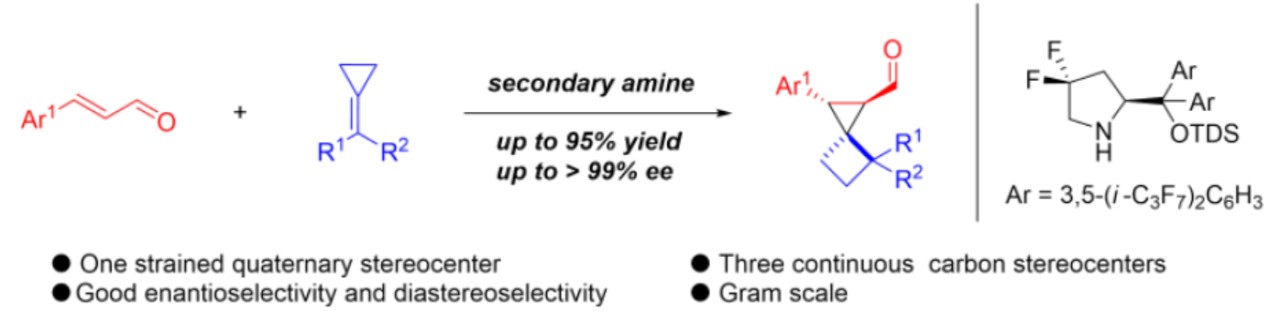
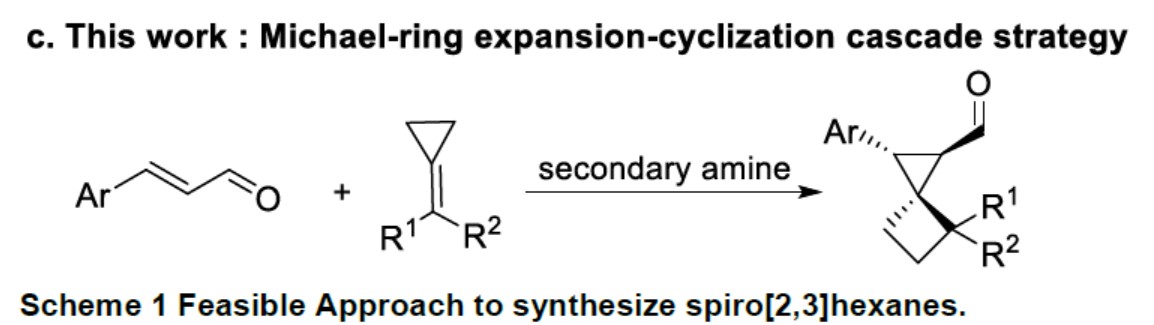
随着有机催化的迅速发展,手性仲胺催化已成为合成手性分子强大的工具之一。基于作者对合成小环化合物的长期研究,作者试图尝试,是否可以通过不对称合成,构建含有小环的螺环化合物。作者设想,二氟取代的仲胺催化剂可产生亚胺离子,可能对该反应起到促进作用。如果烯烃可以使亚胺离子中间体的β-碳原子共轭加成的话,该策略将补充传统亚胺离子催化的亲核试剂库,同时作为一种对映选择性合成螺[2,3]己烷的新型方法(Scheme 1-c)。
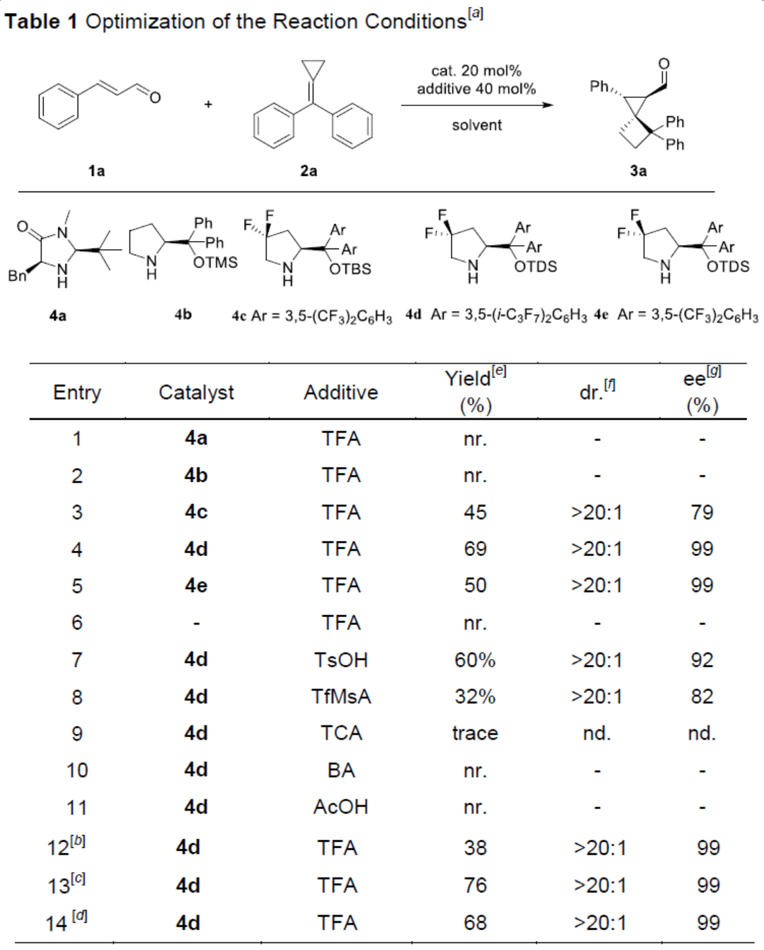
为了验证反应的可行性,作者使用肉桂醛1a和富电子的亚甲基环丙烷2a作为模型底物对反应进行了研究(Table 1)。首先,作者对常用的仲胺手性催化剂进行了筛选(entries 1-5),手性催化剂4a和4b在该系统中均不起作用,而使用含有两个电负性氟原子催化剂4c(为了提高亚胺离子的反应活性)时,以中等收率获得所需的产物3a,同时具有较高的立体选择性。使用具有多位阻和芳烃支架上的全氟异丙基手性胺催化剂4d/4e时,收率和立体选择性均显著提高。此外,在不存在仲胺催化剂的条件下,即使反应36 h仍未检测到任何产物(entry 6),这表明三氟乙酸作为唯一的催化剂时,不能使反应顺利进行。为了获得更高的收率,作者试图使用一些添加剂(在亚胺离子的构建中起重要作用)(entries 7-11),反应结果表明,添加剂三氟乙酸效果最佳。而对反应温度的进一步研究表明,提高温度可获得更好的结果(entry 13),但是,将温度升至50 ℃会导致某些原料分解,因此导致收率略有下降(entry14)。
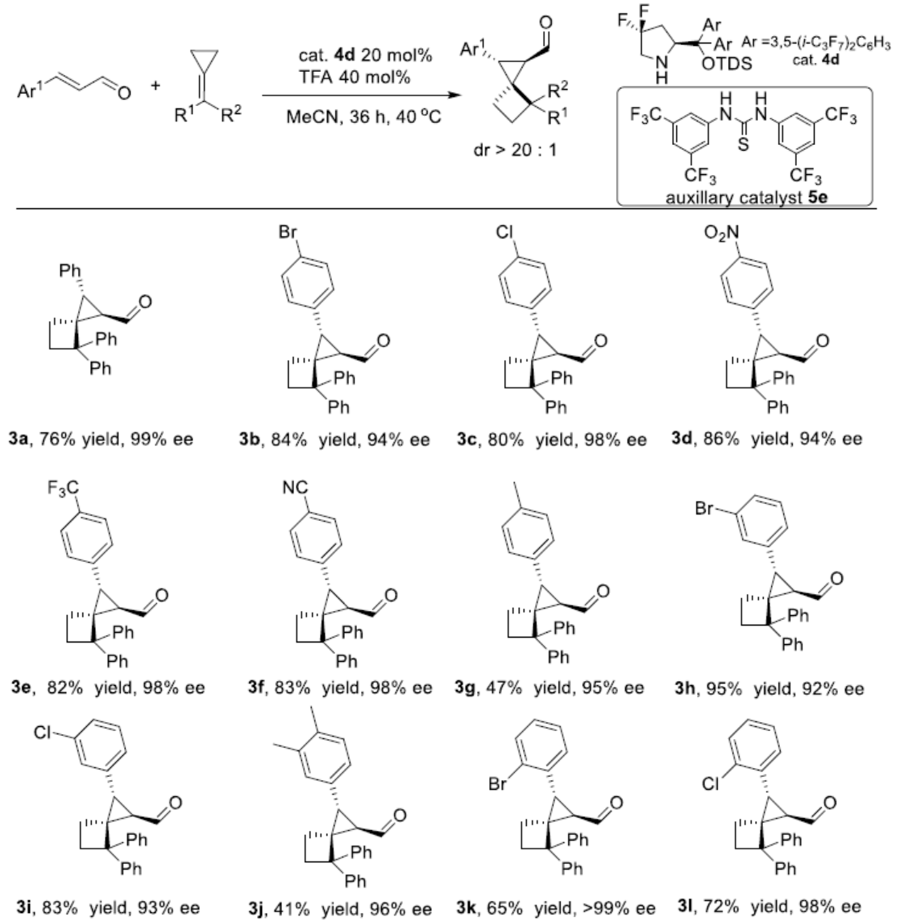
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Scheme 2)。首先,作者对α,β-不饱和醛进行研究(3a–3n)。当α,β-不饱和醛的苯基对位含有吸电子基团,如卤化物(3b–3c)、硝基(3d)、三氟甲基(3e)和氰基(3f),均与体系兼容,获得相应的产物。而当α,β-不饱和醛的苯基含有给电子基团时(3g, 3j),也可获得高ee的螺环产物,但收率有所降低。该结果说明,亚胺离子的活性受电子效应影响。而将芳基取代改为萘基时,也获得相应的产物3m–3n。随后,作者对亚甲基环丙烷的底物进行了研究(3o–3t)。考虑到在对位带有溴或氯原子的亚甲基环丙烷在乙腈中具有较差的溶解性,因此改用DCE作为溶剂。然而,底物不能有效地转化为产物(转化率<10%)。但借助助催化剂5时,该反应可产生具有良好对映选择性的产物。反映结果表明,亚甲基环丙烷苯环上带有给电子基(3r、3t)的收率高于含有卤素(3p、3q、3s)的底物。此外,对3a的放大实验依旧可行,以高收率获得螺环化合物,但ee略有下降。
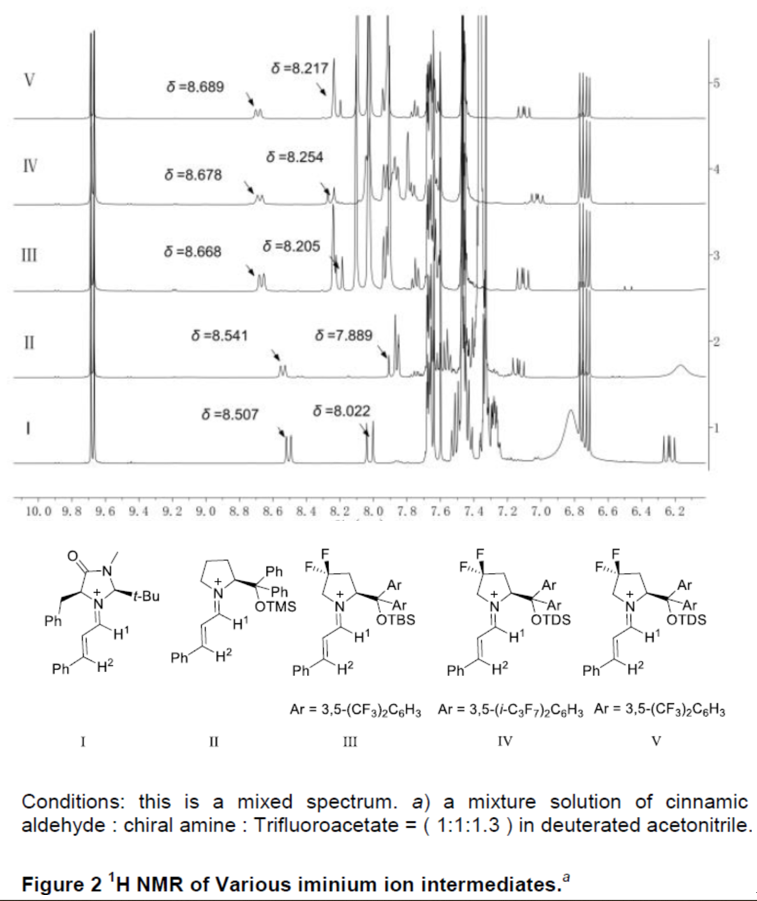
为了确定仲胺催化剂对中间体反应的影响,作者在CD3CN中进行了一些1H NMR实验(Figure 2)。作者发现,在1H NMR中亚胺离子中间体的化学位移明显不同其它几个,中间体III、IV和V中H1和H2的化学位移明显更高。该实验表明二氟取代的亚胺离子中间体具有更高的反应性。
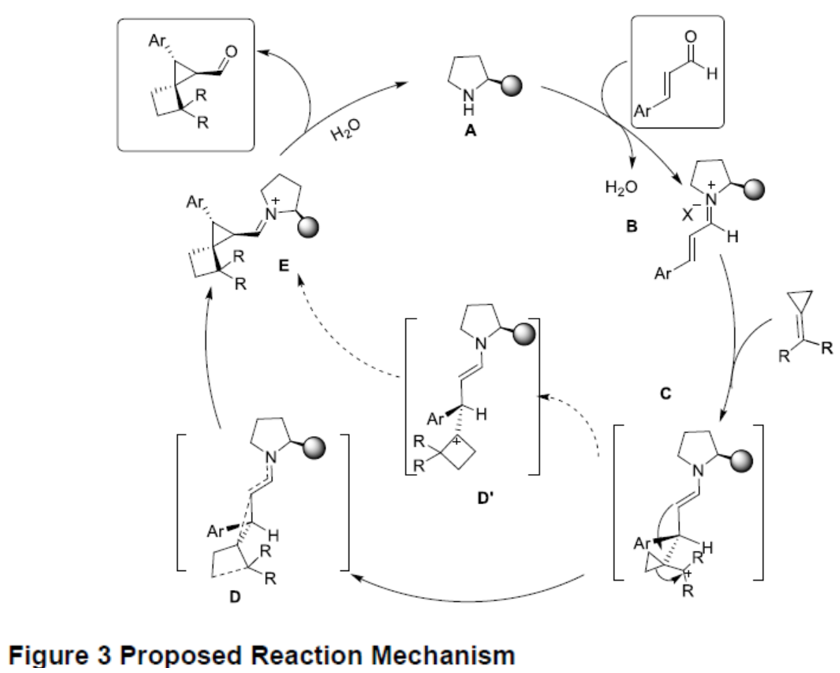
根据上述实验结果和相关文献的查阅,作者提出了一种可能的反应机理(Figure 3)。首先,仲胺与α,β-不饱和醛缩合形成亚胺离子(中间体B),然后亚甲基环丙烷底物与亚胺离子的β位置发生迈克尔加成反应,获得中间体C。随后,中间体C经重排和亲电子加成,使环丙烷扩环形成四元环,同时构建了新的环丙烷,即螺环骨架中间体D。此外,重排和亲电加成过程同时发生,而不是经中间D’的过程。最后,水解中间体E获得产物3。
为了进一步证明该方法的综合适用性,作者对底物进行了一些修饰(Scheme 3)。产物3a可以通过Wittig反应转化为相应的烯烃6,同时保持良好的收率以及对映选择性。产物3a也可以通过LiAlH4还原为相应的醇,所有的环丙烷取代的甲醇和三元环状烯烃衍生物都是有机合成中有用的中间体。此外,与二胺反应,可获得苯并啉衍生物8,同时保持对映选择性。
总结
兰州大学许鹏飞教授报道了,一种高对映选择性合成螺[2,3]己烷衍生物的方法,涉及迈克尔加成反应、环扩张、环加成等串联过程,各种取代的α,β-不饱和醛均可顺利转化为相应的螺环产物,同时保持高非对映和对映选择性。此外,该反应可以很容易地放大,在合成含有复杂骨架产物方面具有较大的应用价值。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.