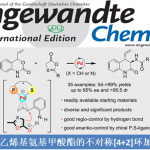
导读
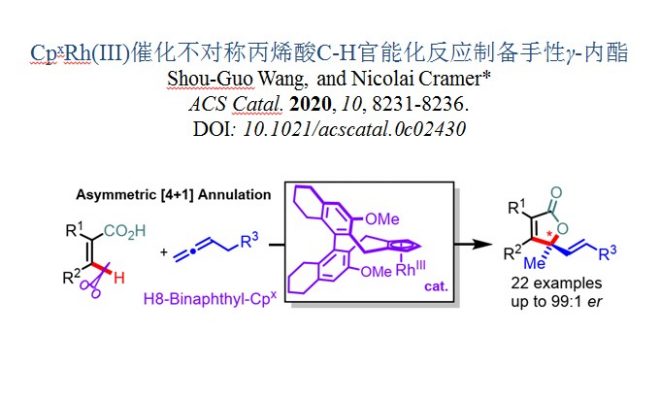
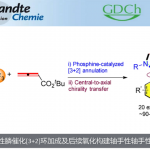
羧酸化合物具有分布广泛、容易获取且价格低廉等优点,作为有机合成中普遍存在的中间体。目前,自由羧酸的直接C-H官能化已引起人们的注意,可以高效直接构筑重要的合成模块。[1]与酰胺或异羟肟酯导向的对映选择性C-H官能化相比,游离羧酸的反应发展相对较少。2013年,Wang和Yu报道了一例不对称的钯(II)催化芳基乙酸乳糖化反应,通过酸诱导芳香C(sp2)-H活化策略制备手性苯并呋喃酮。[2]之后,Yu等发展了钯催化酸导向环丙烷或环丁烷羧酸的对映选择性C(sp3)-H活化/交叉偶联反应。[3]尽管如此,游离羧酸的高效对映选择性C-H官能化的研究尚存在巨大挑战。从可用性和实用性的角度出发,丙烯酸的使用是非常吸引人的,但其在C-H官能化中可作为受体烯烃且经常容易聚合,因此应用具有极大挑战性。基于挑战烯基不对称C-H键官能化的研究兴趣,并受到Cheng发展的丙烯酸定向RhIII-官能化反应的启发,[4]洛桑联邦理工学院Nicolai Cramer课题组利用手性CpxRhIII配合物作为催化剂,实现丙烯酸的对映选择性烯基C-H官能化反应(图1)。相关成果发表于:
“Asymmetric CpxRh(III)-Catalyzed Acrylic Acid C-H Functionalization with Allenes Provides Chiral γ-Lactones”
Shou-Guo Wang, and Nicolai Cramer* ACS Catal. 2020, 10, 8231-8236.DOI: 10.1021/acscatal.0c02430
图1.羧酸导向的C-H功能化反应
论文概要
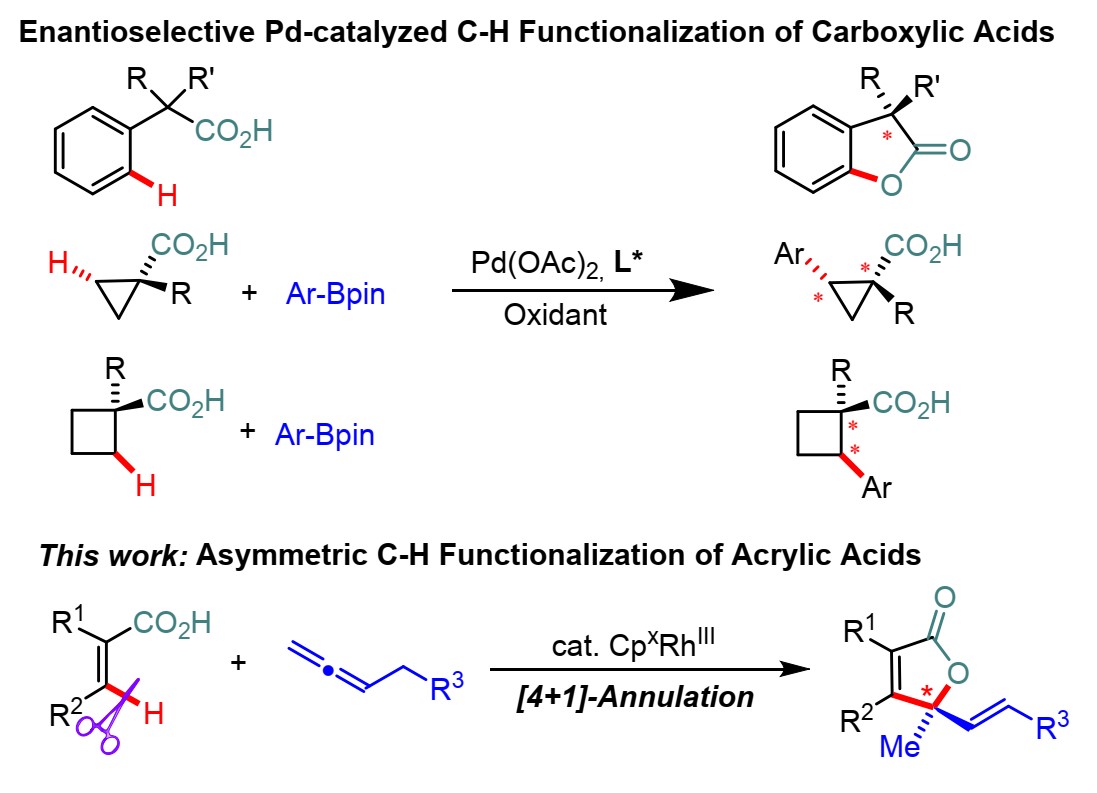
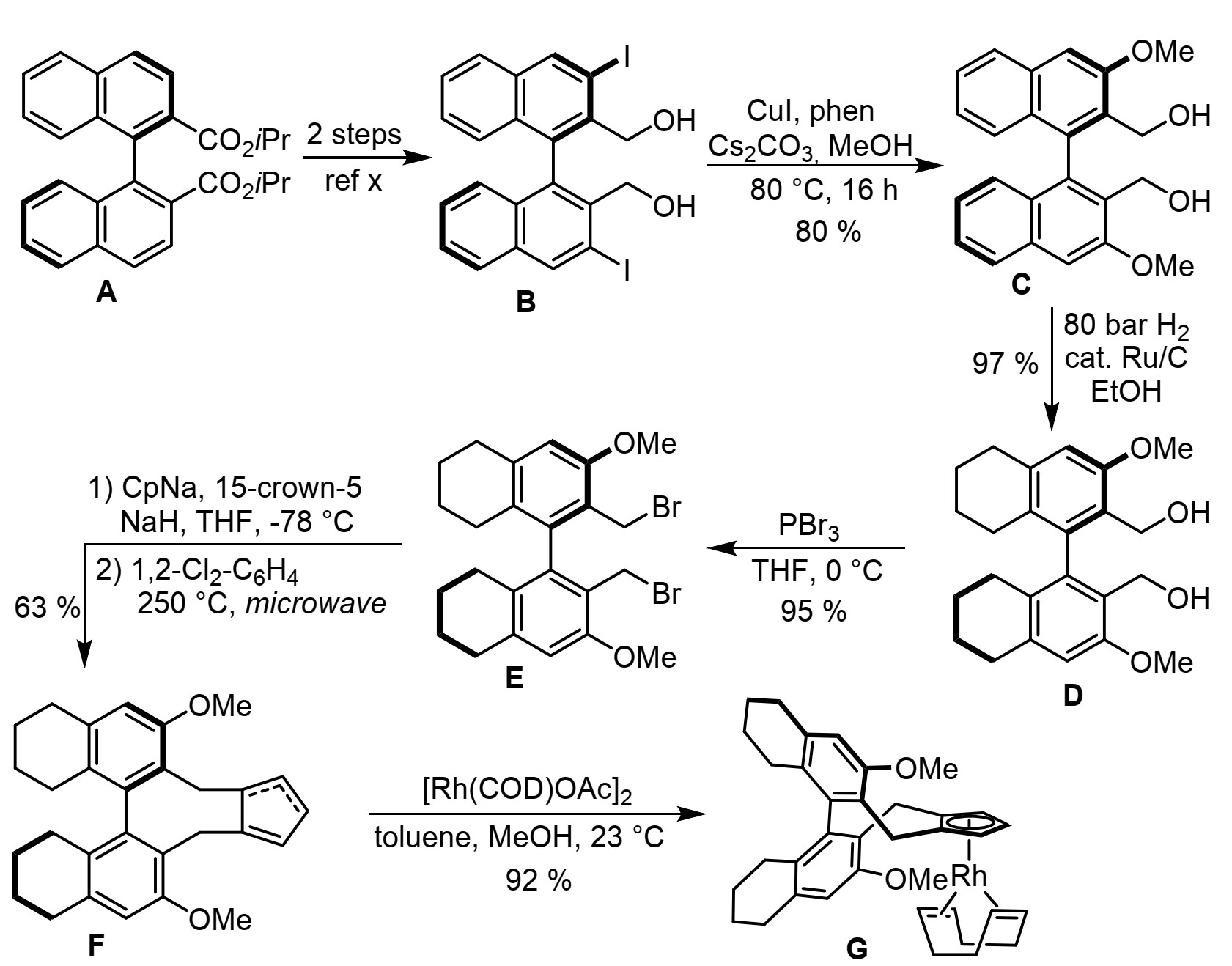
在CpxRhIII催化中,发展功能强大的手性Cp配体(Cpx)具有重要意义。作者基于新型联萘轴手性Cp配体,发展了具有不同骨架和选择性的高效配体。与联萘骨架配体相比,手性半饱和H8联萘类似物具有不同的构象刚度、几何结构和二面角,作者发展了新型具有刚性轴手性H8联萘骨架Cpx配体,应用于不对称丙烯酸C-H官能化反应中。
图2.配体的制备
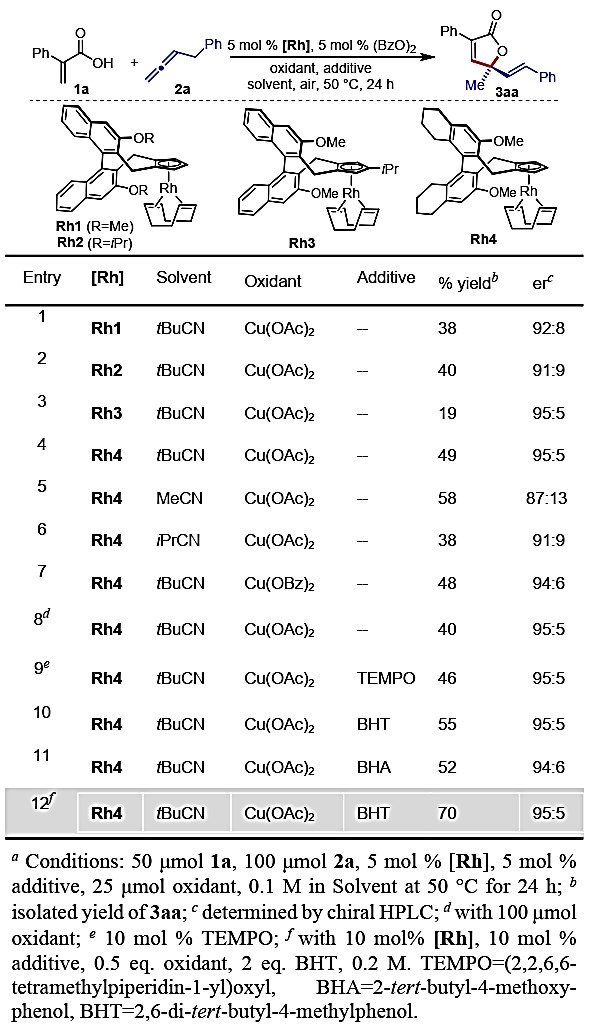
作者首先进行了条件筛选,用2-苯丙烯酸(1a)和苄烯(2a)为底物,实现[4+1]环化反应。作者使用具有甲氧基联萘衍生的Cpx为配体,过氧苯甲酰作为氧化剂,tBuCN为溶剂,Cu(OAc)2中作为终端氧化剂,以38%的收率和92:8的er值得到目标内酯3aa(表1, entry 1)。
表1.条件筛选
随着配体骨架上的取代基体积增大,即使用-OiPr取代的Cpx配体(Rh2)时,得到基本相似的反应结果(entry 2)。当使用Rh3作为催化剂时,Cpx配体的改变显著影响了反应的不对称诱导,尽管收率只有19%,但以95:5 的er值得到3aa(entry 3)。当作者使用具有手性H8-联萘-Cpx配体的Rh4作为催化剂时,反应表现出很好的选择性,对收率和对映选择性均有较大提高,以49%的收率以及95:5的er值得到目标产物3aa(entry 4)。通过对不同腈类溶剂的筛选,发现tBuCN具有最好的反应结果(entry 4-6)。作者发现乙腈作为溶剂时,反应收率较高(58%),但仅为87:13 er(entry 5),认为腈类溶剂对反应有重要作用。不同的铜氧化剂对该反应的收率和对映选择性影响不大(entry 7)。增加Cu(OAc)2至两倍当量时,反应收率降低,仅为40%(entry 8)。之后,作者对不同的添加剂(TEMPO,BHA和BHT)进行了筛选(entry 9-11),发现当使用BHT作为添加剂时,提高了γ-内酯3aa的收率,同时仍保持优良的对映选择性(entry 11)。作者进一步增加催化剂用量和提高反应浓度,能够极大的提高反应的收率同时保持95:5 er(entry 12)。最终作者确定以10 mol% 的Rh4作为催化剂、(BzO)2作为氧化剂、 Cu(OAc)2作为终端氧化剂、BHT为添加剂、tBuCN 为溶剂作为最优反应条件。
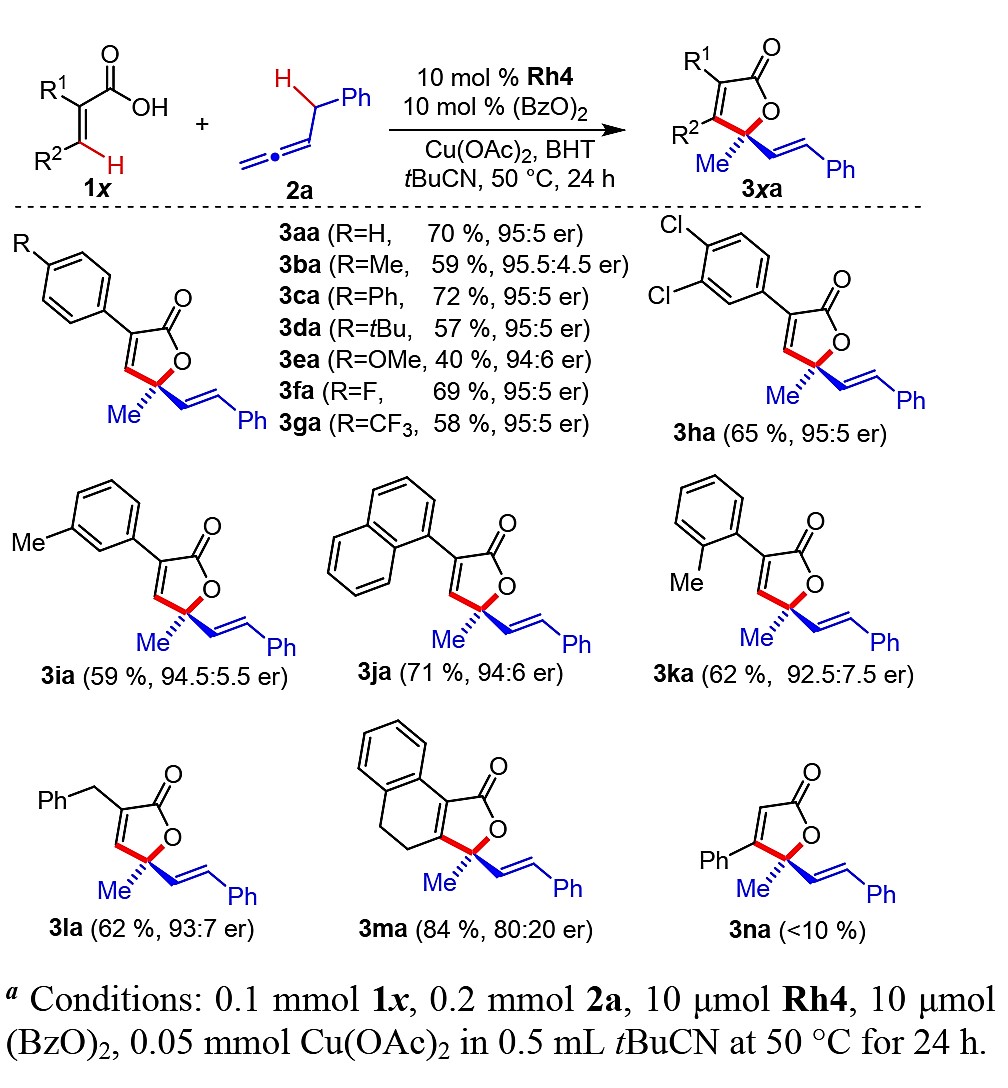
在获得上述最优反应条件后,作者对该[4+1]环化反应中的丙烯酸进行了底物拓展研究(图3)。首先对丙烯酸的α位上R1的不同取代芳基进行了拓展。在芳环上具有给电子或吸电子取代基均能很好的适应该反应,以中等至良好的收率(40-72%)和良好的对映选择性(94:6-95.5:4.5 er)与苄基烯2a生成γ-内酯产物3aa-3ha。具有不同位阻的芳基取代基,如1-萘基和邻甲苯基均表现出良好的良好的收率和对映选择性,在该[4+1]环化反应中得到相应产品3ja(71%,94:6 er)和3ka(62%,92.5:7.5er)。苄基取代底物1l可以生成内酯3la(62%, 93:7er)。此外,2,3-二取代丙烯酸1m也可发生反应,得到具有较高收率但是对映选择性略有下降的环内酯3ma(62%,93:7er)。然而,肉桂酸类底物的反应性较差,这表明在丙烯酸的α位上有一个取代基对反应起到重要的促进作用。
图3不同取代的丙烯酸底物拓展
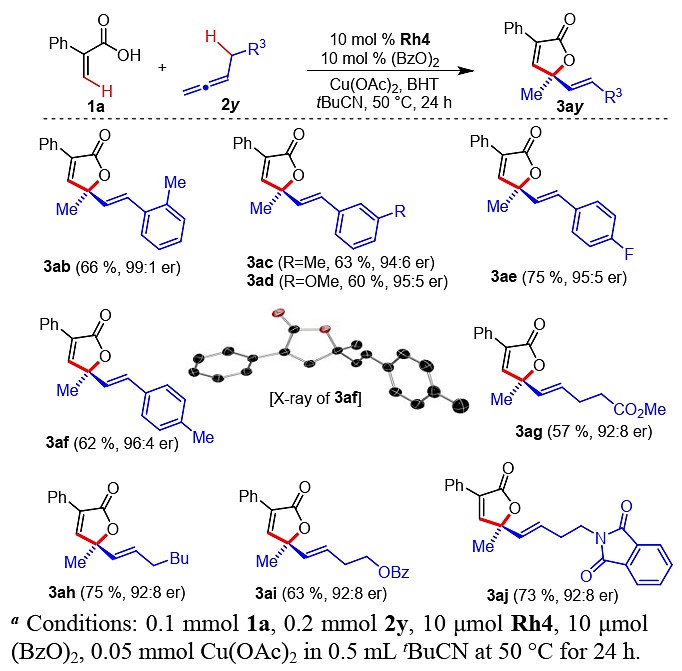
作者也对不同取代的联烯进行了底物拓展(图4)。一系列具有不同电性和位阻的取代芳基均能适应该反应,能以良好的收率(60-75%)和优良的对映选择性(94:6-99:1 er)得到内酯3ab-3af。值得注意的是,邻甲基苄基联烯2b可得到具有高对映选择性的内酯3ab(99:1 er)。其他非芳基的脂肪族取代底物均适用于该[4+1]环化反应,表明产物中的共轭烯烃不是整个转换所需的驱动力。此外,其他各种各样的取代基,如酯类和邻苯二甲酰胺类也具有较好的耐受性,均能得到良好的目标内酯3ag-3aj。
图4不同取代的联烯底物拓展
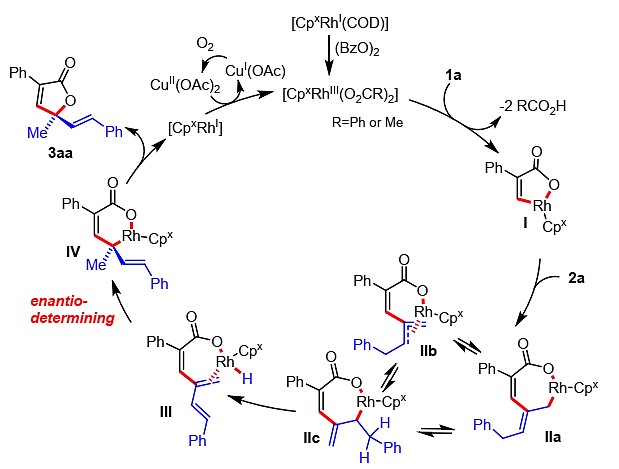
作者提出了该丙烯酸类化合物不对称C-H活化反应的催化循环(图5)。首先CpxRhI经(BzO)2氧化形成活性CpxRhII配合物,再与底物1a进行配体交换,经CMD型定向烯基C-H活化形成五元结构I。紧接着,2a插入得到中间体IIa–IIc,经β-氢消除生成三烯中间体III。随后,生成中间体IV(对映选择性的决定步)。最后,经还原消除后产生内酯3aa并产生CpxRhI物种(经Cu(OAc)2氧化,形成CpxRhII参与下一个催化循环,CuII由氧气氧化再生)。
图5可能的催化循环
论文总结评价
洛桑联邦理工学院Nicolai Cramer课题组发展了一种新型的半饱和H8联萘骨架Cpx配体。与现有的联萘衍生Cpx配体相比,作者新开发的手性半饱和H8联萘骨架Cpx配体与其相应的CpxRh配合物具有优异的催化性能,可以挑战酸C-H键官能化。在本工作中,利用手性CpxRhIII配合物作为催化剂,实现了丙烯酸的对映选择性烯基C-H官能化反应,通过[4+1]环化反应以高达99:1 er的对映选择性得到不饱和γ-内酯。
参考文献
- [1] C. Sambiagio, D. Schönbauer, R. Blieck, T. Dao-Huy, G. Pototschnig, P. Schaaf, T. Wiesinger, M. F. Zia, J. Wencel-Delord, T. Besset, B. U. W. Maes, M. A Schnürch, Chem. Soc. Rev. 2018, 47, 6603-6743. DOI: 10.1039/C8CS00201K
- [2] X.-F. Cheng, Y. Li, Y.-M. Su, F. Yin, J.-Y. Wang, J. Sheng, H. U. Vora, X.-S. Wang, J.-Q. Yu, J. Am. Chem. Soc. 2013, 135, 1236-1239. DOI: 10.1021/ja311259x
- [3] P.-X. Shen, L. Hu, Q. Shao, K. Hong, J.-Q. Yu, J. Am. Chem. Soc. 2018, 140, 6545-6549. DOI: 10.1021/jacs.8b03509
- [4] P. Gandeepan, P. Rajamalli, C.-H. Cheng, Chem. Eur. J. 2015, 21, 9198-9203. DOI: 10.1002/chem.201501106
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.