译自Chem-Station网站日本版 原文链接:ベックマン開裂 Beckmann Fragmentation
翻译:炸鸡 校对:JiaoJiao
概要
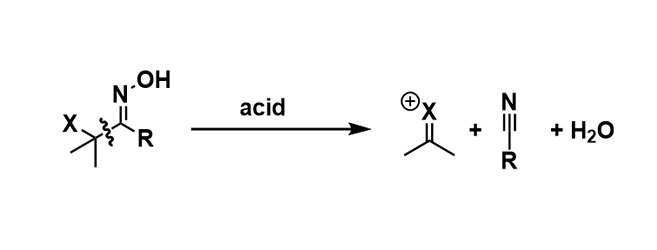
贝克曼重排反应是由酮肟的N-O键断裂引发的阳离子重排反应。但是当酮肟的α位的取代基能很好地稳定碳正离子时,腈基(C≡N)会倾向于与碳正离子分裂,而不是发生贝克曼重排。我们把这种反应称为贝克曼裂解反应(Beckmann Fragmentation)。碳正离子可以发生E1消去反应或被亲核试剂捕捉的一系列转化反应。
基本文献
- Beckmann, E. Dtsch. Chem. Ges. 1886, 19, 988. doi:10.1002/cber.188601901222
- Wallach, O. Justus Liebigs Ann. Chem.1890, 259, 309. doi:1002/jlac.18902590211
- Wallach, O. Justus Liebigs Ann. Chem.1899, 309, 1. doi:1002/jlac.18993090102
- Werner, A.; Piguet, A. 1904, 37, 4295. doi:10.1002/cber.19040370407
- Werner, A.; Detscheff, T. 1905, 38, 69. doi:10.1002/cber.19050380109
- Schroeter, G. Dtsch. Chem. Ges.1911, 44, 1201. doi:10.1002/cber.19110440205
- Brown, R. F.; van Gulick, N. M. .; Schmid, G. H. Am. Chem. Soc.1955, 77, 1094. doi:10.1021/ja01610a005
- Ferris, A. F. Org. Chem.1960, 25, 12. doi:10.1021/jo01071a003
<Review>
- Grob, C. A.; Schiess, P. W. Chem. Int. Ed. Engl.1967, 6, 1. doi:10.1002/anie.196700011
- Grob, C. A. Chem. Int. Ed. Engl.1969, 8, 535. doi:10.1002/anie.196905351
- Gawley, R. E. React.1988, 35, 14. doi:10.1002/0471264180.or035.01
- Drahl, M. A.; Manpadi, M.; Williams, L. J. Chem. Int. Ed.2013, 52, 11222. doi:10.1002/anie.201209833
发现历史
1886年贝克曼裂解反应首次作为贝克曼重排反应的副反应被报道。1890年O. Wallach提出贝克曼裂解反应发生的最佳反应条件。
反应机理
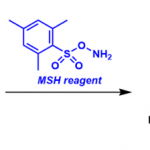
酮肟的α位有叔碳或是杂原子(O, S, N)时,α-碳正离子能够被稳定,从而促进裂解反应的进行。如果β位有硅原子或锡原子,优先考虑贝克曼裂解。如果重排反应会使产物的分子结构发生扭曲变形产生张力(热力学不利),那么将会优先发生贝克曼裂解反应。
反应案例
碳正离子中间体的捕获
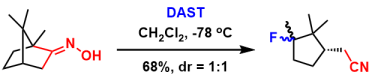
三氟化二乙基氨基硫(DAST)产生氟阴离子捕获碳正离子[1]
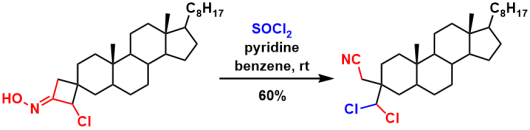
氯捕获碳正离子[2]
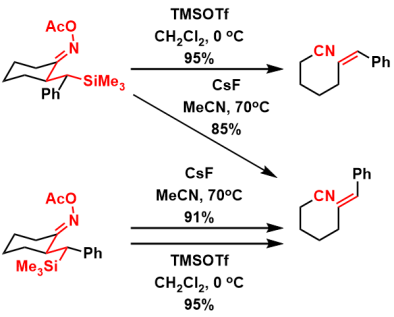
碳正离子被路易斯碱集合,并随后与有机金属试剂反应[3]
硅和锡的导向型贝克曼裂解反应
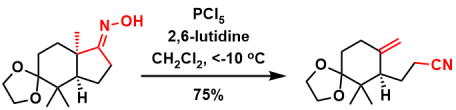
β位有硅基团导向的贝克曼裂解[4]
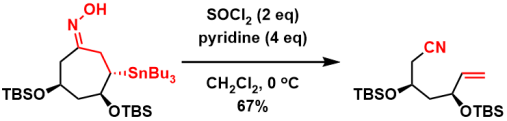
β位有锡基团的贝克曼裂解[5]
在全合成领域的应用
(±)-byssochlamic acid的合成[6]
(+/-)-modhephene的合成[7]:α位的氧原子促进裂解
(−)-elegansidiol的合成[8]
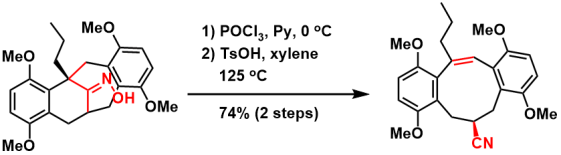
昆虫信息素的合成[9]:硅基团导向的贝克曼裂解反应
参考文献
- Kirihara, M.; Niimi, K.; Momose, T. Commun.1997, 6, 599. doi:10.1039/a607749h
- Błaszczyk, K.; Koenig, H.; Mel, K.; Paryzek, Z. Tetrahedron2006, 62, 1069. doi:1016/j.tet.2005.11.005
- (a) Fujioka, H.; Matsumoto, N.; Ohta, R.; Yamakawa, M.; Shimizu, N.; Kimura, T.; Murai, K. Tetrahedron Lett.2015, 56, 2656. doi:1016/j.tetlet.2015.03.089 (b) Fujioka, H.; Matsumoto, N.; Kuboki, Y.; Mitsukane, H.; Ohta, R.; Kimura, T.; Murai, K. Chem. Pharm. Bull. 2016, 64, 718. doi:10.1248/cpb.c16-00006
- Nishiyama, H.; Sakuta, K.; Osaka, N.; Arai, H.; Matsumoto, M.; Itoh, K. Tetrahedron1988, 44, 2413. doi:1016/S0040-4020(01)81693-8
- Bakale, R. P.; Scialdone, M. A.; Johnson, C. R. Am. Chem. Soc.1990, 112, 6729. doi:10.1021/ja00174a053
- Stork, G.; Tabak, J. M.; Blount, J. F. Am. Chem. Soc.1972, 94, 4735. doi:10.1021/ja00768a055
- Laxmisha, M. S.; Subba Rao, G. S. R. Tetrahedron Lett.2000, 41, 3759. doi:1016/S0040-4039(00)00486-X
- Cao, L.; Sun, J.; Wang, X.; Zhu, R.; Shi, H.; Hu, Y. Tetrahedron2007, 63, 5036. doi:1016/j.tet.2007.03.123
- Nishiyama, H.; Sakuta, K.; Itoh, K. Tetrahedron Lett.1984, 25, 223. doi:1016/S0040-4039(00)99845-9
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


























No comments yet.