本文作者:杉杉
导读
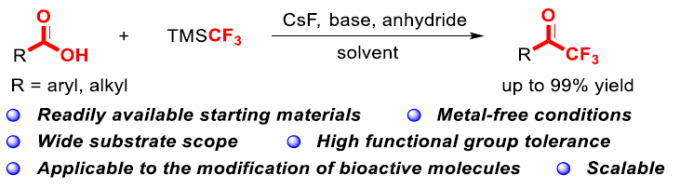
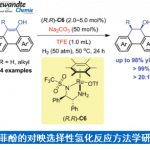
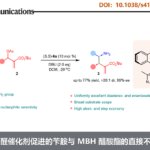
近日,海南大学的陈铁桥教授课题组在Org. Lett.中发表论文,报道一种高效并通用的苯甲酸与TMSCF3之间的直接三氟甲基化反应方法学。同时,作者通过对具有羧酸结构单元的生物活性分子直接修饰的研究,进一步阐明这一策略的合成应用价值。此外,这一全新的三氟甲基化策略具有实验操作简洁、反应条件温和、原料易得以及底物应用范围广泛等优势。
Trifluoromethylation of Benzoic Acids: An Access to Aryl Trifluoromethyl Ketones
X. Liu, L. Liu, T. Huang, J. Zhang, Z. Tang, C. Li, T. Chen, Org. Lett. 2021, 23, 4930. doi: 10.1021/acs.orglett.1c01720.
正文
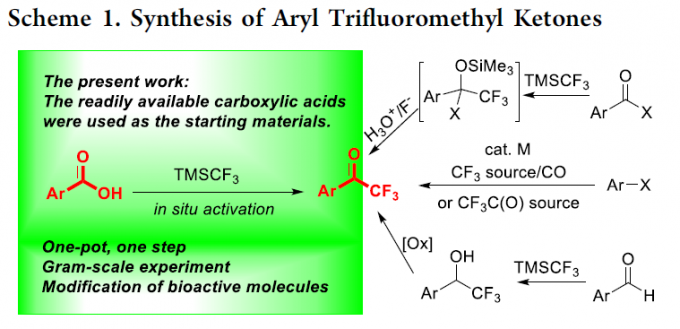
氟原子的引入是化学科学、材料科学以及生物科学中用于增强或改变功能性有机分子物理与化学性能的重要策略之一。根据相关的文献报道,约20%的药物分子以及30%的农药分子中存在氟原子的取代。同时,三氟甲基酮作为重要的有机氟化合物,除具有较好的亲脂性与代谢稳定性之外,同样具有较强的吸电子特性,并能够形成较为稳定的水合物。而且,三氟甲基酮类化合物表现出的上述特殊性能,目前已经广泛应用于药物分子的设计与研发。并且,由于其羰基官能团表现出的多重反应活性,三氟甲基酮类化合物同样能够作为构建其它含氟功能有机分子的重要砌块。通常,通过芳基金属试剂 (Li或Mg)与三氟乙酰基衍生物之间的亲核取代反应策略,能够较好地完成一系列三氟甲基酮分子的合成[1]。然而,由于其较为苛刻的反应条件,进而使上述策略的进一步应用受到限制。同时,研究表明,采用富电子芳基底物参与的Friedel-Crafts酰化反应方法学[2],则存在底物应用范围较为有限以及缺乏良好的区域选择性控制等问题。因此,有机合成化学家致力于发展一系列更为有效的反应策略,实现三氟甲基酮分子的高效制备 (Scheme 1) [3]。目前,已经成功开发出采用过渡金属催化的芳卤或芳香拟卤代物参与的三氟乙酰化反应方法学,并进一步应用于三氟甲基酮类化合物的制备[4]。同时,通过α-三氟甲醇的氧化反应方法学,同样能够实现相应三氟甲基酮类化合物的合成[5],然而,在这一策略中,需要选择较不稳定的醛作为起始原料,进行相应醇底物的预先合成。并且,反应过程中通常需要选择超化学计量 (overstoichiometric)的特殊氧化剂。为有效解决上述策略中存在的诸多局限,这里,本文将报道一种苯甲酸与TMSCF3之间的三氟甲基化反应方法学,进而以良好至优良的反应收率,获得一系列相应的芳基三氟甲基酮类分子 (Scheme 1)。并且,这一全新的三氟甲基化策略具有实验操作简洁、反应条件温和、原料易得以及底物应用范围广泛等优势。
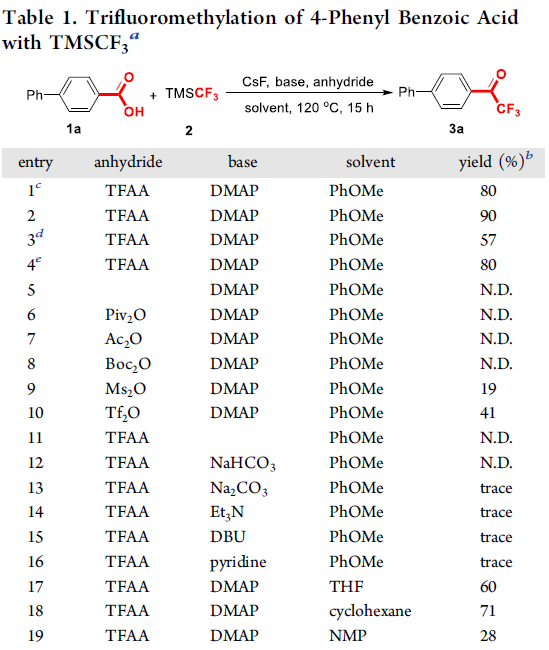
首先,作者采用4-苯基苯甲酸1a与TMSCF3作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用DMAP作为碱,苯甲醚作为反应溶剂,同时加入TFAA与CsF,在反应温度为120℃的条件下进行反应,最终获得90%收率的目标产物3a。
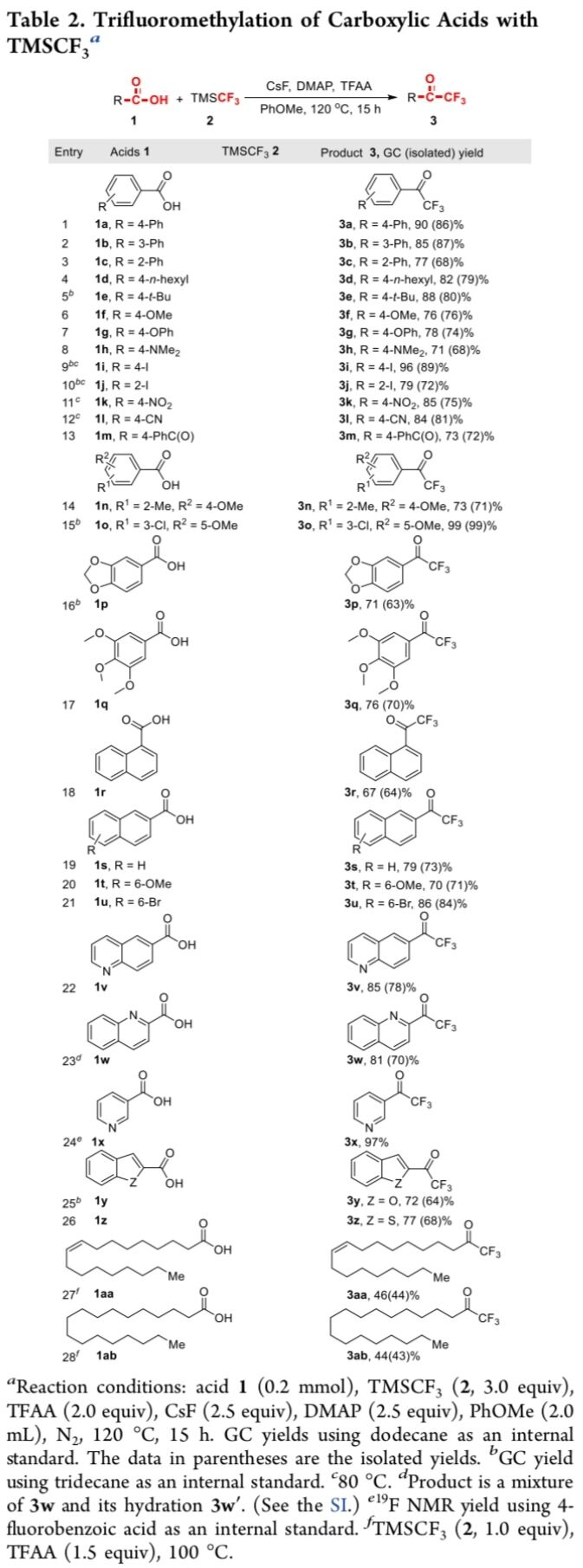
在获得上述的最佳反应条件之后,作者开始对羧酸底物的应用范围进行考察 (Table 2)。研究表明,苯环中具有不同吸电子与供电子基团取代的苯甲酸底物,均能够顺利地参与上述的三氟甲基化过程,并获得相应的目标产物3a–3q。同时,作者发现,上述对标准反应条件对于萘甲酸与多环芳香羧酸以及杂环芳香羧酸底物,同样能够有效地兼容,并获得相应的三氟甲基化产物3r–3z。此外,作者进一步发现,上述的三氟甲基化策略同样能够应用于各类脂肪族羧酸底物,并获得相应的三氟甲基酮产物3aa与3ab,然而,却表现出反应收率的显著降低,可能源自于羰基碳的电子密度相对较高,因而,不利于后续亲核加成步骤的进行。
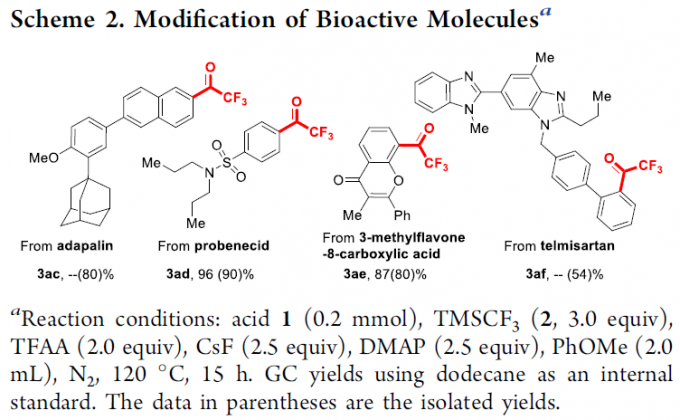
为进一步阐明这一策略的合成实用性,作者发现,采用上述的三氟甲基化条件,能够成功地对一系列具有生物活性的羧酸分子进行直接修饰,并获得相应的三氟甲基酮产物 (Scheme 2)。例如,用于皮肤病治疗的临床药物adapalin,在上述的标准反应条件下,能够较为容易地进行相应的三氟甲基化过程,并以80%的收率获得相应目标产物3ac。而作为抗痛风药物 (antigout drug)以及抗生素佐剂 (antibiotic adjuvant)的probenecid分子,在这一全新的三氟甲基化反应条件下,能够以90%的收率获得相应的三氟甲基酮产物3ad。之后,作者发现,将用于冠心病临床治疗的药物分子3-甲基黄酮-8-羧酸应用于上述的三氟甲基化反应时,能够以80%的收率,获得相应的目标产物3ae。同时,作者进一步发现,抗高血压药物telmisartan在上述的标准反应条件下,同样能够以54%的反应收率,获得相应的三氟甲基化产物3af。
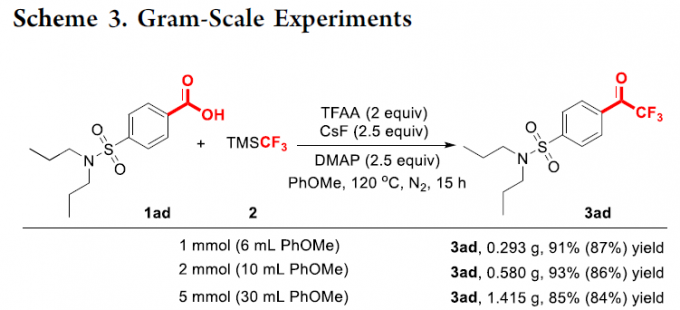
接下来,作者进行一系列克级规模实验的研究 (Scheme 3)。该小组发现,采用probenecid 1ad作为模型底物,在上述的标准反应条件下,分别进行1mmol、2mmol以及5 mmol规模的反应实验。研究发现,通过一系列相关的实验后处理操作之后,选择硅胶柱色谱进行分离,均能够获得较高收率的三氟甲基化产物3ad,进而表明,这一全新的三氟甲基化反应方法学具有良好的合成应用价值。
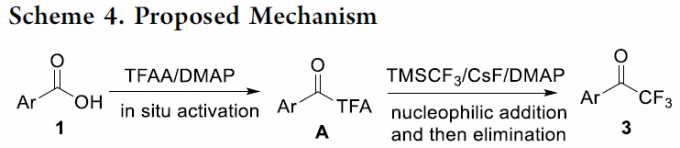
最后,根据前期的文献报道[6]-[9],作者提出一种合理的反应机理 (Scheme 4)。首先,羧酸1通过TFAA的原位活化,形成混合酸酐A。之后,在CsF与 DMAP的辅助下,混合酸酐A 与TMSCF3经历亲核加成-消除过程,形成相应的三氟甲基酮产物3。
总结
海南大学陈铁桥教授课题组报道一种环境友好的,并通过廉价易得的羧酸作为起始原料进行的三氟甲基化反应方法学,并成功完成一系列三氟甲基酮分子的构建。这一全新的三氟甲基化策略具有实验操作简洁、反应条件温和、原料易得、底物应用范围广泛以及优良的官能团兼容性等优势。此外,该小组通过对一系列具有良好生物活性的羧酸分子的直接修饰以及后续克级规模实验的研究,进一步阐明这一全新的三氟甲基化策略具有良好的合成应用前景。
参考文献
[1] (a) R. J. Andrew, J. M. Mellor, Tetrahedron 2000, 56, 7261. doi: 10.1016/S0040-4020(00)00597-4.(b) L. Zhu, Z. Miao, C. Sheng, J. Yao, C. Zhuang, W. Zhang, J. Fluorine Chem. 2010, 131, 800. doi: 10.1016/j.jfluchem.2010.04.002.
(c) B. Heinz, D. Djukanovic, M. A. Ganiek, B. Martin, B. Schenkel, P. Knochel, Org. Lett. 2020, 22, 493. doi: 10.1021/acs.orglett.9b04254.
[2] (a) A. Andicsová-Eckstein, E. Kozma, Z. Puterová-Tokárová, D. Végh, J. Fluorine Chem. 2015, 180, 272. doi: 10.1016/j.jfluchem.2015.10.011.(b) R. A. Wolf, Org. Process Res. Dev. 2008, 12, 23. doi: 10.1021/op700199p.
(c) S. Yao, Z. Ren, Y. Wang, Z. Guan, J. Org. Chem. 2016, 81, 4226. doi: 10.1021/acs.joc.6b00580.
(d) W. Wang, W. Xiong, J. Wang, Q. Wang, W. Yang, J. Org. Chem. 2020, 85, 4398. doi: 10.1021/acs.joc.0c00116.
(e) Y. Hua, J. Chen, H. Yang, M. Wang, J. Org. Chem. 2018, 83, 1160. doi: 10.1021/acs.joc.7b02599.
(f) F. Rahmani, A. Darehkordi, Synthesis 2018, 50, 2124. doi: 10.1055/s-0037-1609433.
[3] (a) C. B. Kelly, M. A. Mercadante, N. E. Leadbeater, Chem. Commun. 2013, 49, 11133. doi: 10.1039/C3CC46266H.(b) W. Wu, Z. Weng, Synthesis 2018, 50, 1958. doi: 10.1055/s-0036-1591971.
(c) K. Funabiki, A. Hayakawa, T. Inuzuka, Org. Biomol. Chem. 2018, 16, 913. doi: 10.1039/C7OB02862H.
(d) H. Cheng, Y. Pei, F. Leng, J. Li, A. Liang, D. Zou, Y. Wu, Y. Wu, Tetrahedron Lett. 2013, 54, 4483. doi: 10.1016/j.tetlet.2013.06.045.
[4] (a) M. B. Johansen, O. R. Gedde, T. S. Mayer, T. Skrydstrup, Org. Lett. 2020, 22, 4068. doi: 10.1021/acs.orglett.0c01117.(b) K. Funabiki, A. Hayakawa, T. Inuzuka, Org. Biomol. Chem. 2018, 16, 913. doi: 10.1039/C7OB02862H.
(c) F. Zhu, G. Yang, S. Zhou, X. Wu, RSC Adv. 2016, 6, 57070. doi: 10.1039/C6RA12287F.
(d) K. Domino, M. B. Johansen, K. Daasbjerg, T. Skrydstrup, Organometallics 2020, 39, 688. doi: 10.1021/acs.organomet.9b00849.
(e) X. Yi, Y. Cao, X. Wang, H. Xu, S. Ban, H. Dai, Tetrahedron Lett. 2020, 61, 151780. doi: 10.1016/j.tetlet.2020.151780.
(f) W. Wu, Q. Tian, T. Chen, Z. Weng, Chem. – Eur. J. 2016, 22, 16455. doi: 10.1002/chem.201604300.
[5] (a) Y. Kadoh, M. Tashiro, K. Oisaki, M. Kanai, Adv. Synth. Catal. 2015, 357, 2193. doi: 10.1002/adsc.201500131.(b) S. A. Miller, K. A. Bisset, N. E. Leadbeater, N. Eddy, Eur. J. Org. Chem. 2019, 1413. doi: 10.1002/ejoc.201801718.
(c) C. B. Kelly, M. A. Mercadante, T. A. Hamlin, M. H. Fletcher, N. E. Leadbeater,Org. Chem.2012,77, 8131. doi: 10.1021/jo301477s.
(d) Y. Tanaka, T. Ishihara, T. Konno, J. Fluorine Chem. 2012, 137, 99. doi: 10.1016/j.jfluchem.2012.03.002.
(e) M. Kirihara, K.Suzuki, K. Nakakura, K. Saito, R. Nakamura, K. Tujimoto, Y. Sakamoto, Y. Kikkawa, H. Shimazu, Y. Kimura, J. Fluorine Chem. 2021, 243, 109719. doi: 10.1016/j.jfluchem.2020.109719.
[6] (a) J. Boivin, L. E. Kaim, S. Z. Zard, Tetrahedron 1995, 51, 2573. doi: 10.1016/0040-4020(95)00006-T.(b) Y. Chang, C. Cai, J. Fluorine Chem. 2005, 126, 937. doi: 10.1016/j.jfluchem.2005.04.012.
(c) M. M. Kremlev, A. I. Mushta, W. Tyrra, D. Naumann, H. T. M. Fischer, Y. L. Yagupolskii, J. Fluorine Chem. 2007, 128, 1385. doi: 10.1016/j.jfluchem.2007.06.009.
[7] (a) Z. Han, S. Chen, Y. Tu, X. Lian, G. Li, Eur. J. Org. Chem. 2019, 4658. doi: 10.1002/ejoc.201900250.(b) N. Allendörfer, M. Es-Sayed, M. Nieger, S. Bräse, Tetrahedron Lett. 2012, 53,388 doi:10.1016/j.tetlet.2011.11.014.
(c) R. P. Singh, G. Cao, R. L. Kirchmeier, J. M. Shreeve, J. Org. Chem. 1999, 64, 2873. doi: 10.1021/jo982494c.
(d) J. B. Geri, M. M. W. Wolfe, N. K. Szymczak, Angew. Chem. Int. Ed. 2018, 57, 1381. doi: 10.1002/anie.201711316.
[8] D. M. Rudzinski, C. B. Kelly, N. E. Leadbeater, Chem. Commun. 2012, 48, 9610. doi: 10.1039/C2CC35037H. [9] (a) C. Liu, Z. Qin, C. Ji, X. Hong, M. Szostak, Chem. Sci. 2019, 10, 5736. doi: 10.1039/C9SC00892F.(b) Z. Li, L. Liu, K. Xu, T. Huang, X. Li, B. Song, T. Chen, Org. Lett. 2020, 22, 5517. doi: 10.1021/acs.orglett.0c01869.
(c) C. Liu, C. Ji, T. Zhou, X. Hong, M. Szostak, Angew. Chem. Int. Ed. 2021, 60, 10690. doi: 10.1002/anie.202100949.
(d) X. Qiu, P. Wang, D. Wang, M. Wang, Y. Yuan, Z. Shi, Angew. Chem. Int. Ed. 2019, 58, 1504. doi: 10.1002/anie.201813182.
(e) C. Liu, C. Ji, X. Hong, M. Szostak, Angew. Chem. Int. Ed. 2018, 57, 16721. doi: 10.1002/anie.201810145.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.