本文作者:孙苏赟
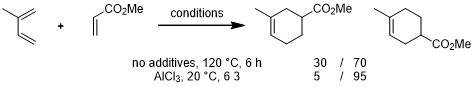
极化作用会对DA反应产生影响的,例如使用不同极性的溶剂,以及在反应中使用Lewis酸添加剂。相比起没有Lewis酸添加剂的情况,添加Lewis酸后可以提高反应的立体化学选择性和区域选择性,例如丙烯酸衍生物的反应[1]:
但是后续的报道显示MeAlCl2对于Z-烯烃的效果更好[2]:
几乎所有的Lewis酸在DA反应中的主要作用,都是和亲双烯体底物形成盐加合物而降低亲双烯体的LUMO来使得反应以更高的选择性发生。以最简单的质子化的丙烯醛为例:
以上质子化的丙烯醛可以看出,质子降低了其LUMO和HOMO的能量,并且HOMO可以有和双键相反的极性,LUMO会有更大的极化能力。
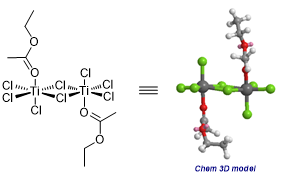
此外Lewis酸还有提高反应选择性的效果,这里值得一提的是Lewis酸络合物的结构。对于羰基化合物来说,Lewis酸结合位点是氧原子,因此有两种可能的构型:和大取代基处于顺式或是反式,一般来说由于位阻因素Lewis酸和大取代基都是处于反式构型的。硼Lewis酸一般形成的是四面体结构,而对于Ti(IV),Sn(IV)等Lewis酸常见的是四面体,双三角锥或八面体构型,例如[3,4]:
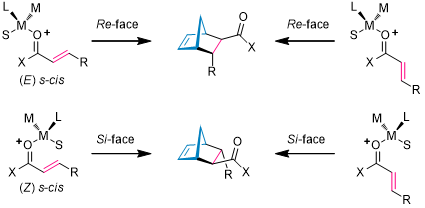
以线性不饱和羰基化合物为例,Lewis酸以影响酯基的构型来控制DA反应的面选择性:
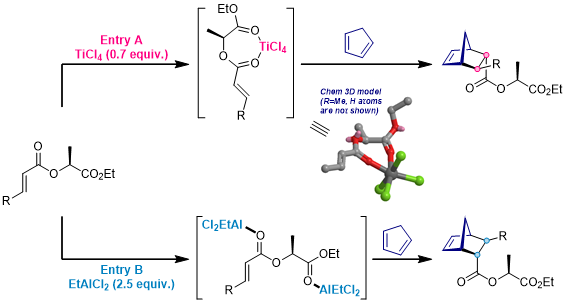
不同配位能力的Lewis酸和双烯体底物产生的配合物是有差别的,并且反应的立体化学结果也是不同的:
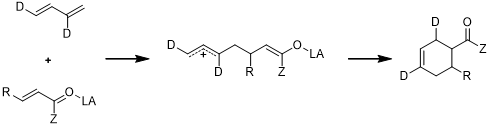
而对于活性很高的Lewis酸配合物,取代基和Lewis酸的双重作用可以提升供体-受体的反应速率,也就是说双烯体上供电取代基和亲双烯体上的吸电取代基可以加快反应速率,甚至在某些情况下可以使得反应成为分步的反应:
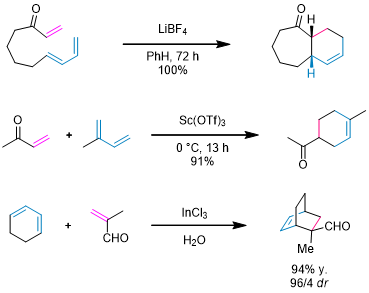
虽然这样的反应不会改变反应的区域选择性,但是反应中的立体化学选择性可能会因为两性离子中间体而下降。这里是常见的Li(I),Sc(III)和In(III)催化的几个例子:
基于以上的背景可见,Diels-Alder反应中使用的Lewis酸是实现不对称反应最有效的方法。
References
- Org. Chem.1966, 31, 4, 1121–1123. DOI:10.1021/jo01342a031
- J.Am. Chem. Soc.1997, 119, 31, 7402–7403. DOI: 10.1021/ja971070h
- Tetrahedron Lett., 1992, 33, 6945. DOI: 1016/S0040-4039(00)60902-4
- Chem. Int. Ed. Engl., 1985, 24, 112. DOI: 10.1002/anie.198501121


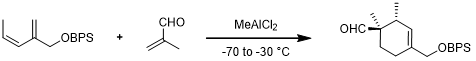
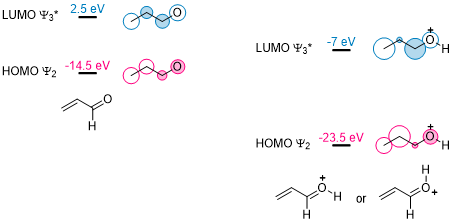
















No comments yet.