本文作者:孙苏赟
第五部分 硼试剂烯和亚胺的反应
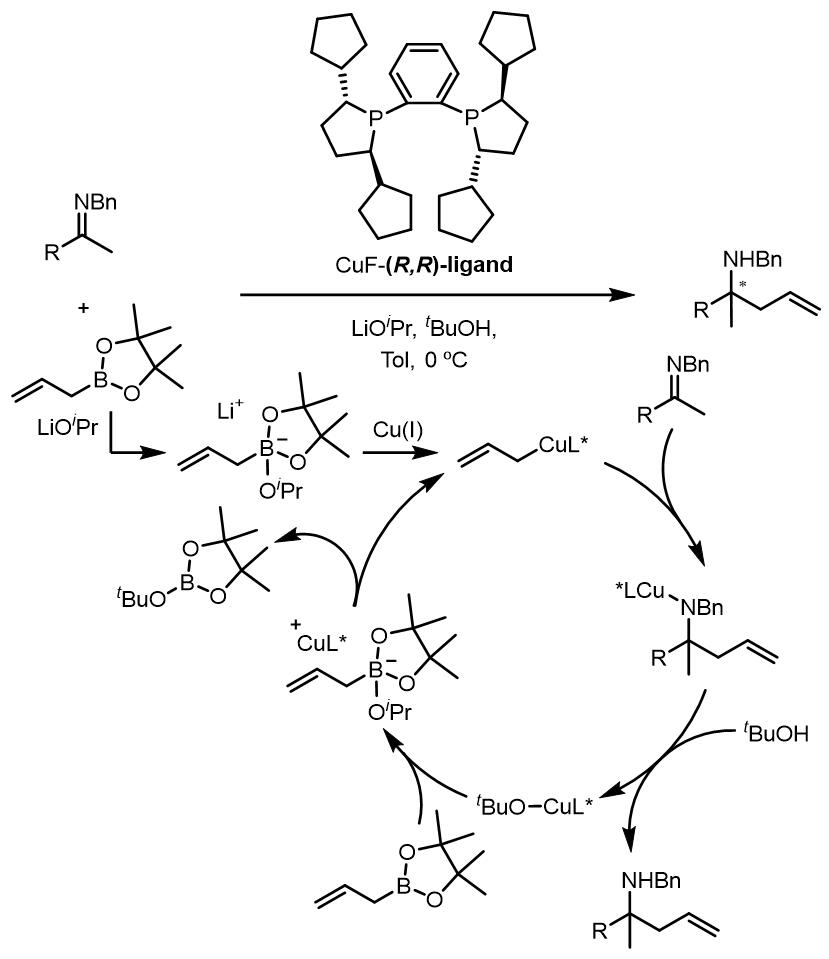
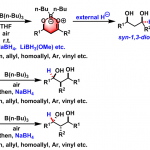
1. Nakai和Shibasaki开发出铜和双齿膦体系,用来高效的催化的亚胺的烯丙基化反应:[1]
2. NHC作为配体参与的Hoveyda-Boron烯丙基化
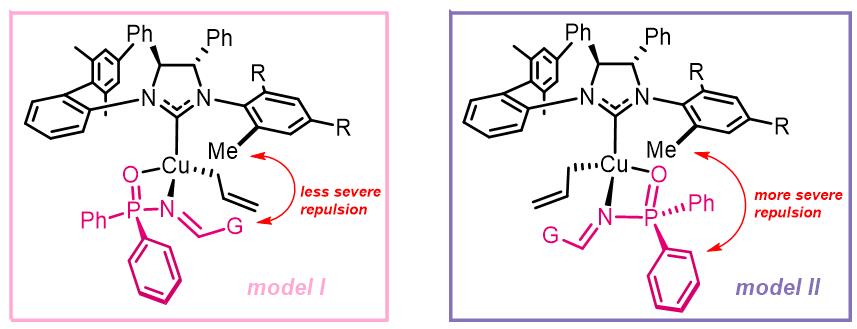
2011年,Hoveyda课题组报道了一种NHC配体和铜催化的膦酰酰胺的烯丙基化反应。从反应底物上来看,芳基、杂环芳基、共轭底物和较少的烷基底物可以得到较高的化学选择性的烯丙基化,对于巴豆基化,反应产率一般,但是非对映异构的选择性却比较差。[2]
从反应的过程上来看,由于磷原子的手性,有两种可能的过渡态,由于位阻的原因是的反应经过第一种模型进行,而立体选择性较好的得到了产物。
反应的机理:
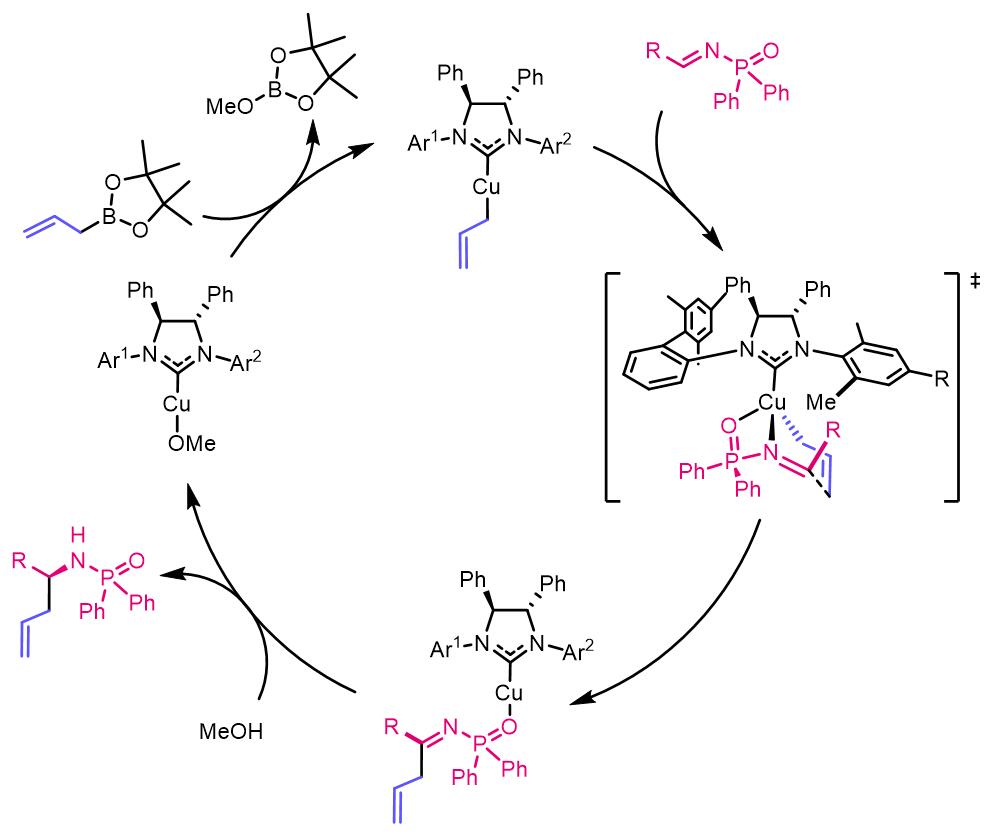
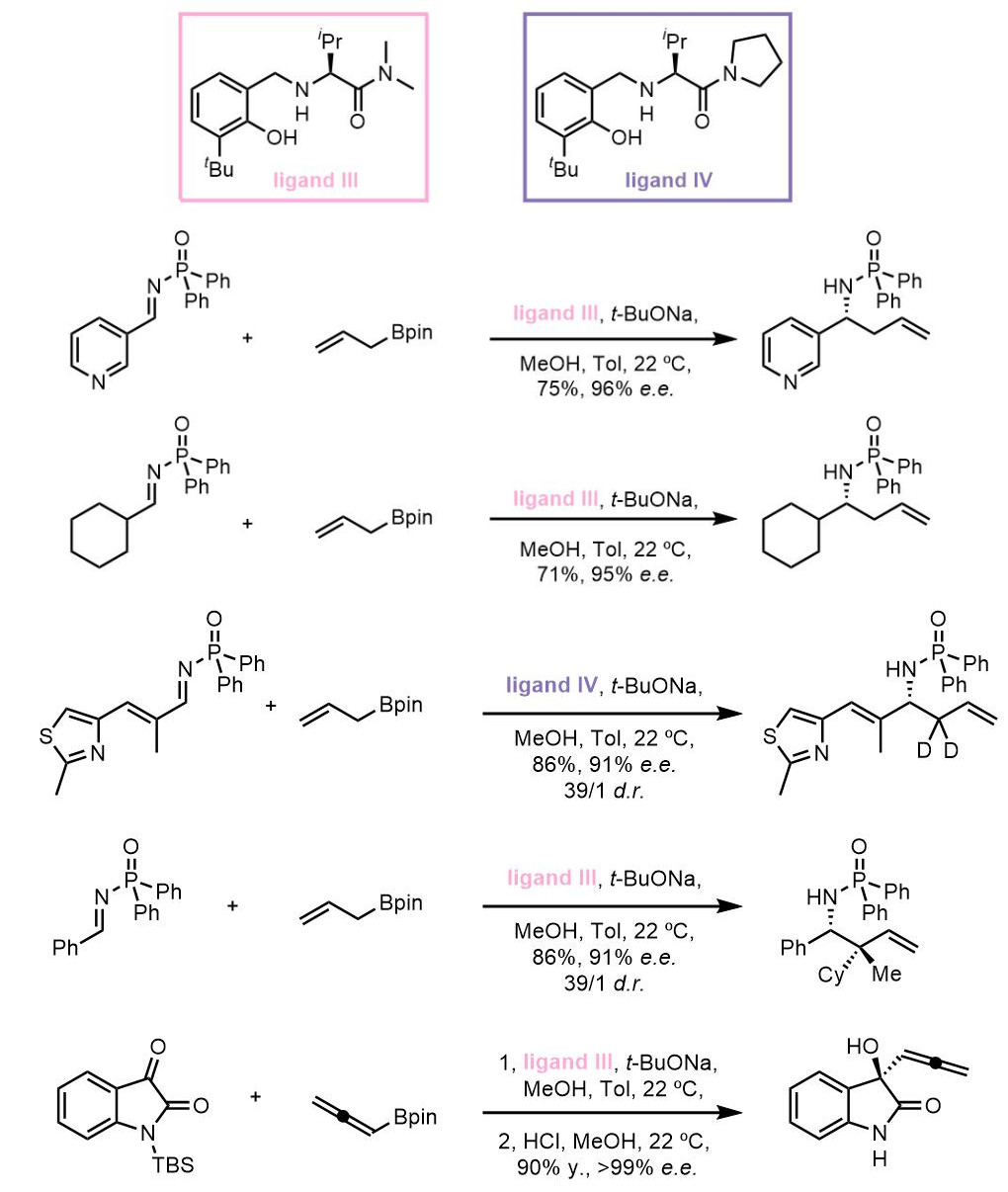
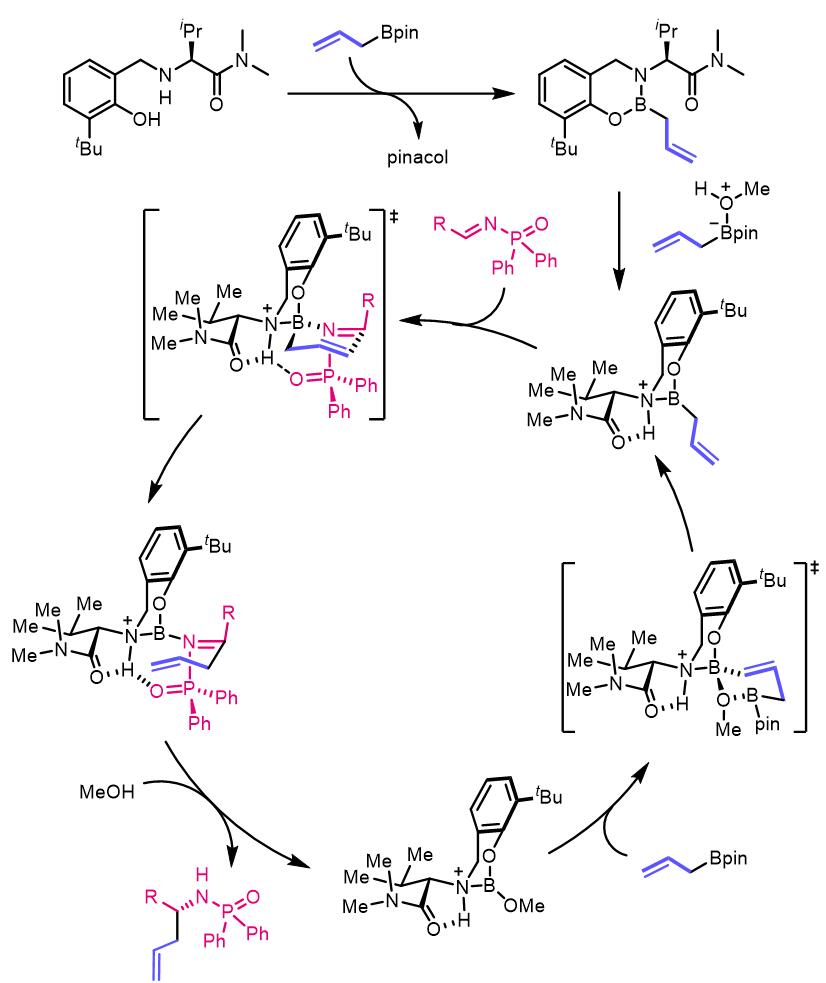
反应的驱动力是生成了更加稳定的硼酸三酯。之后在2013年,他们又推出了氨基酸衍生物作为手性配体的膦酰酰胺的烯丙基化反应:[3]
反应机理:
如果反应体系中没有MeOH,那么转化率从将会非常低。
参考文献
- [1] J. Am. Chem. Soc.2006, 128, 23, 7687-7691. Doi: 10.1021/ja061510h
- [2] J. Am. Chem. Soc.2011, 133, 10, 3332-3335. Doi: 10.1021/ja200311n
- [3] Nature 2013, 494, 216–221. Doi: 1038/nature11844
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.