本文作者:杉杉
导读
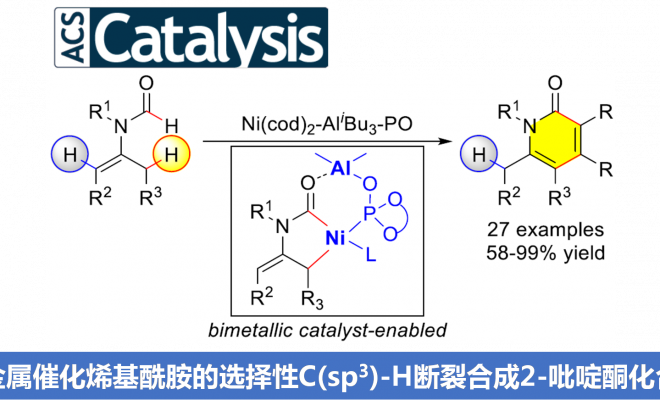
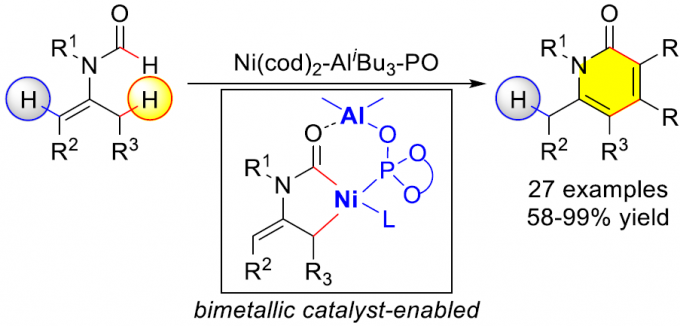
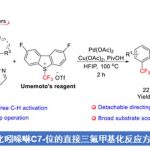
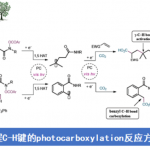
酰基烯胺类化合物(enamide)能够进行导向的C-H键官能团化反应,然而,C-H键官能团化的反应位点主要位于反应活性相对较高的乙烯基C(sp2)-H键,而反应活性较低的β’-C(sp3)-H键的活化方法学却极少有文献报道。近日,南开大学叶萌春课题组在ACS Catalysis发表论文,报道了通过采用双功能膦氧化物(bifunctional phosphine oxide, PO)配体桥联的Ni-Al双金属催化剂,成功实现N-甲酰基烯胺底物的选择性C(sp3)-H断裂,从而以58-99%的收率获得一系列2-吡啶酮衍生物。
Selective C(sp3)-H Cleavage of Enamides for Synthesis of 2-Pyridones via Ligand-Enabled Ni-Al Bimetallic Catalysis
R. Wang, J.Li, Y.Li, S. Qi, T. Zhang, Y. Luan, M. Ye,
ACS Catal.2021, 11, 858. doi: 10.1021/acscatal.0c04585.
正文
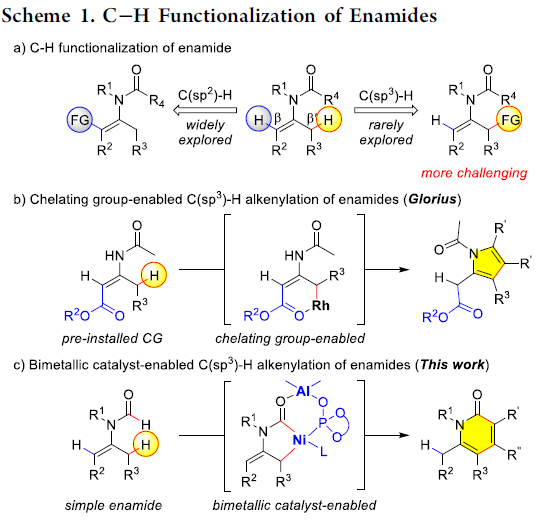
酰基烯胺不仅能够作为有机合成中重要的合成砌块,而且这一结构单元广泛存在于一系列天然产物以及生物活性分子中。由于酰基烯胺分子中官能团结构的多样性,例如存在酰胺官能团以及与其邻近的具有高度极化性的C=C,因而,在过去的几十年中,通过酰基烯胺作为起始原料构建各类含氮有机分子,已有大量文献报道。同时,近年来,采用酰基烯胺底物进行的导向C-H键官能团化方法学由于能够为复杂分子的合成提供一种步骤经济与原子经济的方法,并且无需将底物进行预先活化,因此,一直以来备受关注。目前,已经成功建立起一系列催化C-H官能团化反应,例如芳基化、烯基化、炔基化、烷基化、酰化、磺酰化等。然而,上述反应大多发生在乙烯基C(sp2)-H键位置(Scheme 1a, left)。反之,对于反应活性更低的酰基烯胺β’-C(sp3)-H键活化却少有文献报道(Scheme 1a, right)。2010年,Glorius等[1] 发现通过在酰基烯胺的β-位引入酯基,能够降低π键的电子密度,从而抑制C(sp2)-H键的反应活性,进而促进金属Rh中心活化C(sp3)-H键。通过这一策略,首次完成Rh催化的β’-C(sp3)-H键的环化反应,最终获得一系列吡咯类化合物(Scheme 1b)。这一方法学是酰基烯胺β’-C(sp3)-H键官能化方法学研究的重要进展,然而,在这一策略的设计中,需要预先引入酯基,造成底物合成的难度增加。为解决这一问题,南开大学的叶萌春课题组报道了采用双功能膦氧化物(PO)配体桥联的Ni-Al双金属催化剂,进而成功实现N-甲酰基保护的烯胺的选择性C(sp3)-H环化反应,并以58-99%的收率获得一系列2-吡啶酮衍生物(Scheme 1c )。
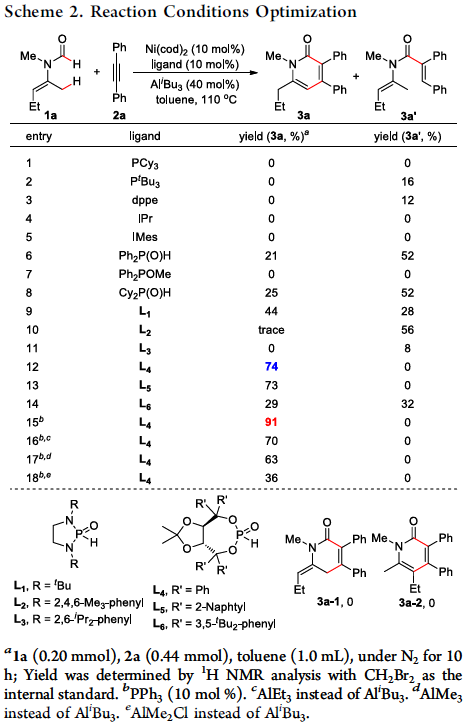
在未引入活化基团情况下,要顺利完成酰基烯胺的区域选择性C(sp3)-H官能团化,较为理想的策略便是选择适宜的N-保护基与催化剂。之前,Nakao与本课题组[2-3]已经研究表明,采用Ni-Al双金属催化剂能够有效地活化一系列N-甲酰基烯胺分子,进而顺利参与C(sp3)-H或C(sp2)-H的环化。受到上述研究的启发,作者选择N-甲酰基烯胺作为反应底物,原因如下:(1)具有Lewis酸性的Al共催化剂能够使酰基烯胺活化,并使乙烯基C-H键的反应活性降低;(2)活性的镍催化中间体由于能够原位形成环状结构,进而获得一定程度的稳定化,并提高C(sp3)-H键活化的催化活性;(3)通过更换不同的配体,可以进一步区分C(sp2)-H/C(sp3)-H键。根据上述设想,作者采用N-甲酰基烯胺1a与二苯乙炔2a作为模型底物,进行相关反应条件的优化筛选(Scheme 2)。实验结果表明,在选择Ni(cod)2与AliBu3作为催化剂,L4作为配体,并加入PPh3,在甲苯溶剂中进行回流,最终获得91%收率的目标产物3a。
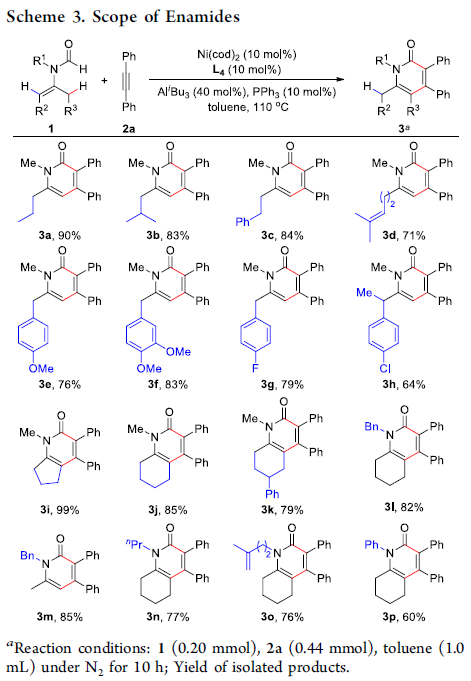
在获得上述最佳反应条件后,作者开始考察酰基烯胺底物1的应用范围(Scheme 3)。研究表明,在酰基烯胺的β-位存在的烷基以及带有供电子基或吸电子基芳基,均能够顺利完成上述反应,并以64-90%的收率获得相应的产物3a–3h。值得注意的是,酰基烯胺分子中存在烯丙基C(sp3)-H键(3d)时,反应位点仍然保持不变,这表明上述反应具有优良的位点选择性。除末端C(sp3)-H键之外,环内的C(sp3)-H键同样能够受到上述双金属催化剂活化,并以良好至优良的反应收率获得预期的2-吡啶酮产物3i–3k。此外,研究发现,具有其他N-烷基保护基的酰基烯胺底物,均能够与上述反应条件良好地兼容,并以76-85%的收率获得相应的产物31–3o。同时,研究发现,N-芳基底物仍然能够良好地兼容(3p),并获得预期的2-吡啶酮产物。然而,由于存在芳基C(sp2)-H键活化的竞争,使反应收率出现降低。
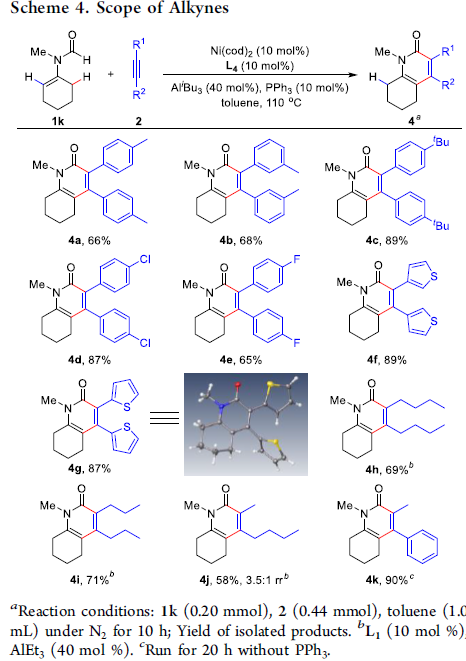
接下来,作者进一步考察炔基底物2的适用范围(Scheme 4)。研究表明,具有各种供电子基团或吸电子基团取代的二芳基炔,均能够与上述反应条件良好地兼容,并以65-89%收率获得相应的产物4a–4e。同时,该小组发现,二杂芳基炔同样可以顺利地完成上述的C(sp3)-H键官能团化反应,进而获得89%与87%收率的产物4f与4g。并且,作者进一步观察到,二烷基炔底物的反应活性较低,随后,该小组对上述反应条件进行进一步改进,实验结果表明,采用二胺衍生的配体L1与立体效应较小的AlEt3结合,能够进一步提高二烷基炔底物的反应活性,并获得较高收率的产物4h–4j。此外,作者同样对非对称炔基底物进行考察,实验发现,非对称二烷基炔底物通常能够获得中等程度的区域选择性(4j)。而非对称烷基芳基炔底物,则能够获得优良的区域选择性(4k)。
总结
南开大学叶萌春课题组报道了通过采用双功能膦氧化物(PO)配体桥联的Ni-Al双金属催化剂,顺利实现各类N-甲酰基烯胺的区域选择性C(sp3)-H键环化反应,并以58-99%的收率获得一系列2-吡啶酮衍生物。同时,研究表明,该方法学具有良好的底物适用范围。而且,双金属催化剂的选择,对于C(sp3)-H活化的区域选择性的控制至关重要。
参考文献
[1] S. Rakshit, F. W. Patureau, F. Glorius, J. Am. Chem. Soc. 2010, 132, 9585. [2] Y. Nakao, E. Morita, H. Idei, T. Hiyama, J. Am. Chem. Soc. 2011, 133, 3264. [3] (a) Y. Wang, F. Zhang, Y. Luan, M. Ye, Org. Lett. 2020, 22, 2230.(b) H. Chen, Y. Wang, Y. Luan, M. Ye, Angew. Chem. Int. Ed. 2020, 59, 9428.

















No comments yet.