氧气是人类赖以生存的气体。也是生物的生合成中必要的元素。氧元素与各种元素结合,变成他们的氧化物。
氧的基本物理性质
| 分类 | 非金属、氧族元素 |
|---|---|
| 原子序号・原子量 | 8 (15.9994) |
| 电子配置 | 2s22p4 |
| 密度 | 1.429kg/m3 |
| 融点 | –218.4℃ |
| 沸点 | –182.96℃ (钻石) |
| 硬度 | — |
| 色・形状 | 无色・气体 |
| 存在度 | 地球 47万4000ppm、宇宙2.38✕107 |
| 克拉克数 | 49.5%(1位) |
| 发现者 | 卡尔·威廉·舍勒(1772年)、约瑟夫·普利斯特里(1774年) |
| 主要的同位素 | 16O(99.757%), 17O(0.038%), 18O (0.205%) |
| 用途例 | 氧化剂、助燃剂、杀菌作用(O3)、氧气罐 |
| 前后的元素 | 氮ー氧ー氟 |
氧气是谁发现的?
氧气是由两个研究者分别发现的,一个人是舍勒(Carl Wilhelm Scheele),瑞典的化学家。
1772年、舍勒发现了氧气gas, 并且阐述了空气中含有「火气」(氧气)。舍勒在他唯一的一部著作《论空气和火的化学》(Chemische Abhandlung von der Luft und dem Feuer)中报道了自己的发现。但这本书被出版商延误,直到1777年才出版。舍勒自己提到过他于1774年给拉瓦锡写过一封信,详细阐述了“火气”的性质,但这封信丢失了,直到1993年才被找到,从而确定了舍勒在1772年就发现了氧气.
在舍勒发现空气后2年,1774年,英国化学家约瑟夫·普利斯特里写了一部名为《几种气体的实验和观察》(Experiments and Observations on Different Kinds of Air)的三卷本的书,于1777年出版。在这部书里他首次详细叙述了氧气的各种性质,但他是从燃素说的角度出发对氧气进行研究的,称它为“脱燃素气体”(dephlogisticated air)。由于他在1774年发现氧气后,很快就发表了论文,这就造成了对氧气的最早发现者的争论。
现在,氧气由这两位大化学家分别发现这个事实已经明了,所以公认为氧气是这两位发现的。
卡尔·威廉·舍勒
1742–1786年 氯,锰,钡等元素的发现者,同时也是草酸,柠檬酸,苯甲酸等有机物质的发现者,然而很多都没有及时公开。
约瑟夫·普利斯特里
1733–1804年 英国化学家、1794移民美国、获得过美国化学会最高奖-科普利奖章
最便宜的氧化剂
氧气可以作为各种物质的氧化剂使用。纸,木头等碳水化合物经过氧气氧化后,生成水与二氧化碳。同时氧气也能与金,铂等稳定的金属反应,形成各自的金属氧化物。
例如,铁生锈的过程就是铁与氧气结合形成了氧化铁。另外,食物在室温下放置一段时间后,味道与颜色都慢慢发生变化,这也是食物渐渐被氧化的一个过程。在工业上,氧气做为最廉价的氧化剂被广泛使用。
氧气的同素异形体:臭氧O3
氧具有两种同素异形体。它们是有两个氧原子结合形成的O2与3个氧原子结合的結合形成的臭氧O3。臭氧具有更强的氧化作用,另外还有杀菌,脱臭的效果。存在于平流层的臭氧被称为臭氧层,可以有效地阻碍紫外线直射到地球表面。

*需要注意的是,高浓度的臭氧具有刺激性臭味,并且是有毒的。同时虽说臭氧具有强力的氧化作用,但是其实起到主要氧化作用的是羟基自由基(·OH)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


























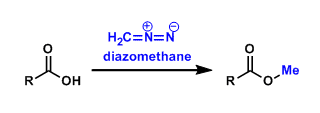

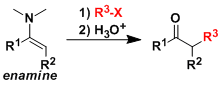
No comments yet.