概要
TERP (Organotellurium-Mediated Living Radical Polymerization)是可逆的惰性自由基聚合(≈living radical polymerization)的一种。
自由基聚合反应中由于自由基末端的互相结合与拔氢后的或者拔氢后的歧化反应导致反应终止等问题,所以生成的聚合物的分子量的调控就变得很困难。TERP通过使用有机碲化合物作为链转移剂和自由基引发剂,可以在所有聚合物链均等扩散的低活性物种浓度下聚合,从而实现精确可控聚合。
它是继NMP,ATRP ,RAFT等之后的一种新的可逆的惰性自由基聚合体系,与其他体系相比,可通过单种转移剂控制多种多官能乙烯基单体的聚合,通用性比较强,另外在嵌段共聚物合成方面也表现出色1。
该聚合法已经由日本大塚化学(株)实现了工业化应用。
基本文献
- Yamago, S. Chem. Rev. 2009, 109, 5051–5068. DOI:10.1021/cr9001269 (Review)
- Yamago, S.; Iida, K.; Yoshida, J. J. Am. Chem. Soc. 2002, 124, 2874-2875.DOI:10.1021/ja025554b
反应机理
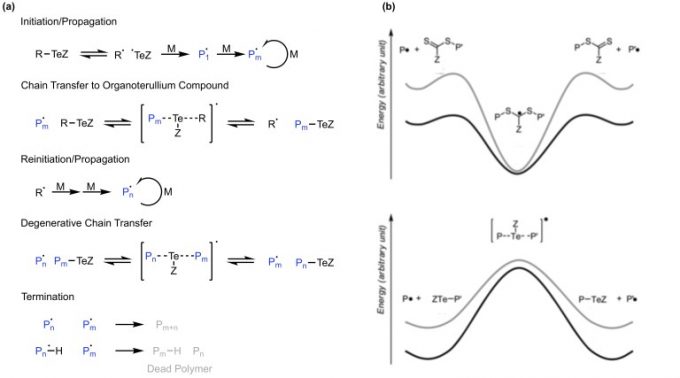
图1. TERP的聚合机理 (a) RAFT聚合、TERP的自由基交换连锁机理的势能图 (b)。图中P为Polymer, M为Monomer。
活化机理有两步:首先是通过有机碲化合物可逆的裂解碳自由基的机理,另外一步是生成的碳自由基与另一分子的有机碲化合物反应发生交换连锁机理。基本上可逆的裂解机制仅发生于引发反应、聚合中是通过交换连锁反应机理进行。低活性种浓度下的聚合也是可以进行的,并且可以几大限度的抑制停止反应。尽管通过交换连锁机理以类似于RAFT聚合的方式控制聚合,但是机理本身在热力学上是不同的,在TERP中,在交换连锁(链)反应过程中基本上没有中间体。
反应实例
根据反应形式,分为第一代,第二代和第三代。
第1代
使用有机碲化合物的热解作为自由基源。因此,需要80至110℃的高温条件。
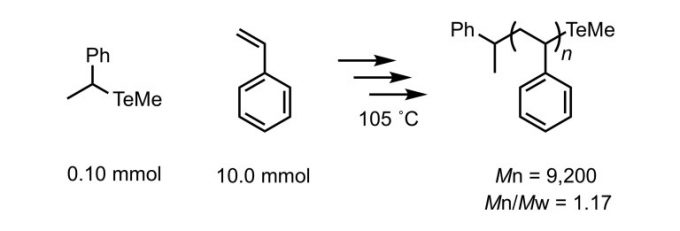
Styrene的聚合。在氮气中,将单体,AIBN和有机碲化合物混合,并将温度升高至105℃。有机碲化合物分解,产生自由基,并进行聚合。
第2代
自由基引发剂,特别是偶氮引发剂的热分解用作自由基源。 有机碲化合物仅用作链转移剂。 可以在比第一代更低的温度(40-80℃)下进行反应。
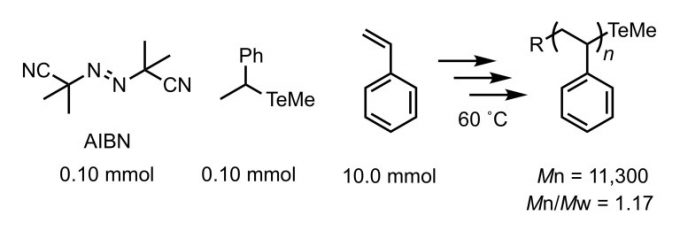
Styrene的聚合,在氮气氛下,将单体,AIBN和有机碲化合物混合,并将温度升至60°C,AIBN分解并产生自由基以促进聚合反应3。
第3代
有机碲化合物的光解被用作自由基源。 即使在低温(0°C至室温)下也可以聚合。 聚合ON / OFF可以通过光照射来控制。
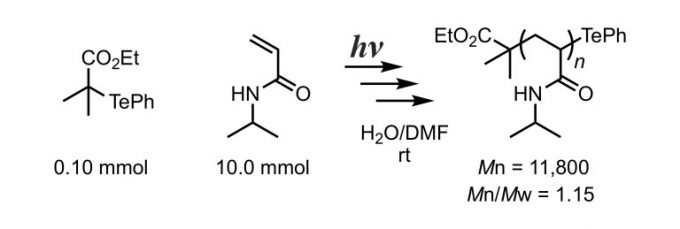
N-isopropyl acrylamide (NIPAM)的光聚合。在氮气氛中,将单体和有机碲化合物溶解在溶剂中,并用光照射分解有机碲化合物以产生自由基,并进行聚合4。
实验技巧
- 由于有机碲化合物在氧气存在下不稳定,因此反应应在充分脱气和氮取代的条件下进行。
备考
- 有机碲化合物可以通过以下反应以克规模合成,主要是通过减压蒸馏纯化。
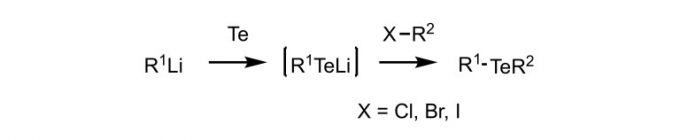
- 加入二碲化物作为助催化剂可改善聚合控制度5。
- 使用具有相同机理的有机锑化合物作为聚合体系Organostibine-mediated Living Radical Polymerization (SBRP)7或使用有机铋化合物的Organobismuthine-mediated Living Radical Polymerization (BIRP)6也被相继报道。
- 尽管这是一种出色的聚合体系,但市场上几乎没有市售的引发剂和链转移剂,因此很难作为聚合条件对照筛选的首选。
参考文献
- Yamago, S. Chem. Rev. 2009, 109, 5051–5068. DOI:10.1021/cr9001269
- Yamago, S.; Iida, K.; Yoshida, J. J. Am. Chem. Soc. 2002, 124, 2874-2875.DOI:10.1021/ja025554b
- Goto, A.; Kwak, Y.; Fukuda, T.; Yamago, S.; Iida, K.; Nakajima, M.; Yoshida, J. J. Am. Chem. Soc. 2003, 125, 8720-8721. DOI:10.1021/ja035464m
- Yamago, S.; Ukai, Y.; Matsumoto, A.; Nakamura, Y. J. Am. Chem. Soc. 2009, 131, 2100-2101. DOI:10.1021/ja8099689
- Kwak, Y.; Tezuka, M.; Goto, A.; Fukuda, T.; Yamago, S.; Macromolecules 2007, 40,1881-1885. DOI:10.1021/ma0623385
- Yamago, S.; Kayahara, E.; Kotani, M.; Ray, B.; Kwak, Y.; Goto, A.; Fukuda, T. Angew. Chem. Int. Ed. 2007, 46, 1304 –1306. DOI: 10.1002/anie.200604473
- Yamago, S.; Ray, B.; Iida, K.; Yoshida, J.; Tada, T.; Yoshizaki, K.; Kwak, Y.; Goto, A.; Fukuda, T. J. Am. Chem. Soc. 2004,126, 13908-13909. DOI:10.1021/ja044787v
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!














No comments yet.