本文作者:杉杉
导读
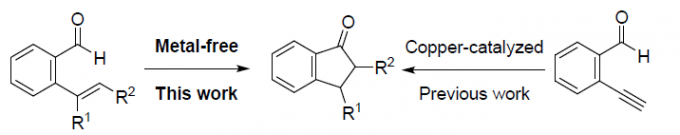
近日,中国科学院上海药物研究所柳红和周宇课题组共同合作在Green Chemistry上发表论文,报道了无需使用金属催化剂和添加剂,以L-脯氨酸作为高效的催化剂,可在温和的条件下反应,即可获得茚满酮(indanones)化合物。同时,与前期通过铜催化2-炔基苯甲醛相比,该策略通过2-乙烯基苯甲醛(2-vinylbenzaldehyde)的分子内氢酰化(hydroacylations)反应从而合成茚满酮化合物,具有绿色环保、高收率等优点。此外,该策略可用于合成抗AD药物多奈哌齐(donepezil)。
A metal-free method for facile synthesis of indanones via intramolecular hydroacylation of 2-vinylbenzaldehydes
Guoxue He, Jinyu Ma, Jianhui Zhou, Chunpu Li, Hong Liu*and Yu Zhou*
Green Chem. ASAP DOI:10.1039/D0GC03572F
正文
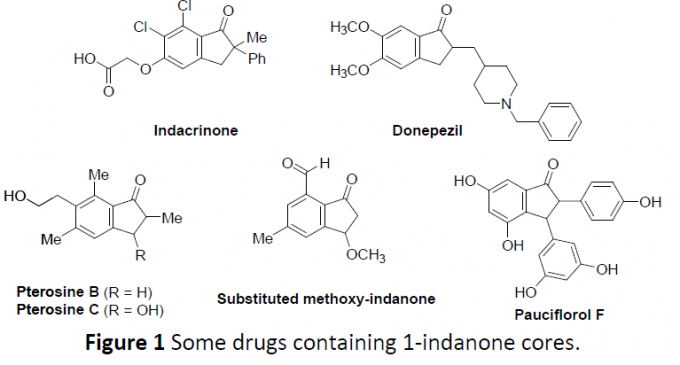
1-茚满酮作为药物化学和有机合成中常见的分子骨架,具有广泛的生物活性,如利尿药茚达立酮(indacrinone)、用于治疗阿尔茨海默氏病的AChE抑制剂多奈哌齐(Donepezil)等。同时,自然界也存在一些茚满酮骨架,如Pterosin B和C、甲氧基-茚满酮以及Pauciflorol F,分别具有抗菌活性、抗癌活性和HIV抑制活性。
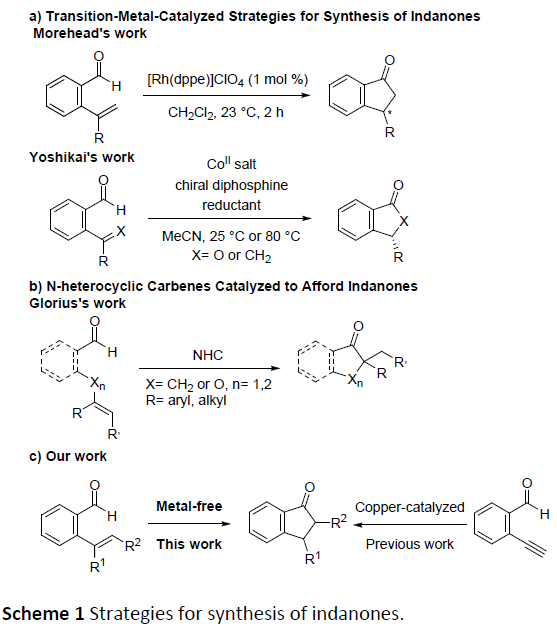
基于其具有的生物学价值,目前已开发出多种有效的策略来构建此类骨架,如金属催化(Pd,In,Au或Cu)分子内的环化或多步串联反应。最近,也报道了通过将烯烃插入醛基的C-H键中,从而构建C-C键的策略,能够作为一种以简单的原料直接合成酮的途径。如Morehead’s课题组[1]报道了Rh(I)催化2-乙烯基苯甲醛分子内的不对称加氢酰化反应,从而以高收率和高对映选择性获得手性3-取代的茚满酮衍生物(Scheme 1a)。Breit课题组[2]和Coltart课题组[3]也报道了类似的研究,分别通过使用不同的Rh(I)催化体系,实现2-乙烯基苯甲醛的分子内加氢酰化反应来合成茚满酮。此外,其他金属催化剂也可实现分子内的加氢酰化反应。如Yoshikai课题组[4]通过使用钴-手性二膦配体的体系,实现2-烯基苯甲醛的对映选择性分子内的加氢酰化反应,从而合成茚满酮衍生物(Scheme 1a)。然而,过渡金属催化的加氢酰化反应也存在一定的局限性,如使用昂贵的过渡金属催化剂、易发生副反应等。因此,仍需一种可替代的绿色合成方法。最近,使用N-杂环卡宾(NHCs)可以作为避免上述问题的途径之一,如Glorius课题组[5]报道了使用N-杂环卡宾(NHCs)催化的策略,实现未活化烯烃取代醛底物的分子内加氢酰化反应,从而合成茚满酮(Scheme 1b)。然而,复杂的起始材料和有限的底物范围限制了反应的应用。2013年,本课题组[6]报道了一种有效的合成手性3-烷基取代茚满酮的策略,涉及N-叔丁烷亚磺酰亚胺与α,β-不饱和二酯的不对称Michael加成的过程。最近,本课题组[7]还报道了一种更为便捷的铜催化策略,即以2-乙炔基苯甲醛为起始原料,通过分子内的环化策略来构建3-羟基-1-茚满酮化合物(Scheme 1c)。但是,此类方法也仍存在一定的局限性,如底物合成路线长、使用金属催化剂等。在此,本课题组报道了一种更为高效的策略,无需金属催化,即可通过分子内的加氢酰化反应合成茚满酮骨架。
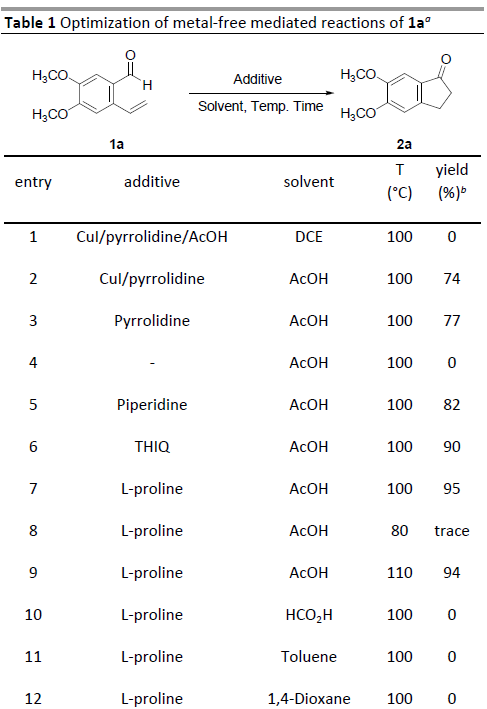
首先,作者以4,5-二甲氧基-2-乙烯基苯甲醛(1a)作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以L-脯氨酸(20 mol%)为催化剂,可在乙酸溶剂中120°C下反应,即可获得90%收率的目标产物2a。
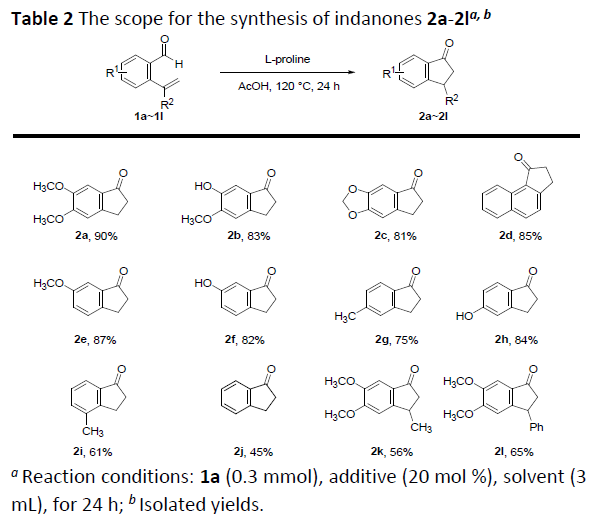
在获得上述最佳反应条件后,作者开始对2-乙烯基苯甲醛底物1进行了扩展(Table 2)。反应结果表明,使用不同取代的R1或R2基团时,如甲氧基、甲基、羟基等,均能以中等以上收率获得相应的产物2a–2i。然而,对于具有吸电子基团的底物,如F、Cl、CN和NO2等,未能获得相应的产物。
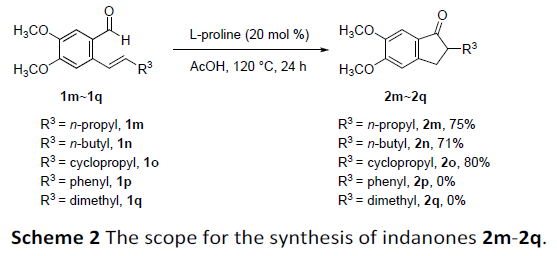
其次,对于R3上含有链烯烃(2m和2n)和环烯烃(2o)的底物时,均以高收率获得相应的产物。然而,对于芳基取代的烯烃(2p)和二甲基取代的烯烃(2q),由于位阻或电子效应的影响,未能实现相应的转化(Scheme 2)。
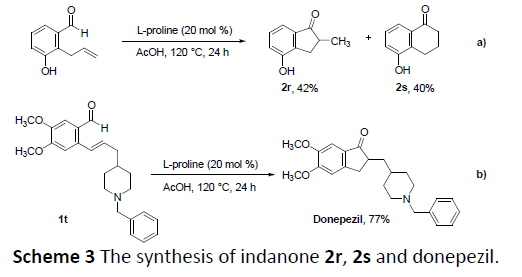
同时,以2-烯丙基-3-羟基苯甲醛为底物时,可分别获得中等收率的五元和六元环产物(2r和2s)。值得注意的是,该策略成功以高收率合成抗AD药物多奈哌齐,进一步表明了反应的实用性(Scheme 3)。
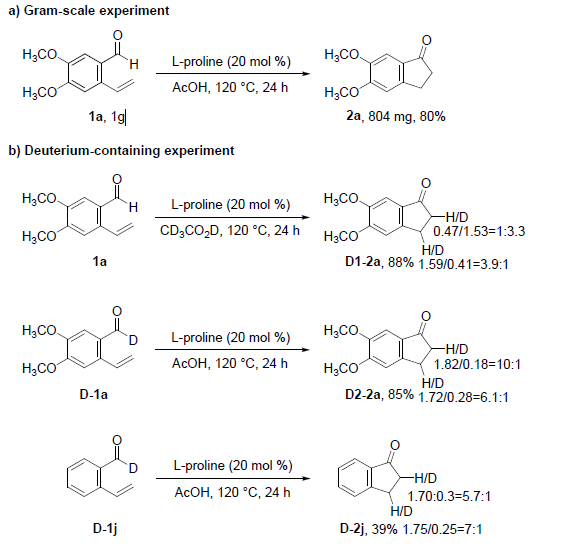
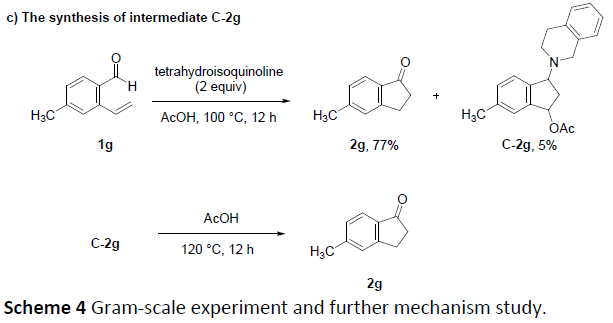
此外,2a的克级实验,同样获得了80%的收率(Scheme 4a)。为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 4b)。首先,在标准条件下使用CD3CO2D时,获得了一部分含氘产物D1-2a。其次,以氘-醛D-1a和D-1j为底物时,获得含氘的产物D2-2a和D-2j。这些结果表明,茚满酮骨架上的氢原子可能分别来自乙酸和醛,可能经历氢迁移的过程。此外,当使用四氢异喹啉代替L-脯氨酸时,以5%的收率获得了关键的中间体C(C-2g),该中间体C-2g可在乙酸下可进一步转化为目标产物2g。
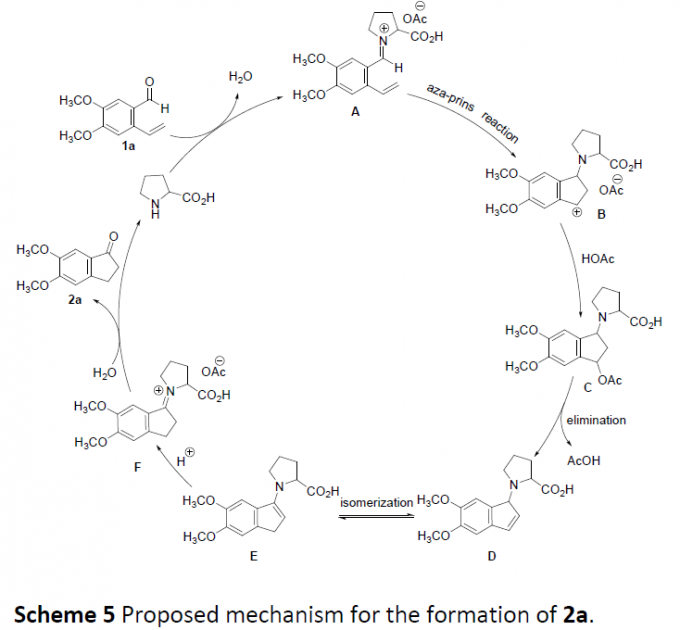
根据上述的实验,作者提出了一种可能的反应机理(Scheme 5)。首先,化合物1a与L-脯氨酸反应形成中间体A,经Aza-Prins反应生成中间体B,再经亲核进攻形成中间体C。紧接着,中间体C经消除得到中间体D,其在酸和高温下进行异构化以获得中间体E,并质子化形成中间体F。最后,经水合作用,从而获得最终的目标产物2a。
总结
中国科学院上海药物研究所柳红和周宇课题组共同合作报道了一种高效且通用的策略,可在无金属催化下,以L-脯氨酸为高效的催化剂,通过2-乙烯基苯甲醛的分子内加氢酰化反应,从而以中等至良好的收率获得茚满酮衍生物。同时,该反应具有绿色环保、操作简单等特点。此外,该策略成功以高收率合成抗AD药物多奈哌齐,进一步表明了反应的实用性。
参考文献
[1] K. Kundu, J. V. McCullagh and A. T. Morehead, J. Am. Chem. Soc., 2005, 127, 16042-16043. [2] N. R. Vautravers, D. D. Regent and B. Breit, Chem. Commun., 2011, 47, 6635-6637. [3] E. J. Rastelli, N. T. Truong and D. M. Coltart, Org. Lett., 2016, 18, 5588-5591. [4] J. Yang and N. Yoshikai, J. Am. Chem. Soc., 2014, 136, 16748-16751. [5] D. Janssen-Muller, M. Schedler, M. Fleige, C. G. Daniliuc and F. Glorius, Angew. Chem. Int. Ed. Engl., 2015, 54, 12492-12496. [6] J. Wang, Y. Zhou, L. Zhang, Z. Li, X. Chen and H. Liu, Org. Lett., 2013, 15, 1508-1511. [7] G. He, C. Wu, J. Zhou, Q. Yang, C. Zhang, Y. Zhou, H. Zhang and H. Liu, J. Org. Chem., 2018, 83, 13356-13362.

















No comments yet.