本期小编为各位同行介绍对映选择性Heck-Matsuda反应。
概要
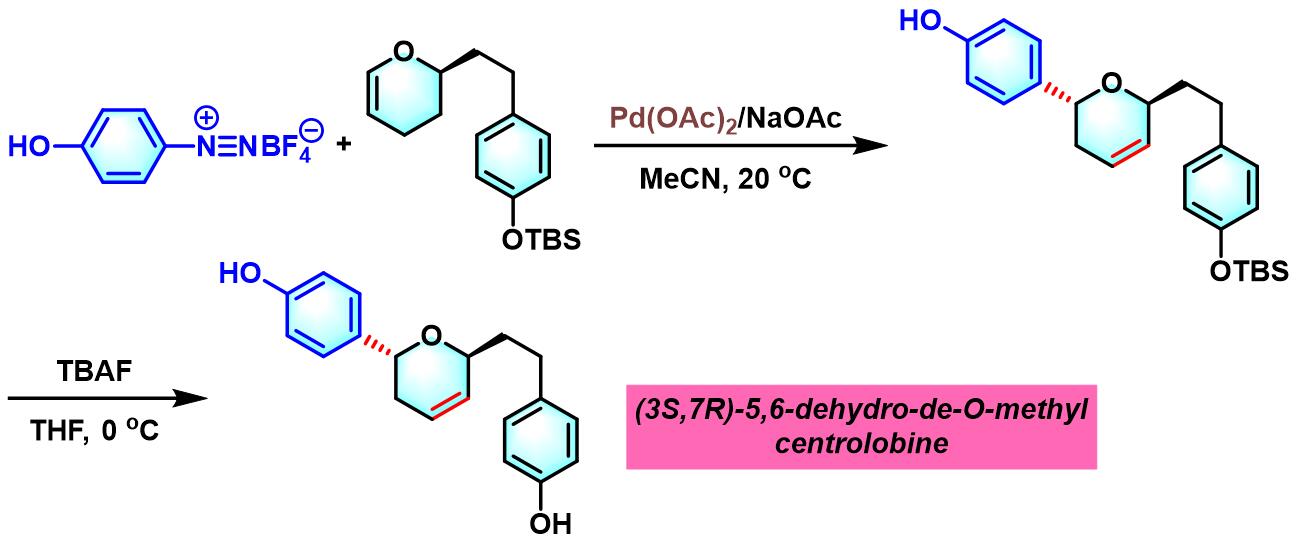
2011年,B. Schmidt通过酚羟基取代芳香重氮盐参与的不对称Heck-Matsuda反应,首次完成(3S,7R)- 5,6-dehydro-de-O-methyl centrolobine的合成[1]。
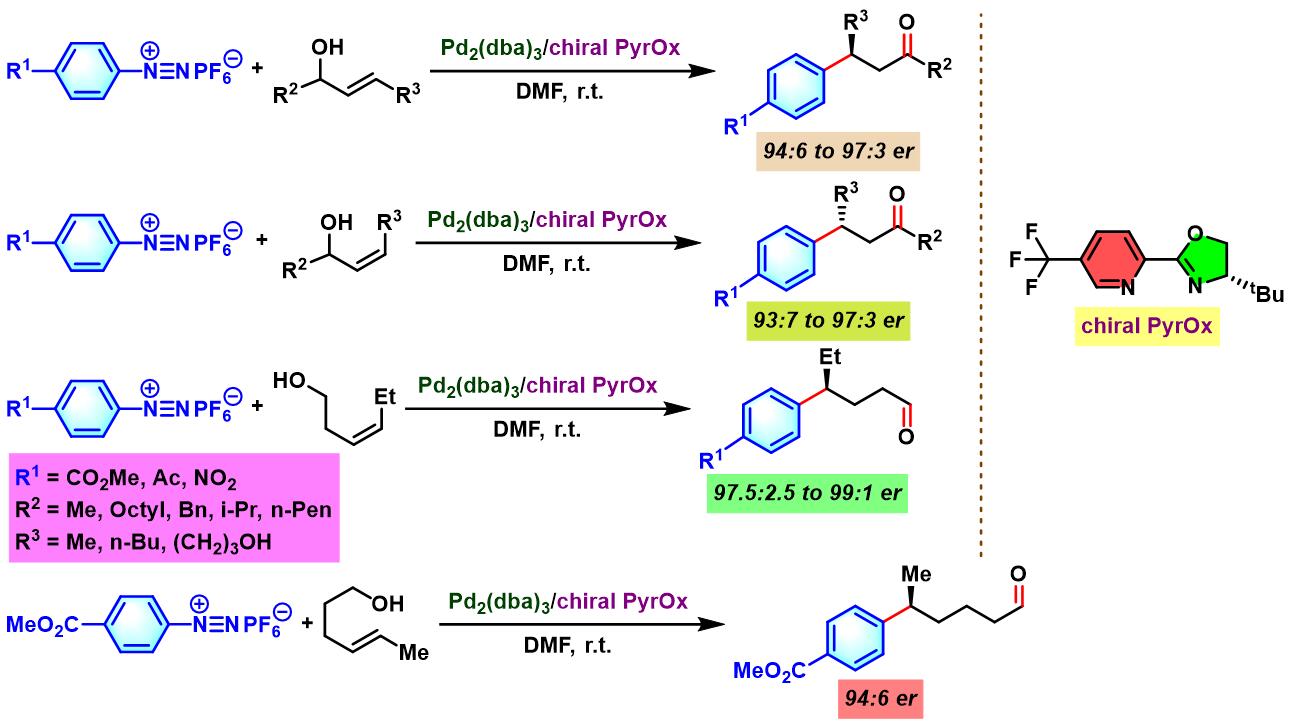
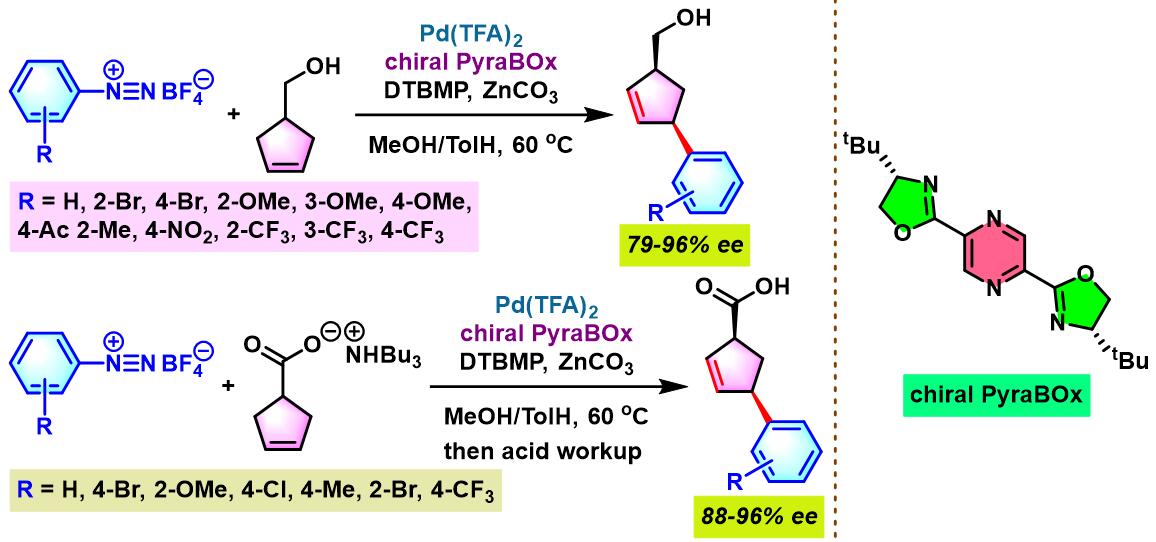
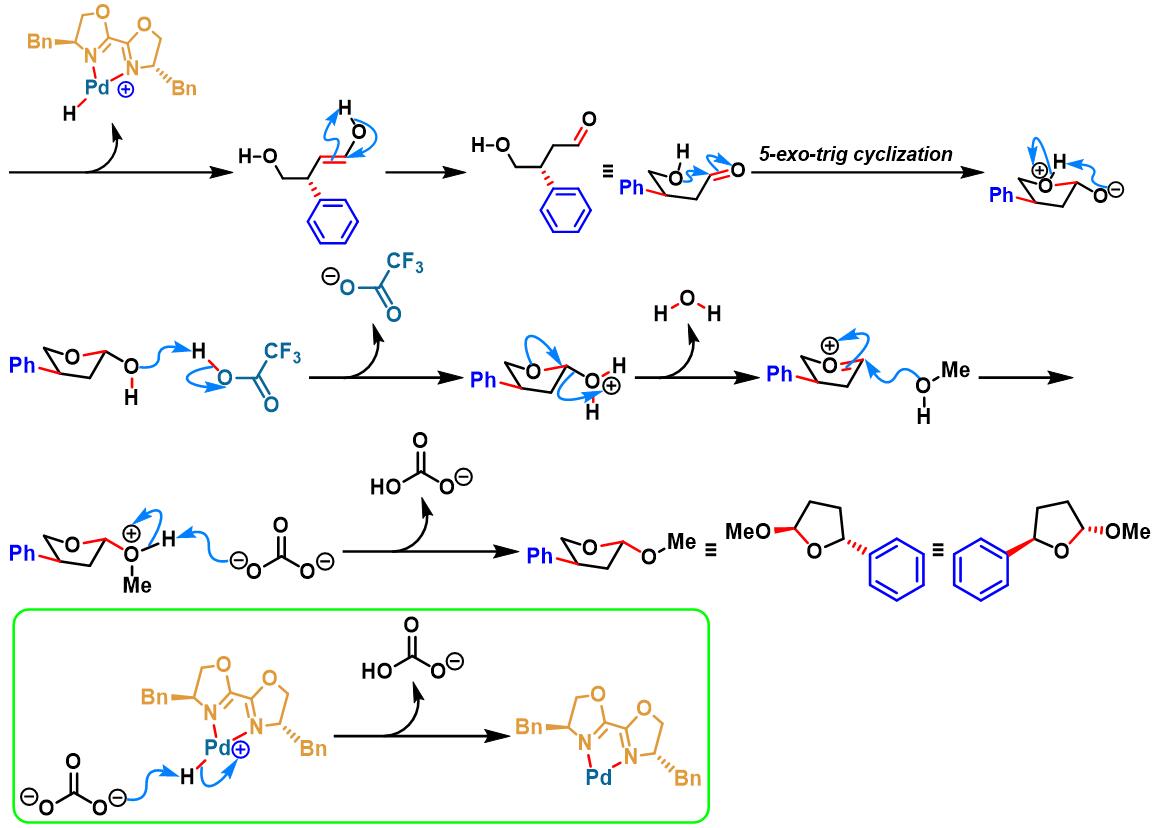
2012年,M. S. Sigman采用手性PyrOx配体 (又称为PyOx, pyridine oxazoline), 对芳香重氮盐与(Z)-烯丙醇、(E)-烯丙醇及高烯丙醇之间的对映选择性Heck-Matsuda偶联过程进行了系统研究,并顺利实现手性β-芳羰基化合物、手性γ-芳羰基化合物与手性δ-芳羰基化合物的不对称合成[2]。
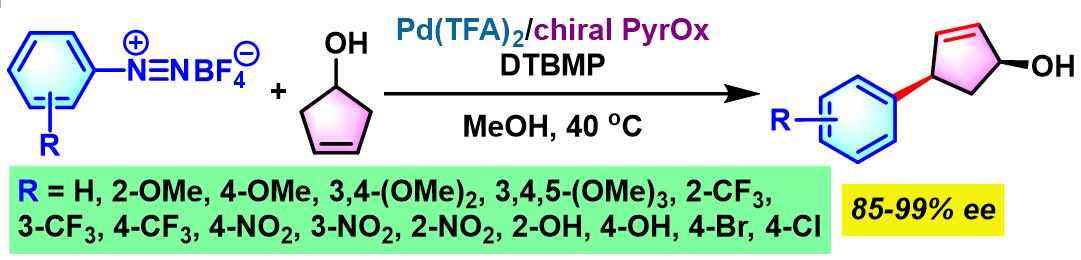
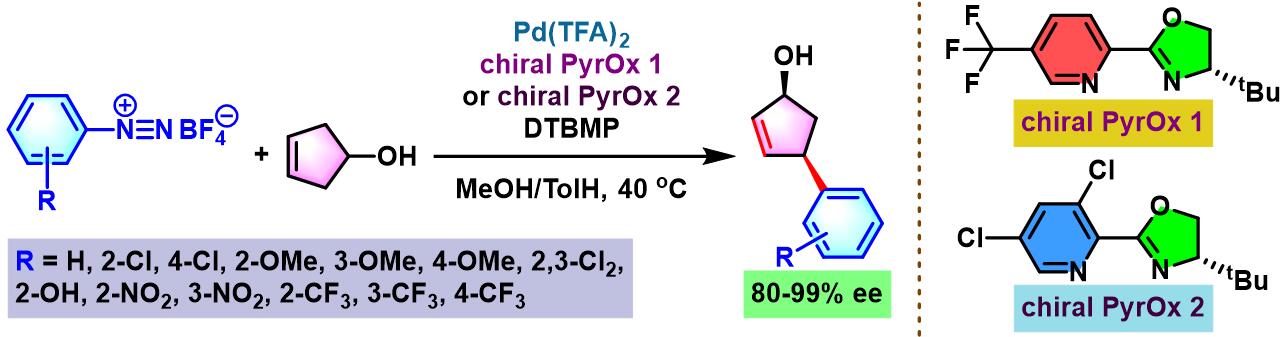
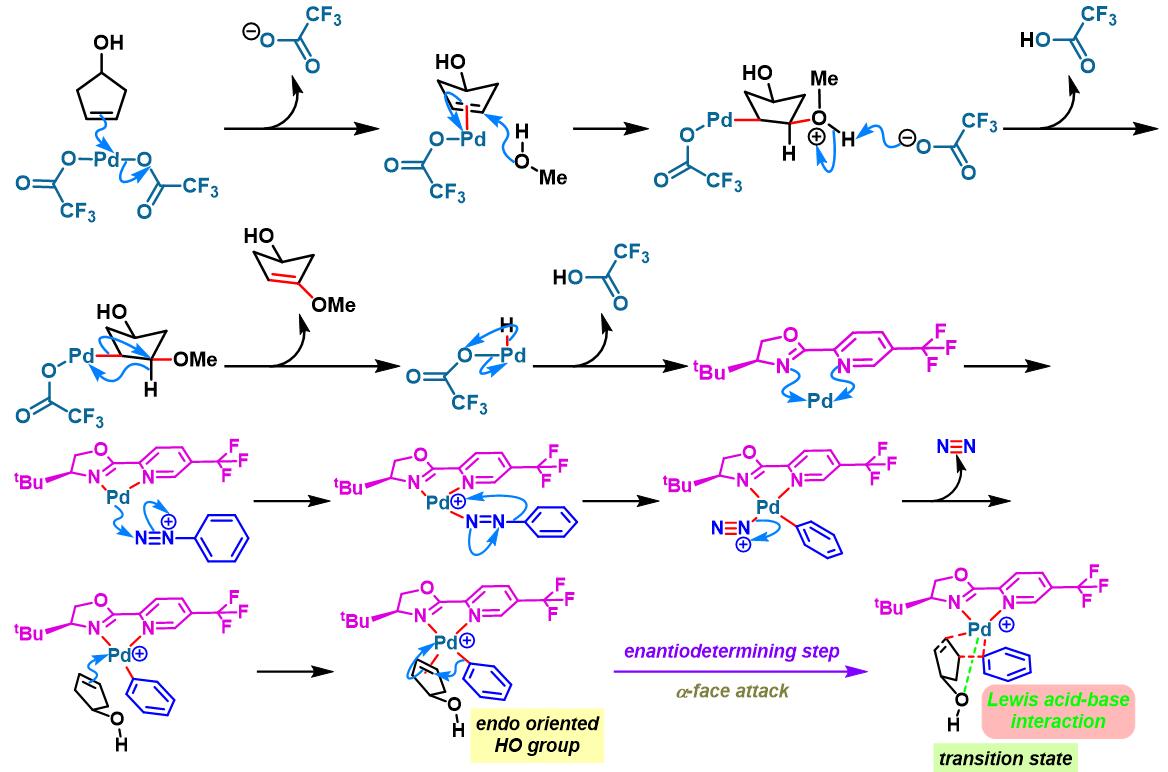
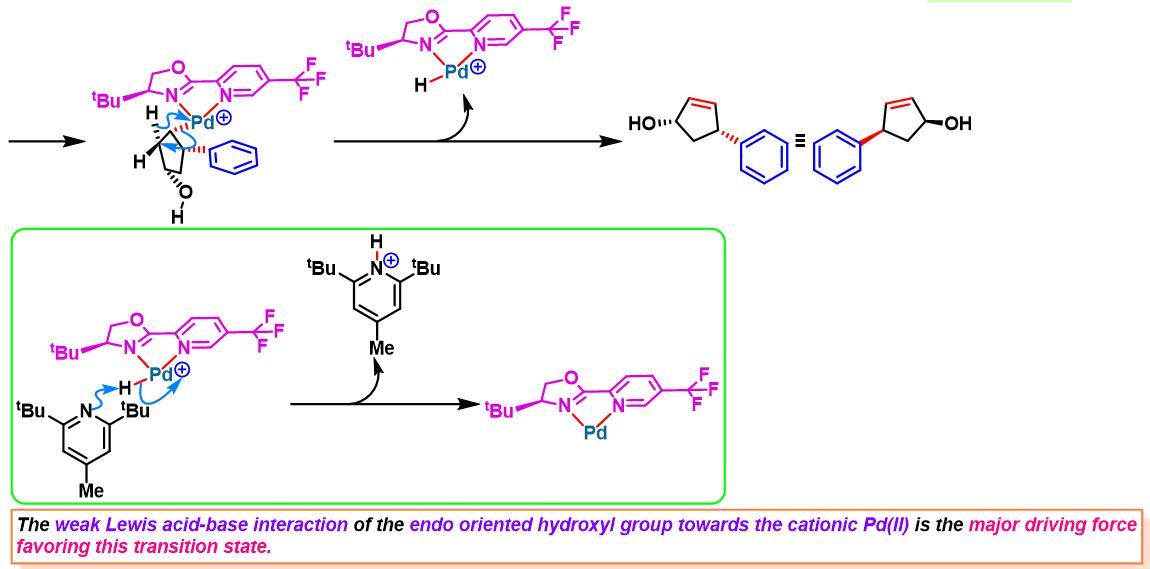
2014年,C. R. D. Correia将该配体应用于3-环戊烯醇的对映选择性去对称化[3]。
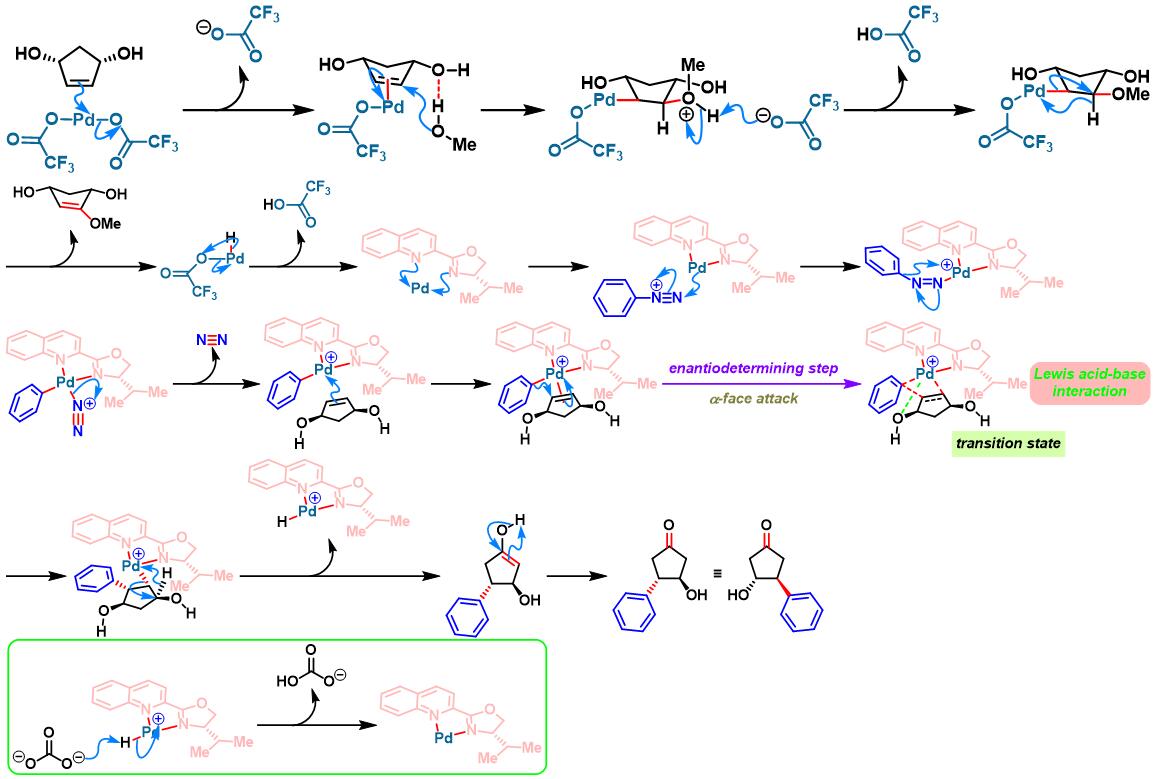
2015年,C. R. D. Correia通过手性QuinOx (quinoline oxazoline)配体,进一步实现内消旋cis-4-环戊烯-1,3-二醇的对映选择性去对称化[4]。
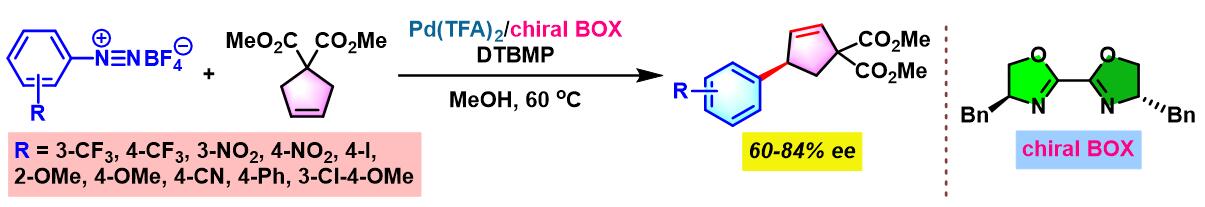
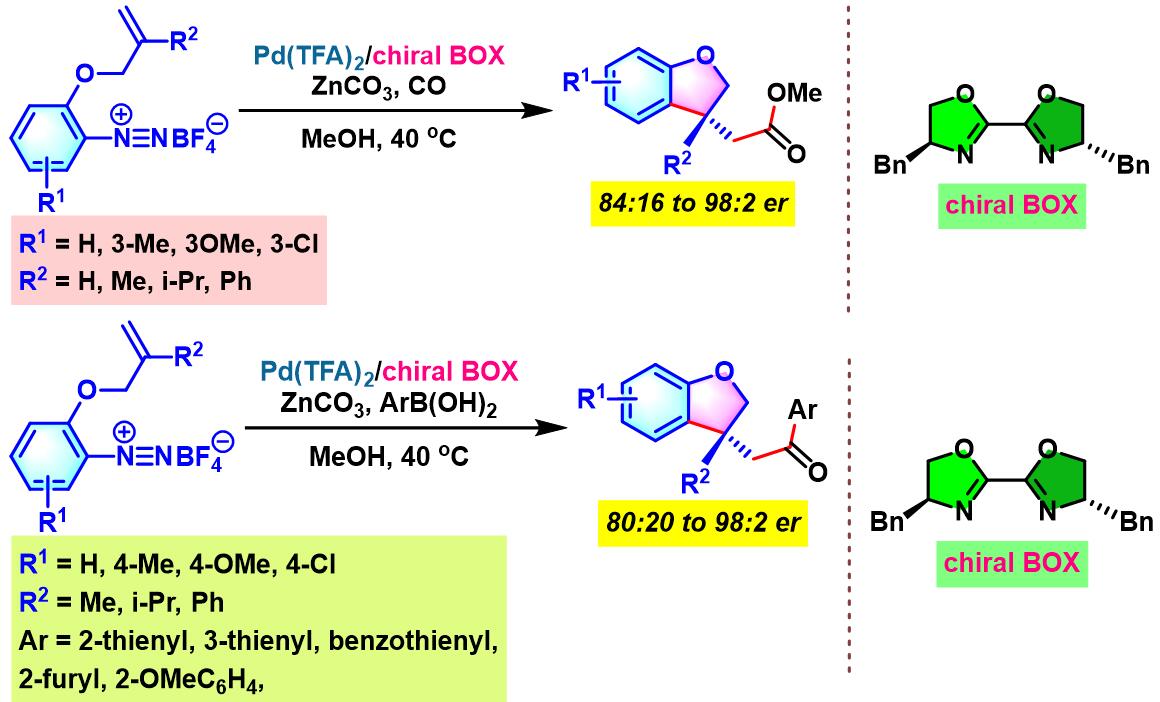
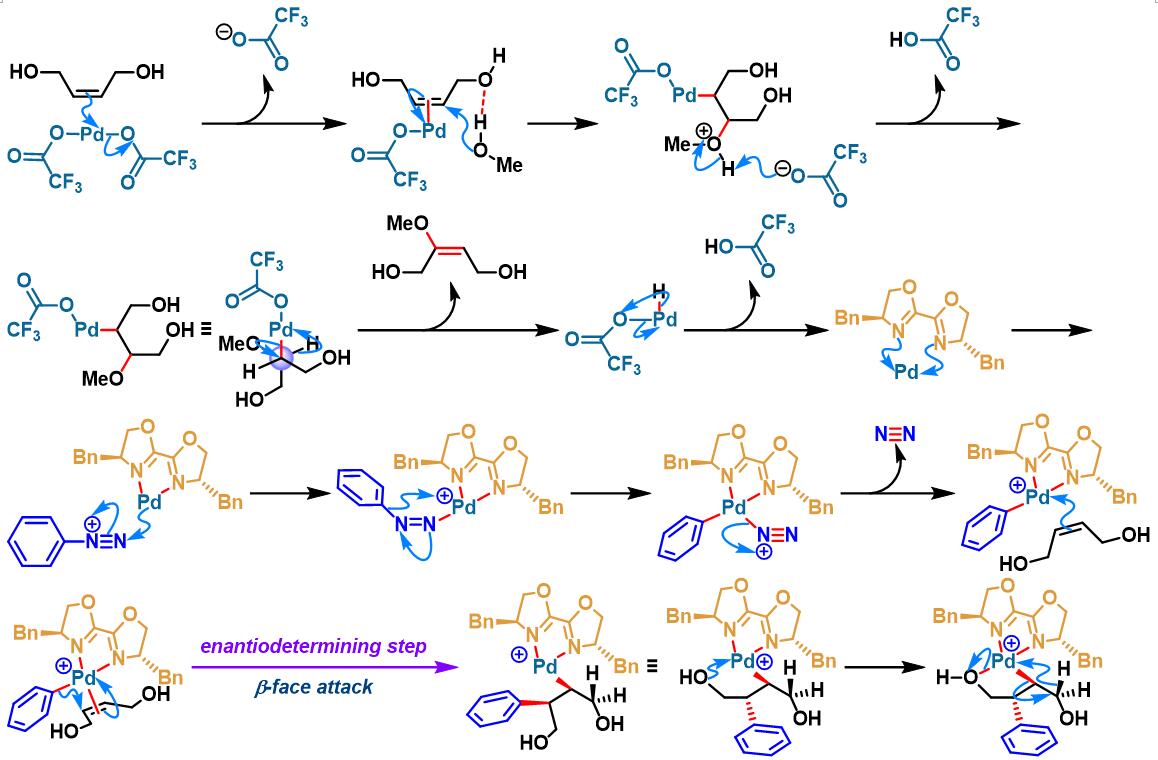
2012年开始,C. R. D. Correia通过手性BOX配体 (bisoxazoline),设计出首例芳香重氮盐与环烯基化合物之间的对映选择性Heck-Matsuda交叉偶联反应[5]。
2013年, C. R. D. Correia继续将该配体应用于芳香重氮盐与非环烯化合物之间对映选择性Heck-Matsuda交叉偶联反应的设计。同时,C. R. D. Correia发现,通过进一步反应,能够顺利完成手性β-芳基-γ-内酯与手性β-芳基醛的构建[6]。
2016年,C. R. D. Correia通过新发展的非共价羟基导向的环戊烯醇对映选择性去对称化方法学,成功完成高度官能团化的手性cis-4-芳基环戊烯醇骨架的构筑[7]。
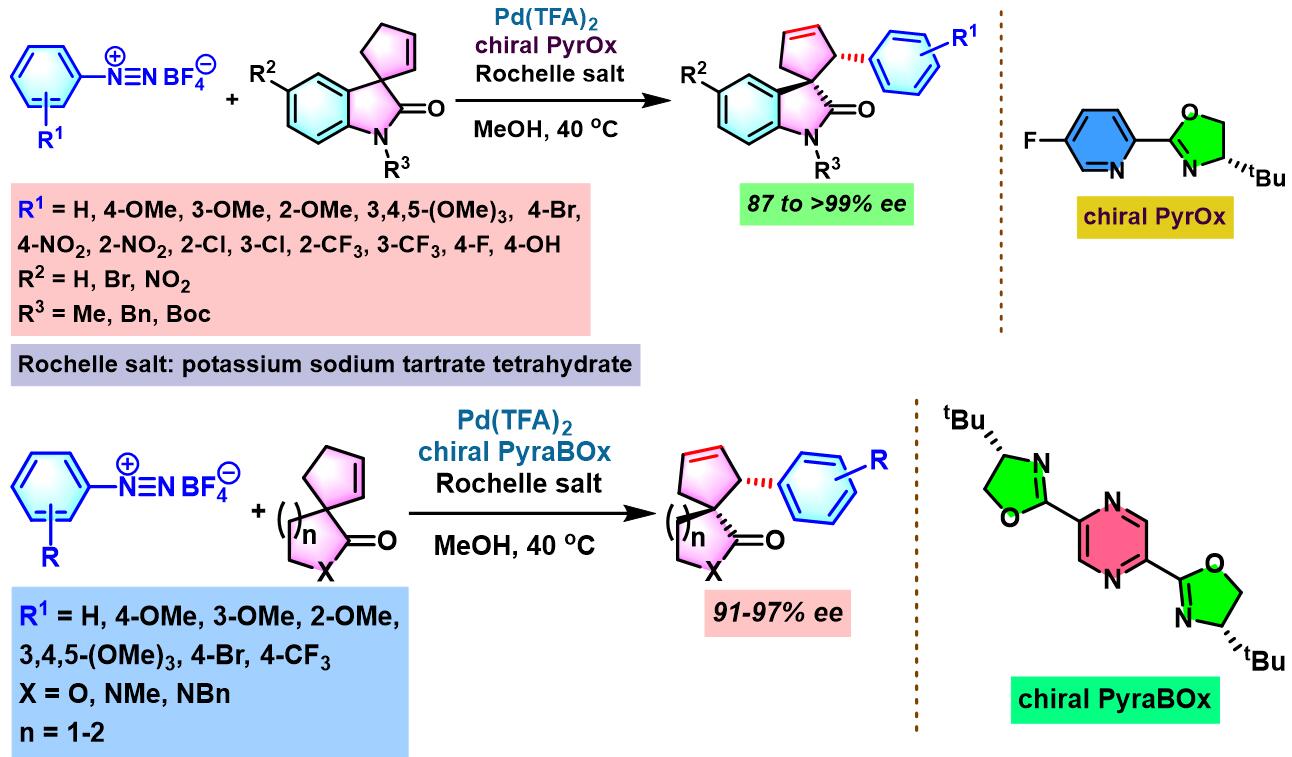
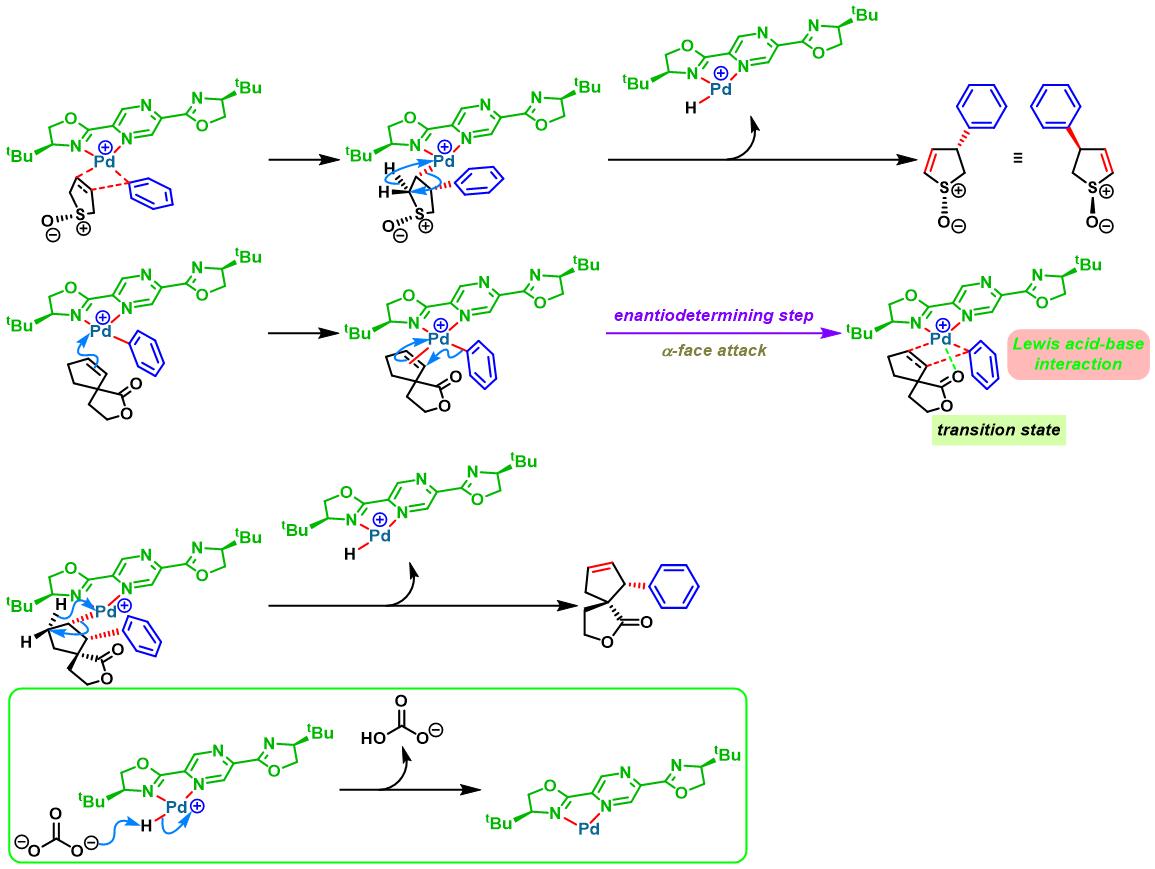
同时,C. R. D. Correia通过新发展的手性PyraBOX (N,N-ligand pyrazinebisoxazoline)配体,将Heck-Matsuda偶联方法学应用于具有S-与P-立体生成中心的手性杂环分子的构筑[8]。
2017年,C. R. D. Correia采用非共价羰基导向的对映选择性去对称化策略,进一步将Heck-Matsuda偶联方法学应用于季碳螺手性中心的构建[9]。
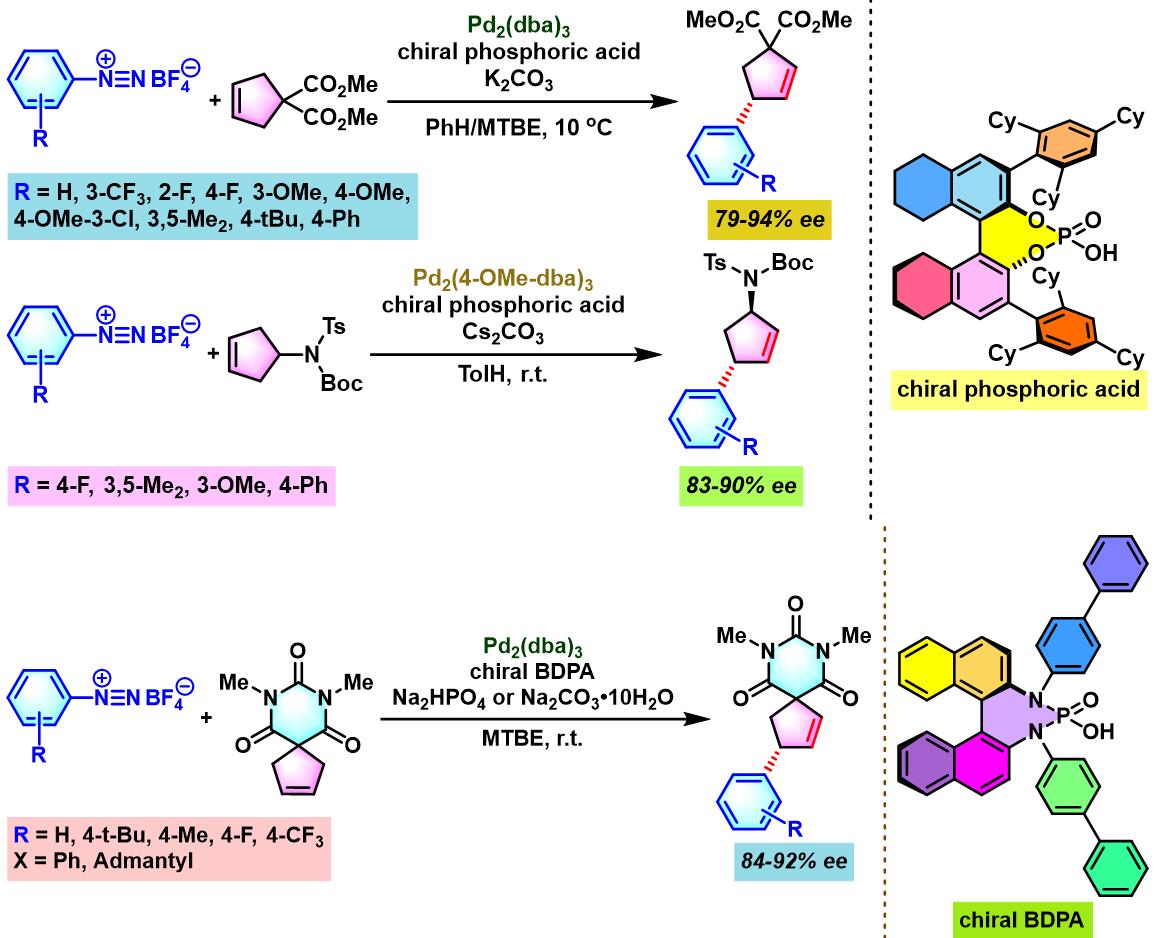
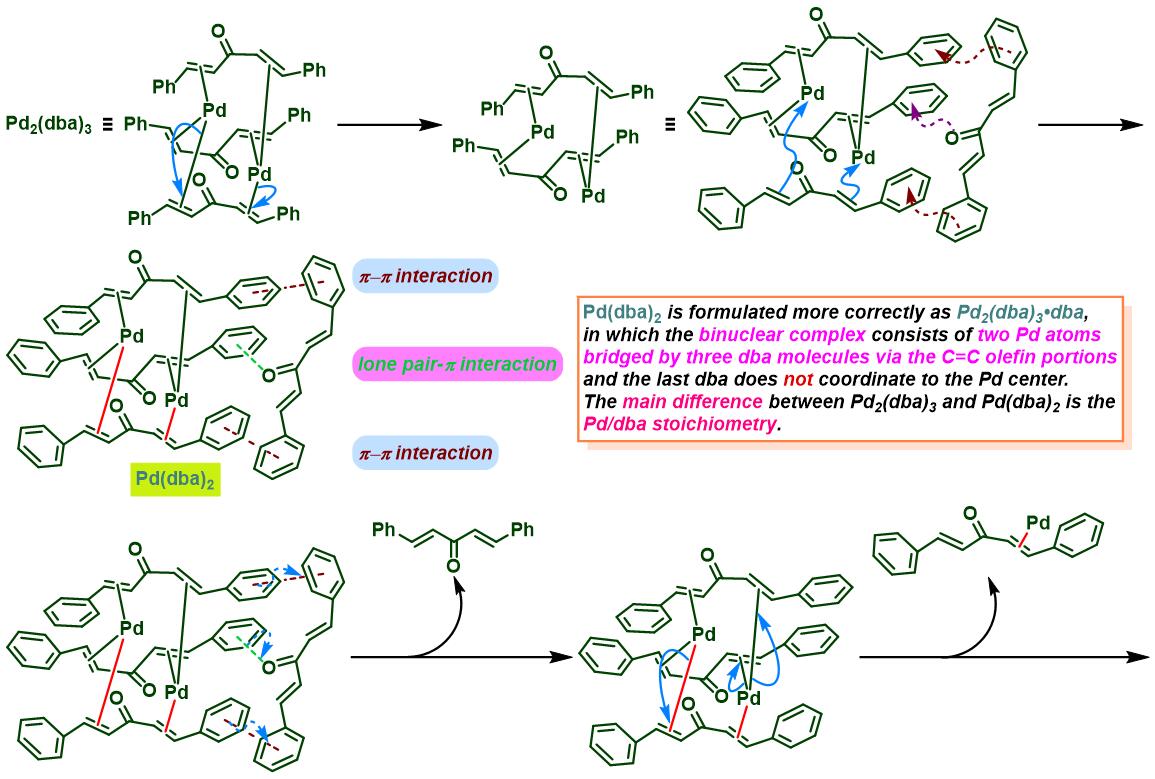
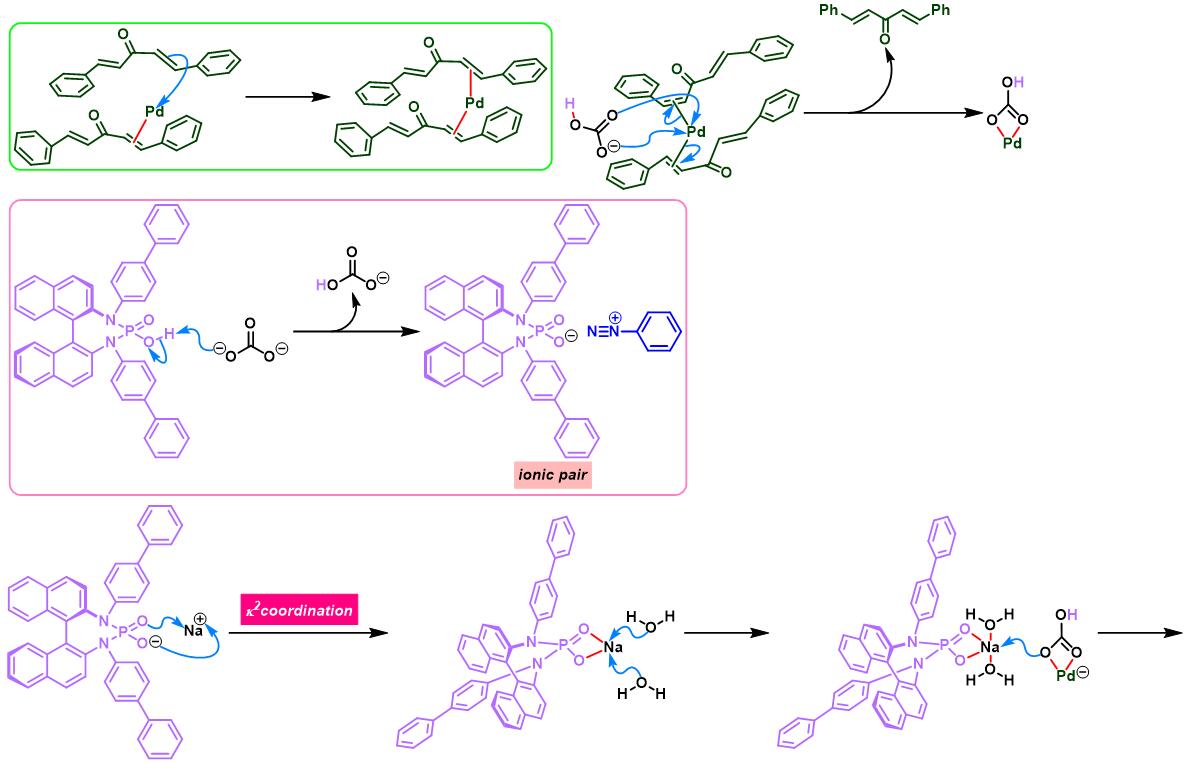
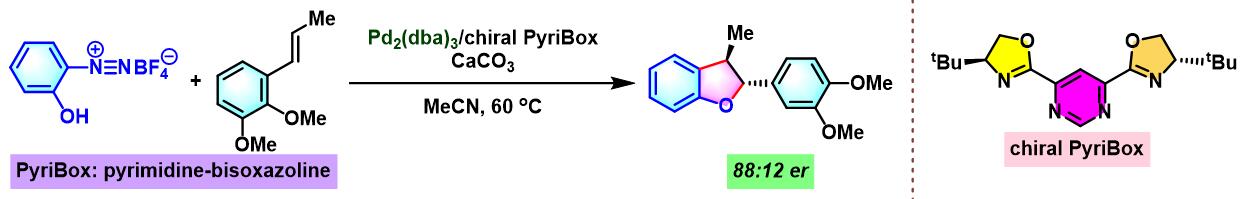
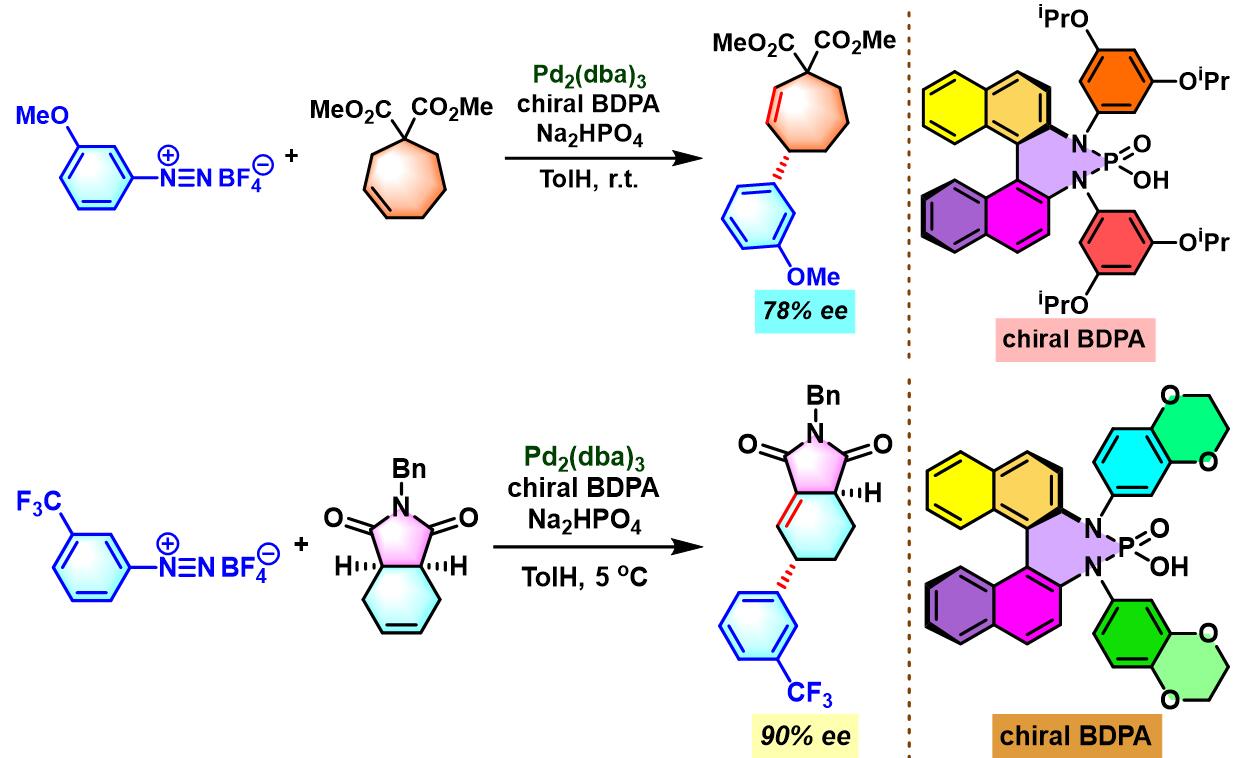
同时,R. B. Sunoj与F. D. Toste通过CAPT (chiral anion phase transfer)策略,即采用BINOL衍生的手性磷酸 (BINOL-derived phosphoric acid)或BINAM (chiral 2,2′-binaphthyl diamine)衍生的手性磷酸 (BINAM-derived phosphoric acid, BDPA)作为反荷离子的芳香重氮盐参与Heck-Matsuda偶联过程。研究表明,通过该策略,能够极大减少副反应的发生。同时提高了偶联产物的收率与反应的对映选择性[10]。
2018年,C. R. D. Correia通过手性BOX配体,完成首例芳香重氮盐参与的对映选择性分子内环外羰基化偶联 (exocarbonylative coupling)反应[11]。
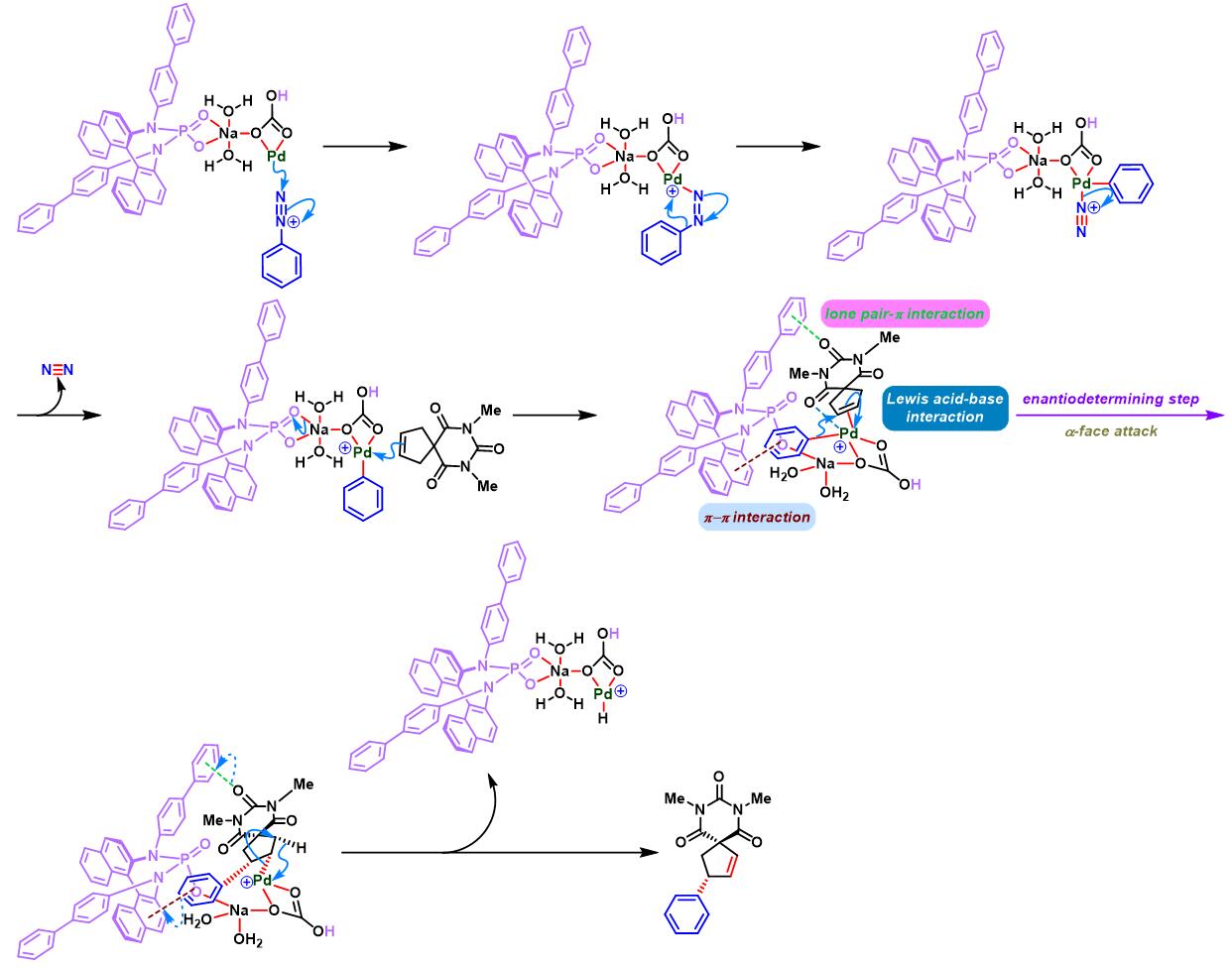
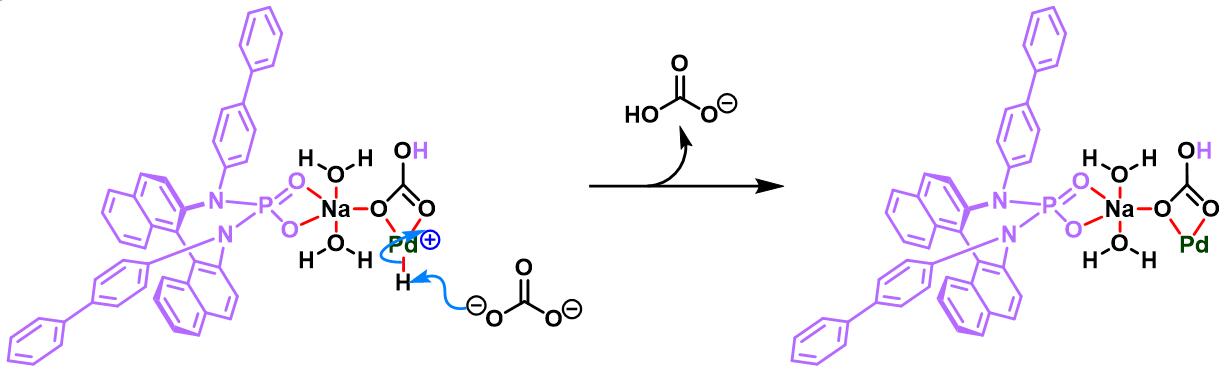
之后,该小组通过非共价底物导向 (non-covalent substrate directable)策略,顺利实现非活化的五元环烯基化合物的对映选择性Heck-Matsuda芳基化,完成手性cis-二取代芳基环戊烯的合成[12]。同时,通过DFT计算表明,通过供体官能团与钯阳离子催化剂之间的内部稳定化的配位层外离子-偶极相互作用 (internal stabilizing out-of-coordination-sphere ion-dipole interaction)产生的非共价导向效应 (non-covalent directing effect)控制反应过程的对映选择性 [12]。
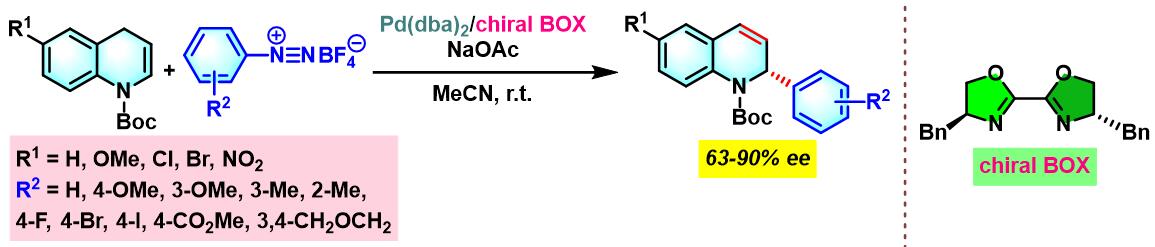
2019年,X. Hou进一步将手性BOX配体应用于1,4-二氢喹啉与芳香重氮盐的不对称Heck-Matsuda交叉偶联[13]。
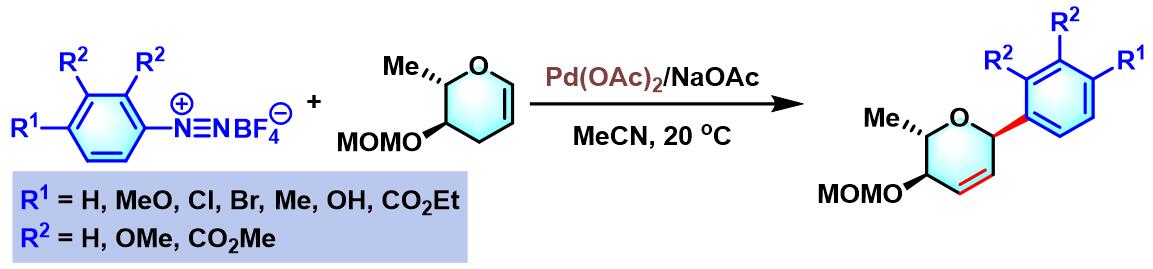
同时, B. Schmidt进一步将Heck-Matsuda偶联策略应用于各类烯糖 (glycal)的芳基化。从而构建起一系列芳基C-糖苷 (Aryl C-Glycosides)类化合物[14]。
基本文献
- [1] B. Schmidt, F. Hölter, A. Kelling, U. Schilde, J. Org. Chem. 2011, 76, 3357. doi: 10.1021/jo2002787.
- [2] E. W. Werner, T. Mei, A. J. Burckle, M. S. Sigman, Science 2012, 338, 1455. doi: 10.1126/science.1229208.
- [3] R.A. Angnes, J. M. Oliveira, C. C. Oliveira, N. C. Martins, C. R. D. Correia, Chem.-Eur. J. 2014, 20, 13117. doi: 10.1002/chem.201404159.
- [4] R. C. Carmona, C. R. D. Correia, Adv. Synth. Catal. 2015, 357, 2639. doi: 10.1002/adsc.201500281.
- [5] C. R. D. Correia, Caio C. Oliveira, A. G. Salles Jr, E. A. F. Santos, Tetrahedron Lett. 2012, 53, 3325. doi: 10.1016/j.tetlet.2012.04.079.
- [6] C. C. Oliveira, Angnes, A. Ricardo, C. R. D. Correia, J. Org. Chem. 2013, 78, 4373. doi: 10.1021/jo400378g.
- [7] J. de Oliveira Silva, R. A. Angnes, V. H. Menezes da Silva, B. M. Servilha, M. Adeel, A. A. C. Braga, A. Aponick, C. R. D. Correia, J. Org. Chem. 2016, 81, 2010. doi: 10.1021/acs.joc.5b02846.
- [8] F. de Azambuja, R. C. Carmona, T. H. D. Chorro, G. Heerdt, C. R. D. Correia, Chem.- Eur. J. 2016, 22, 11205. doi: 10.1002/chem.201602572.
- [9] S. Kattela, G. Heerdt, C. R. D. Correia, Adv. Synth. Catal. 2017, 359, 260. doi: 10.1002/adsc.201600946.
- [10] C. M. Avila, J. S. Patel, Y. Reddi, M. Saito, H. M. Nelson, H. P. Shunatona, M. S. Sigman, R. B. Sunoj, F. D. Toste, Angew. Chem. Int. Ed. 2017, 56, 5806. doi: 10.1002/anie.201702107.
- [11] C. R. D. Correia, R. C. Carmona, O. D. Köster, Angew. Chem. Int. Ed. 2018, 57, 12067. doi: 10.1002/anie.201805831.
- [12] C. R. D. Correia, J. Oliveira, R. A. Angnes, I. U. Khan, E. C. Polo, G. Heerdt, B. Servilha, V. Silva, A. Braga, Chem.-Eur. J. 2018, 24, 11738. doi: 10.1002/chem.201801910.
- [13] Z. Jiang, Y. Jiang, J. Du, D. Chen, C. Ding, B. Xu, X. Hou, Synthesis 2019, 51, 3269. doi: 10.1055/s-0037-1610712.
- [14] F. Otte, B. Schmidt, J. Org. Chem. 2019, 84, 14816. doi: 10.1021/acs.joc.9b02410.
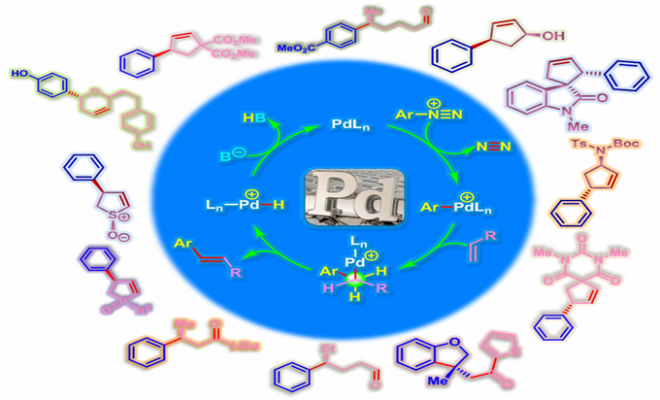
反应机理
手性PyrOx配体参与的不对称Heck-Matsuda反应[1]-[4]
手性QuinOx配体参与的不对称Heck-Matsuda反应[5]
手性BOX配体参与的不对称Heck-Matsuda反应[6]
手性PyraBOX配体参与的不对称Heck-Matsuda反应[7]-[9]
通过CAPT策略进行的不对称Heck-Matsuda反应[10]-[14]
参考文献
- [1] B. Schmidt, F. Wolf, H. Brunner, Eur. J. Org. Chem. 2016, 2972. doi: 10.1002/ejoc.201600469.
- [2] M. Oestreich, Angew. Chem. Int. Ed. 2014, 53, 2282. doi: 10.1002/anie.201310585.
- [3] R.A. Angnes, J. M. Oliveira, C. C. Oliveira, N. C. Martins, C. R. D. Correia, Chem.-Eur. J. 2014, 20, 13117. doi: 10.1002/chem.201404159.
- [4] C. C. Oliveira, E. A. F. dos Santos, J. H. B. Nunes, C. R. D. Correia, J. Org. Chem. 2012, 77, 8182. doi: 10.1021/jo3015209.
- [5] M. S. Sigman, Erik W.Werner, Acc. Chem. Res. 2012, 45, 6, 874. doi: 10.1021/ar200236v.
- [6] C. C. Oliveira, Angnes, A. Ricardo, C. R. D. Correia, J. Org. Chem. 2013, 78, 4373. doi: 10.1021/jo400378g.
- [7] F. de Azambuja, R. C. Carmona, T. H. D. Chorro, G. Heerdt, C. R. D. Correia, Chem.- Eur. J. 2016, 22, 11205. doi: 10.1002/chem.201602572.
- [8] S. Kattela, G. Heerdt, C. R. D. Correia, Adv. Synth. Catal. 2017, 359, 260. doi: 10.1002/adsc.201600946.
- [9] V. H. M. da Silva, C. C. Oliveira, C. R. D. Correia, A. A. C. Braga, Theor. Chem. Acc. 2020, 139, 77. doi: 10.1007/s00214-020-02588-x.
- [10] G. Jindal, R. B. Sunoj, J. Org. Chem. 2014, 79, 7600. doi: 10.1021/jo501322v.
- [11] Y. Reddi, C. Tsai, C. M. Avila, F. D. Toste, R. B. Sunoj, J. Am. Chem. Soc. 2019, 141, 998. doi: 10.1021/jacs.8b11062.
- [12] A. R. Kapdi, A. C. Whitwood, D. C. Williamson, J. M. Lynam, M. J. Burns, T. J. Williams, A. J. Reay, J. Holmes, I. J. S. Fairlamb, J. Am. Chem. Soc. 2013, 135, 8388. doi: 10.1021/ja403259c.
- [13] L. B. Belykh, N. I. Skripov, L. N. Belonogova, V. A. Umanets, T. P. Stepanova, F. K. Schmidt, Kinetics and Catalysis, 2011, 52, 702. doi: 10.1134/S002315841105003X.
- [14] T. Ukai, H. Kawazura, Y. Ishii, J.J. Bonnet, J. A. Ibers, J. Organomet. Chem. 1974, 65, 253. doi: 10.1016/S0022-328X(00)91277-4.
反应实例
对映选择性Oxy-Heck-Matsuda芳基化[6]
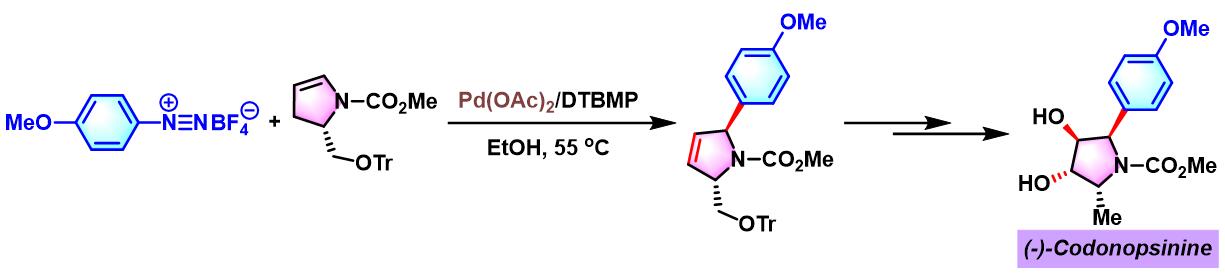
(-)-Codonopsinine的对映选择性全合成[2]
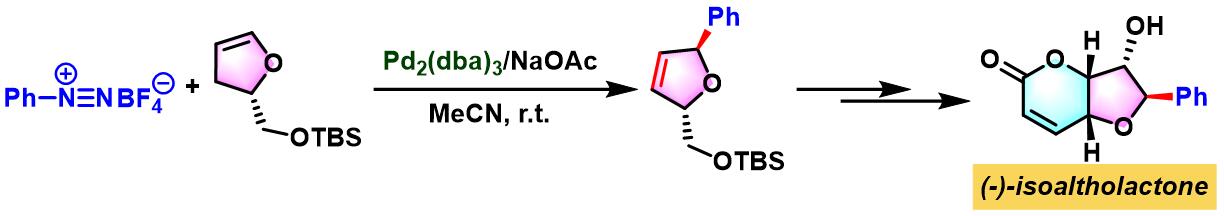
(-)-isoaltholactone的合成[3]
环戊烯与环己烯衍生物的对映选择性芳基化[4]
实验步骤
手性PyrOx配体参与的不对称Heck-Matsuda反应
向放有磁力搅拌子的反应管中加入三氟乙酸钯(0.025 eq.)、手性PyrOx配体 (0.05 eq.)与甲醇 (维持底物浓度为0.075 M)。将上述均相混合物在40 oC下搅拌10 min。10 min后,再加人DTBMP (1 eq.)与烯基化合物 (2 eq.)。随后,加入四氟硼酸芳香重氮盐 (1 eq.)。将上述反应混合物继续搅拌,并通过TLC监控直至反应结束。反应结束后,将上述混合物进行减压浓缩。再加入乙酸乙酯/正己烷 (1:1 v/v) 进行溶解,并通过短硅胶柱过滤,除去极性组分。滤液通过减压除去溶剂后,获得粗产物。将粗产物通过快速柱色谱 (乙酸乙酯/正己烷7:3 v/v 作为洗脱剂)分离纯化,获得相应目标产物。
手性QuinOx配体参与的不对称Heck-Matsuda反应
向放有磁力搅拌子的密封反应瓶中加入三氟乙酸钯 (0.01-0.1 eq.)、手性QuinOx配体 (0.02-0.2 eq.)与甲醇 (维持底物浓度为0.1 M)。将上述均相混合物在40 oC下搅拌5 min。5 min后,将反应瓶冷却至室温,再加人碳酸锌 (0.5 eq.)、烯基化合物 (2 eq.)及四氟硼酸芳香重氮盐 (1 eq.)。将上述反应混合物升温至40 oC,继续搅拌,并通过TLC监控直至反应结束。反应结束后,将上述混合物进行减压浓缩。再加入乙酸乙酯溶解,并通过短硅胶柱过滤。滤液通过减压除去溶剂后,获得粗产物。将粗产物通过快速柱色谱分离纯化,获得相应目标产物。
手性BOX配体参与的不对称Heck-Matsuda反应
向放有磁力搅拌子的反应管中加入三氟乙酸钯 (0.025 eq.)、手性BOX配体 (0.05 eq.)与甲醇 (维持底物浓度为0.075 M)。将上述均相混合物在40 oC下搅拌10 min。10 min后,再加人DTBMP (1 eq.)与烯基化合物 (2 eq.),随后,加入四氟硼酸芳香重氮盐 (1 eq.)。将上述反应混合物继续搅拌,并通过TLC监控直至反应结束。反应结束后,将上述混合物进行减压浓缩。再加入乙酸乙酯/正己烷 (1:1 v/v) 溶解,并通过短硅胶柱过滤,除去极性组分。滤液通过减压除去溶剂后,获得粗产物。将粗产物通过快速柱色谱 (乙酸乙酯/正己烷7:3 v/v 作为洗脱剂)分离纯化,获得相应目标产物。
手性PyraBOX配体参与的不对称Heck-Matsuda反应
向放有磁力搅拌子的密封反应瓶中加入三氟乙酸钯 (0.025 eq.)、手性PyraBOX配体 (0.03 eq.)与甲醇 (维持底物浓度为0.1 M)。将上述均相混合物在60 oC下搅拌7-8 min。7-8 min后,将反应瓶冷却至室温,再加人烯基化合物 (1 eq.)。随后,加入碱 (1 eq.)及四氟硼酸芳香重氮盐 (1.2 eq.)。将上述反应混合物升温至40 oC,继续搅拌,并通过TLC监控直至反应结束。反应结束后,将上述混合物进行减压浓缩。再加入乙酸乙酯溶解,并通过短硅胶柱过滤。滤液通过减压除去溶剂后,获得粗产物。将粗产物通过快速柱色谱分离纯化,获得相应目标产物。
通过CAPT策略进行的不对称Heck-Matsuda反应
向密封反应瓶中加入烯基化合物 (1 eq.)、手性磷酸 (0.03 eq.)与碱 (2 eq.)。再加入甲苯 (维持底物浓度为0.04 M),将上述反应混合物搅拌10 min。10 min后,加入三氟乙酸钯 (0.0005 eq.)及四氟硼酸芳香重氮盐 (1.36 eq.)。将上述反应混合物继续搅拌,并通过TLC监控直至反应结束。反应结束后,将上述混合物通过短硅胶柱过滤。滤液通过减压除去溶剂后,获得粗产物。将粗产物通过快速柱色谱 (正戊烷/乙酸乙酯19:5 v/v及 9:1 v/v进行梯度洗脱)分离纯化,获得相应目标产物。
参考文献
- [1] C. R. D. Correia, A. Ribeiro, E. Polo, N. Martins, Adv. Synth. Catal. 2018, 360, 346. doi: 10.1002/adsc.201701278.
- [2] E. A. Severino, C.R.D. Correia, Org. Lett. 2000, 2, 3039. doi: 10.1021/ol005762d.
- [3] P. R. R. Meira, A. V. Moro, C. R. D. Correia, Synthesis 2007, 2279. doi: 10.1055/s-2007-983781.
- [4] C. M. Avila, J. S. Patel, Y. Reddi, M. Saito, H. M. Nelson, H. P. Shunatona, M. S. Sigman, R. B. Sunoj, F. D. Toste, Angew. Chem. Int. Ed. 2017, 56, 5806. doi: 10.1002/anie.201702107.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.