概要
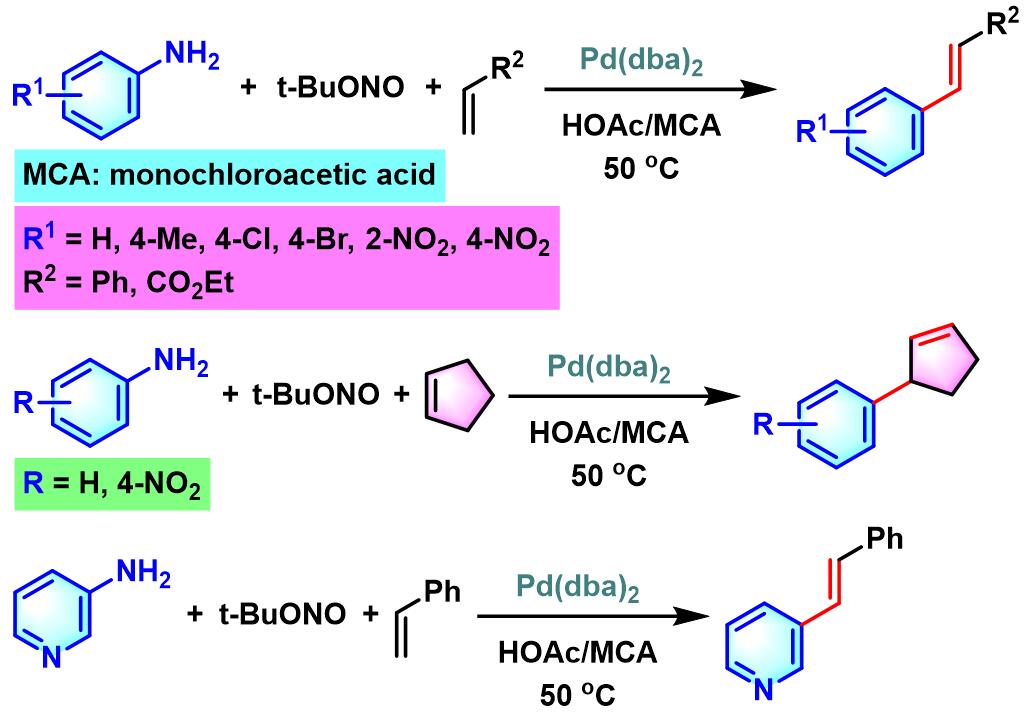
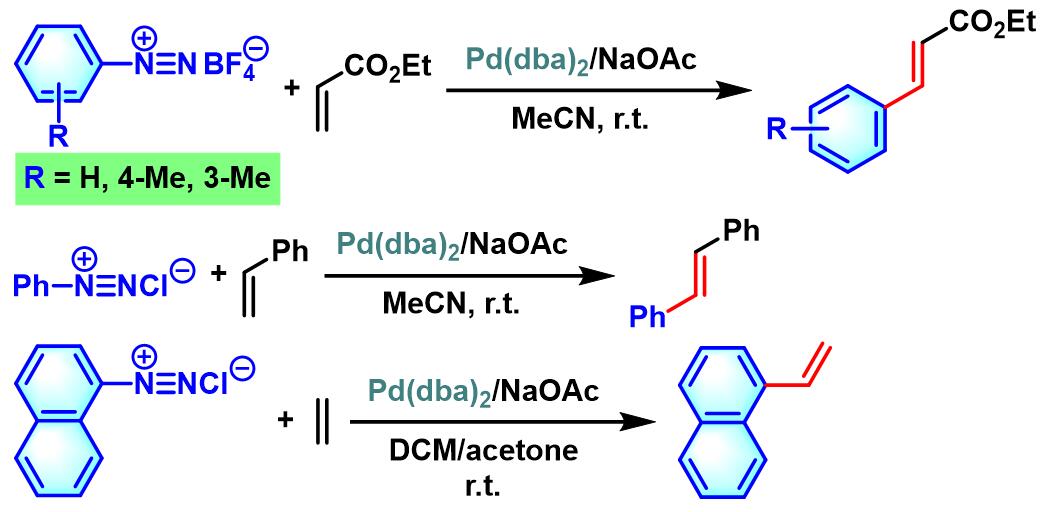
1977年日本Kyushu大学的Matsuda (松田 昴,九州大学工学部合成化学科, Matsuda Tsutomu, Department of Organic Synthesis, Faculty of Engineering, Kyushu University)研究室首次报道了由钯催化剂促进的氯化芳香重氮盐与各类供电子基团取代烯烃之间的交叉偶联过程,成功实现相应供电子基取代烯烃的芳基化[1]。该反应条件对于苯乙烯底物具有较好的(E)-选择性,然而,反应产率中等。
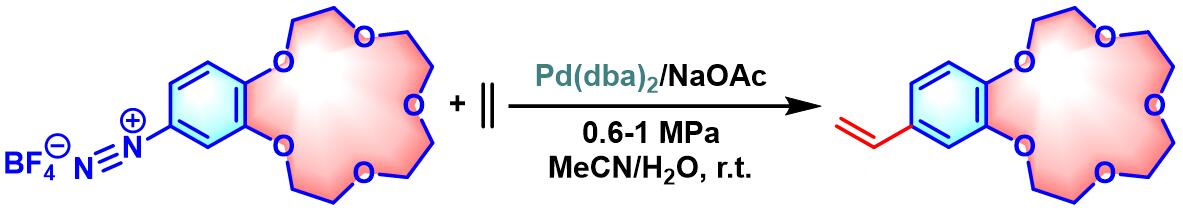
之后,Matsuda采用四氟硼酸芳香重氮盐,将底物扩展至乙烯,并成功实现4ʹ-乙烯基苯并-15-冠-5的合成[2]。
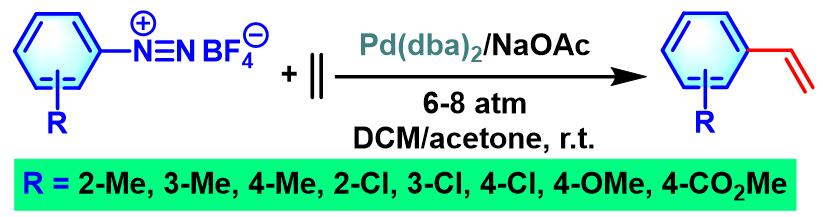
1979年,Matsuda对其它四氟硼酸芳香重氮盐与乙烯的偶联反应进行进一步研究,顺利完成各类取代苯乙烯的合成[3]。
1980年,Matsuda研究发现,通过芳胺与亚硝酸叔丁酯原位生成的芳香重氮盐在钯催化剂存在下,与烯基化合物反应,同样可以有效完成烯烃的(E)-选择性芳基化。同时,还能够使反应产率获得较大提高[4]。
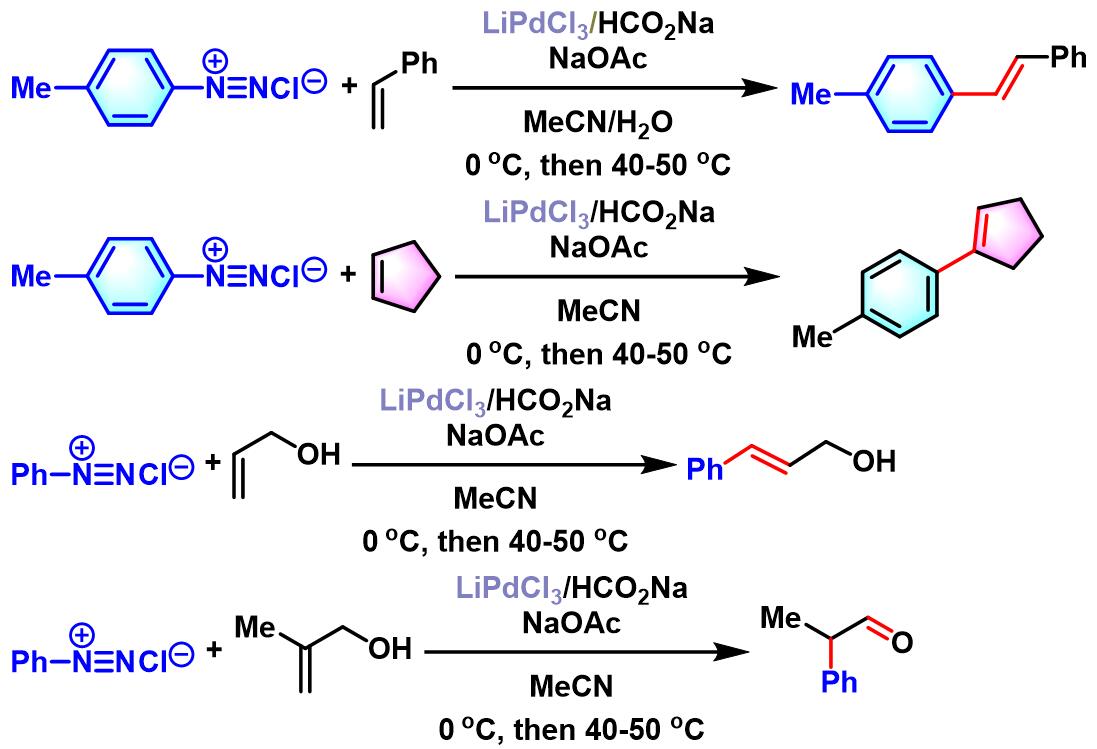
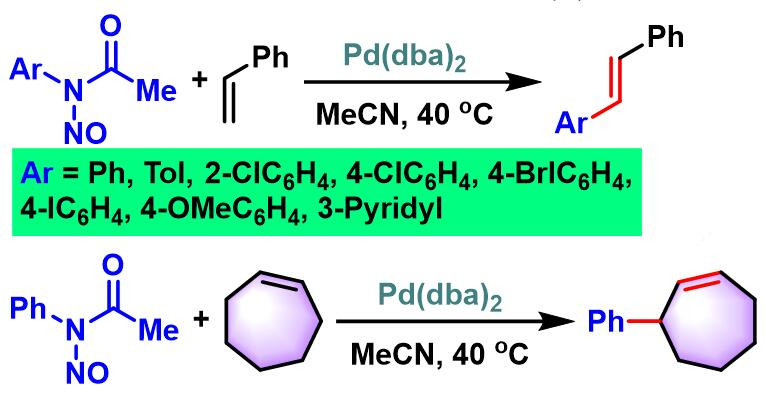
1981年,Matsuda对脂肪族烯烃,环烯烃、烯丙醇、苯乙烯及丙烯酸乙酯等各类烯基底物与芳香重氮盐之间的偶联反应进行了深入研究,发现在钯催化条件下,能够较为方便地实现上述底物的(E)-选择性芳基化[5]。
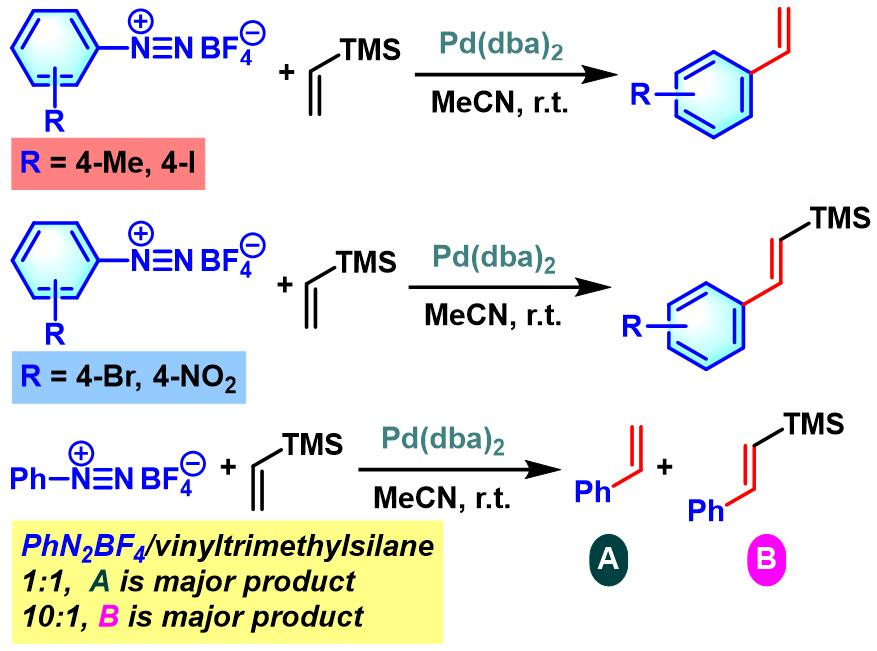
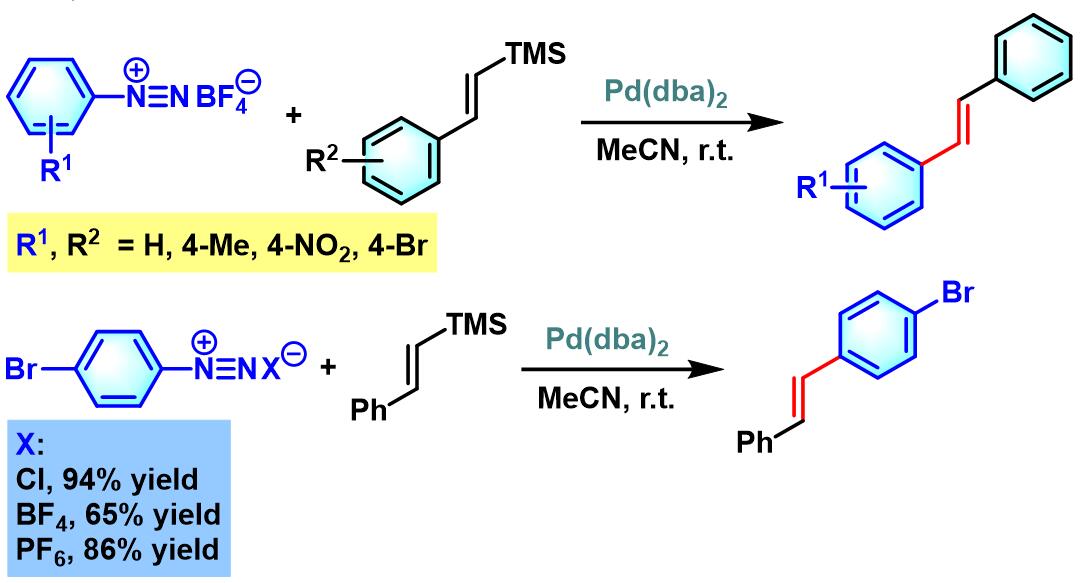
1984年,Kikukawa (菊川 清, 九州大学工学部合成化学科, Kikukawa Kiyoshi, Department of Organic Synthesis, Faculty of Engineering, Kyushu University)将Matsuda发展的偶联方法学应用于乙烯基三甲基硅烷的(E)-选择性芳基化[6]。
之后,Kikukawa进一步对钯催化条件下,(E)-苯乙烯基三甲基硅烷及(Z)-苯乙烯基三甲基硅烷与芳基重氮盐的偶联反应进行了系统研究,发现二者均获得(E)-选择性芳基化产物[7]。
同时,Kikukawa与Ikenaga (池永 和敏,熊本工業大学工業化学科,Ikenaga Kazutoshi, Department of Industrial Chemistry, Kumamoto Institute of Technology)对其它类型的苯乙烯基三烷基硅烷与芳香重氮盐偶联过程的进一步研究,表明采用大位阻烷基取代的硅烷底物,可以获得更高程度的立体选择性[8]。
1985年,Kikukawa进一步将N-亚硝基-N-芳基乙酰胺异构化原位生成的芳香重氮盐,应用于烯烃、取代烯烃及环烯烃的(E)-选择性芳基化[9]。
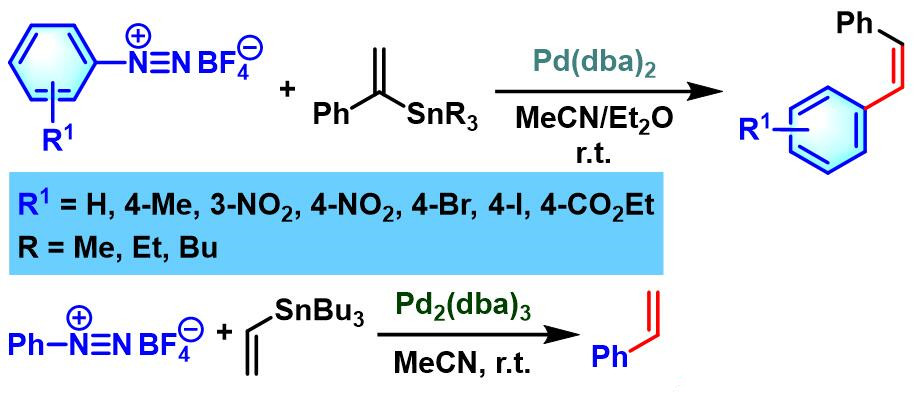
1986年,Kikukawa研究了钯催化剂条件下,各类α-苯乙烯基锡烷与芳香重氮盐的偶联反应,意外地发现反应过程中,立体选择性发生翻转,获得(Z)-二芳基乙烯[10]。
1995年,M. Beller通过合成中常用的Pd/C、Pd/BaSO4及Pd/Al2O3催化剂,完成首例由异相钯催化剂参与的芳香重氮盐与烯基化合物之间的交叉偶联反应[11]。同时,M. Beller惊喜地发现,由上述异相催化剂参与的偶联过程可以在醇类溶剂中顺利进行。
1999年,J. P. Genêt将烯基底物扩展至乙烯基三氟硼酸钾,以良好的产率完成苯乙烯的合成[12]。
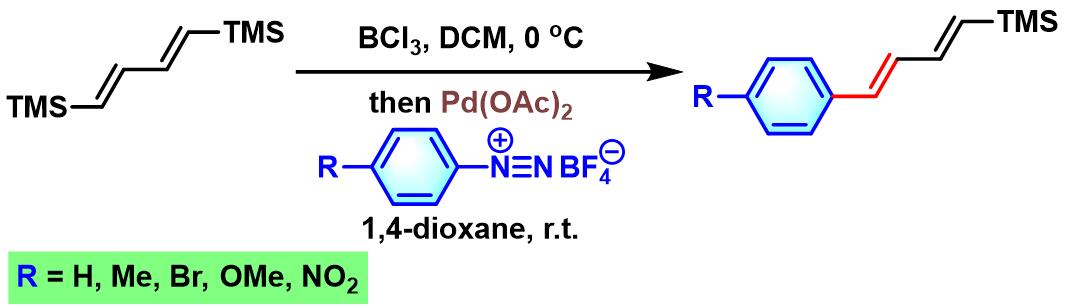
2000年,F. Naso采用三氯化硼原位转金属化形成的烯基硼试剂与芳香重氮盐进行的交叉偶联反应,成功完成芳基乙烯的合成。该方法具有高度的区域及立体选择性[13]。
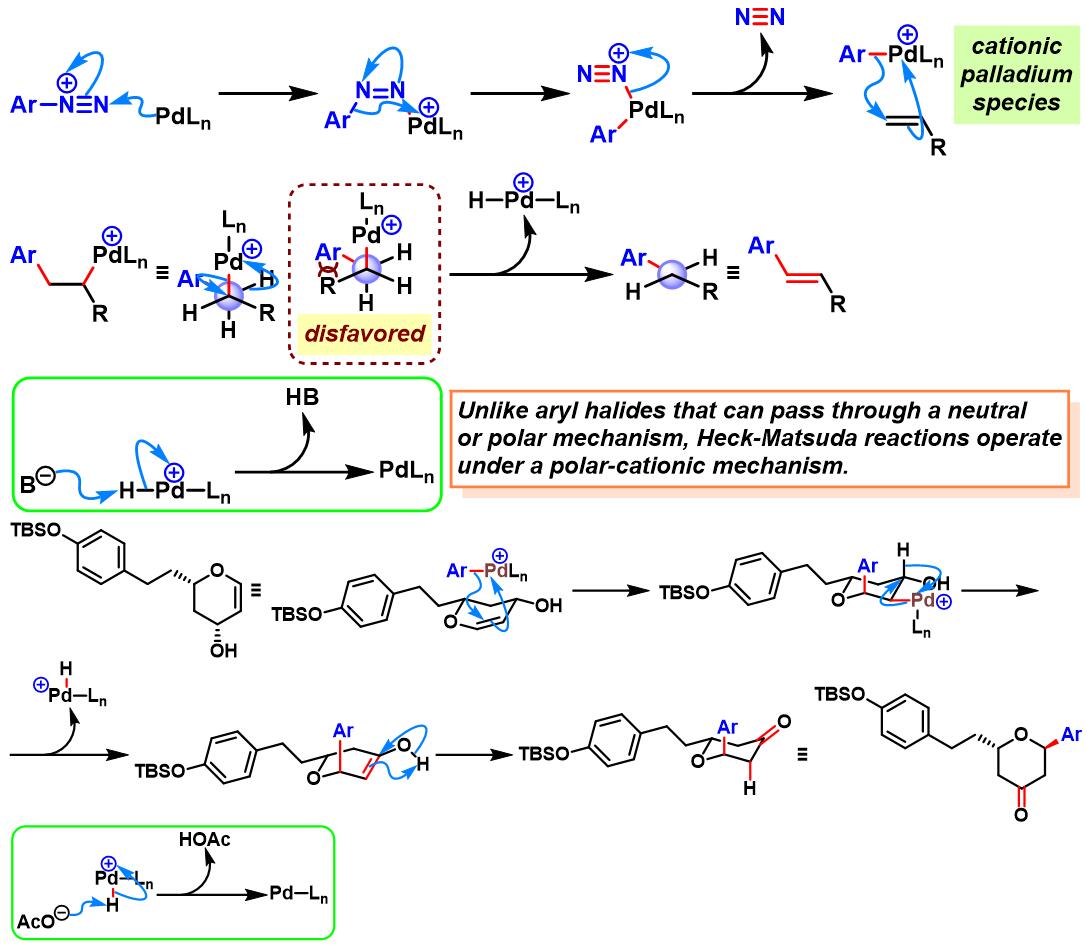
文献中将这种钯催化剂参与的芳香重氮盐与各类烯基化合物之间的交叉偶联过程,形成芳基烯烃或芳基取代的α, β-不饱和化合物的反应称为Heck-Matsuda反应 (Heck-Matsuda reaction)或Matsuda反应 (Matsuda reaction)或Heck-Matsuda芳基化 (Heck-Matsuda arylation)。该反应是对Heck-Mizoroki (溝呂木 勉,東京工業大学資源化学研究所,Mizoroki Tsutomu, Research laboratory of Resources Utilization, Tokyo Institute of Techonology)反应的有力补充。同时,该方法学与Meerwein芳基化反应 (Meerwein arylation)形成互补[1]。目前,该反应已经广泛应用于各类烯基化合物中双键的芳基化[1]-[19]、各类糖苷[20]-[22]、药物[23]-[25]及天然产物全合成[26]-[35]的关键步骤。由于篇幅限制,对于该反应的相关研究进展,小编将在下一期进行详细介绍。
基本文献
- [1] K. Kikukawa, T. Matsuda, Chem. Lett. 1977, 159. doi: 10.1246/cl.1977.159.
- [2] K. Kikukawa, K. Nagira, T. Matsuda, Bull. Chem. Soc. Jpn. 1977, 50, 2207. doi: 10.1246/bcsj.50.2207.
- [3] K. Kikukawa, K. Nagira, N. Terao, F. Wada, T. Matsuda, Bull. Chem. Soc. Jpn. 1979, 52, 2609. doi: 10.1246/bcsj.52.2609.
- [4] K. Kikukawa, K. Maemura, K. Nagira, F. Wada, T. Matsuda, Chem. Lett. 1980, 551. doi: 10.1246/cl.1980.551.
- [5] K. Kikukawa, K. Nagira, F. Wada, T. Matsuda, Tetrahedron 1981, 37, 31. doi: 10.1016/S0040-4020(01)97711-7.
- [6] K. Kikukawa, K. Ikenaga, K. Kono, K. Toritani, F. Wada, T. Matsuda, J. Organomet. Chem. 1984, 270, 277. doi: 10.1016/0022-328X(84)80374-5.
- [7] K. Ikenaga, K. Kikukawa, T. Matsuda, J. Chem. Soc. Perkin Trans. I. 1986, 1959. doi: 10.1039/P19860001959.
- [8] K. Ikenaga, S. Matsumoto, K. Kikukawa, T. Matsuda, Chem. Lett. 1988, 873. doi: 10.1246/cl.1988.873.
- [9] K. Kikukawa, M. Naritomi, G. He, F. Wada, T. Matsuda, J. Org. Chem. 1985, 50, 299. doi: 10.1021/jo00203a003.
- [10] K. Kikukawa, H. Umekawa, T. Matsuda, J. Organomet. Chem. 1986, 311, C44. doi: 10.1016/0022-328X(86)80264-9.
- [11] M. Beller, K. Kühlein, Synlett 1995, 441. doi: 10.1055/s-1995-4981.
- [12] S. Darses, G. Michaud, J. P. Genêt, Eur. J. Org. Chem. 1999, 1875. doi: 10.1002/(sici)1099-0690(199908)1999:8<1875::aid-ejoc1875>3.0.co;2-w.
- [13] F. Babudri, G. M. Farinola, F. Naso, D. Panessa, J. Org. Chem. 2000, 65, 1554. doi: 10.1021/jo9912451.
- [14] A. Roglans, A. Pla-Quintana, M. Moreno-Manas, Chem. Rev. 2006, 106, 4622. doi: 10.1021/cr0509861.
- [15] J. G. Taylor, A. V. Moro, R.C.D. Correia, Eur. J. Org. Chem. 2011, 1403. doi: 10.1002/ejoc.201001620.
- [16] F.X. Felpin, L. Nassar-Hardy, F. Le Callonnec, E. Fouquet, Tetrahedron 2011, 67, 2815. doi: 10.1016/j.tet.2011.02.051.
- [17] B. Schmidt, N. Elizarov, R. Berger, F. Hölter, Org. Biomol. Chem. 2013, 11, 3674 . doi: 10.1039/C3OB40420J.
- [18] C. Rossy, E. Fouquet, F. Felpin, Synthesis 2012, 44, 37. doi: 10.1055/s-0031-1289585.
- [19] J. Yang, H. Zhao, J. He, C. Zhang, Catalysts 2018, 8, 23. doi: 10.3390/catal8010023.
- [20] D. F. Oliveira, E. A. Severino, C. R. D. Correia, Tetrahedron Lett. 1999, 40, 2083. doi: 10.1016/S0040-4039(99)00151-3.
- [21] B. Schmidt, F. A. Hölter, Chem. Eur. J. 2009, 15, 11948. doi: 10.1002/chem.200902053.
- [22] S. Tang, Q. Zheng, D. Xiong, S. Jiang, Q. Li, X. Ye, Org.Lett. 2018, 20, 3079. doi: 10.1021/acs.orglett.8b01117.
- [23] B. Schmidt, N. Elizarov, R. Berger, M. Petersen, Synthesis 2013, 45, 1174. doi: 10.1055/s-0032-1316874.
- [24] C. C. Perez, J. M. Pena, C. R. D. Correia, New J. Chem. 2014, 38, 3933. doi: 10.1039/C4NJ00601A.
- [25] D. Darʹin, G. Kantin, O. Bakulina, R. Žalubovskis, M. Krasavin, Synthesis, 2019, 51, 2230. doi: 10.1055/s-0037-1611211.
- [26] P. Meira, A. Moro, C. R. D. Correia, Synthesis 2007, 2279. doi: 10.1055/s-2007-983781.
- [27] A. V. Moro, M. R. dos Santos, C. R. D. Correia, Eur. J. Org. Chem. 2011, 7259. doi: 10.1002/ejoc.201100886.
- [28] J. G. Taylor, C. R. D. Correia, J. Org. Chem. 2011, 76, 857. doi: 10.1021/jo102134v.
- [29] J. G. Taylor, C. R. D. Correia, J. Org. Chem. 2012, 77, 5220.doi: 10.1021/jo300821w.
- [30] C. Soldi, A. V. Moro, M. G. Pizzolatti, C. R. D. Correia, Eur. J. Org. Chem. 2012, 3607. doi: 10.1002/ejoc.201200308.
- [31] C. C. Oliveira, E.A. F. dos Santos, J. H. B. Nunes, C. R. D. Correia, J. Org. Chem. 2012, 77, 8182. doi: 10.1021/jo3015209.
- [32] Z. Li, F. C. F. Ip, N. Y. Ip, R. Tong, Chem.-Eur. J. 2015, 21, 11152. doi: 10.1002/chem.201501713.
- [33] B. Schmidt, F. Wolf, J. Org. Chem. 2017, 82, 4386. doi: 10.1021/acs.joc.7b00447.
- [34] C. R. D. Correia, S. Kattela, E. C. de Lucca Jr, Chem.-Eur. J. 2018, 24, 17691. doi: 10.1002/chem.201804958.
- [35] C. Frota, E. C. Polo, H. Esteves, C. R. D. Correia, J. Org. Chem. 2018, 83, 2198. doi: 10.1021/acs.joc.7b03098.
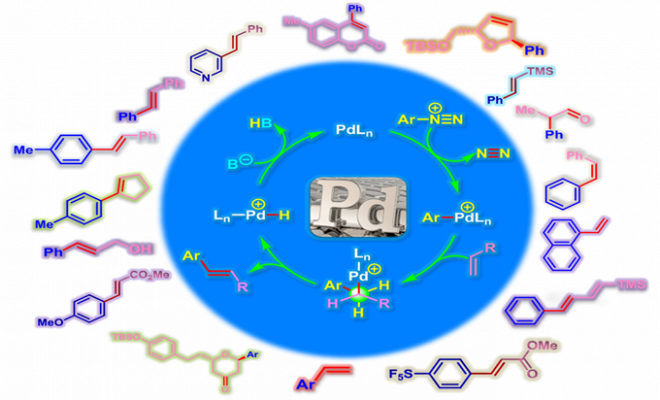
反应机理
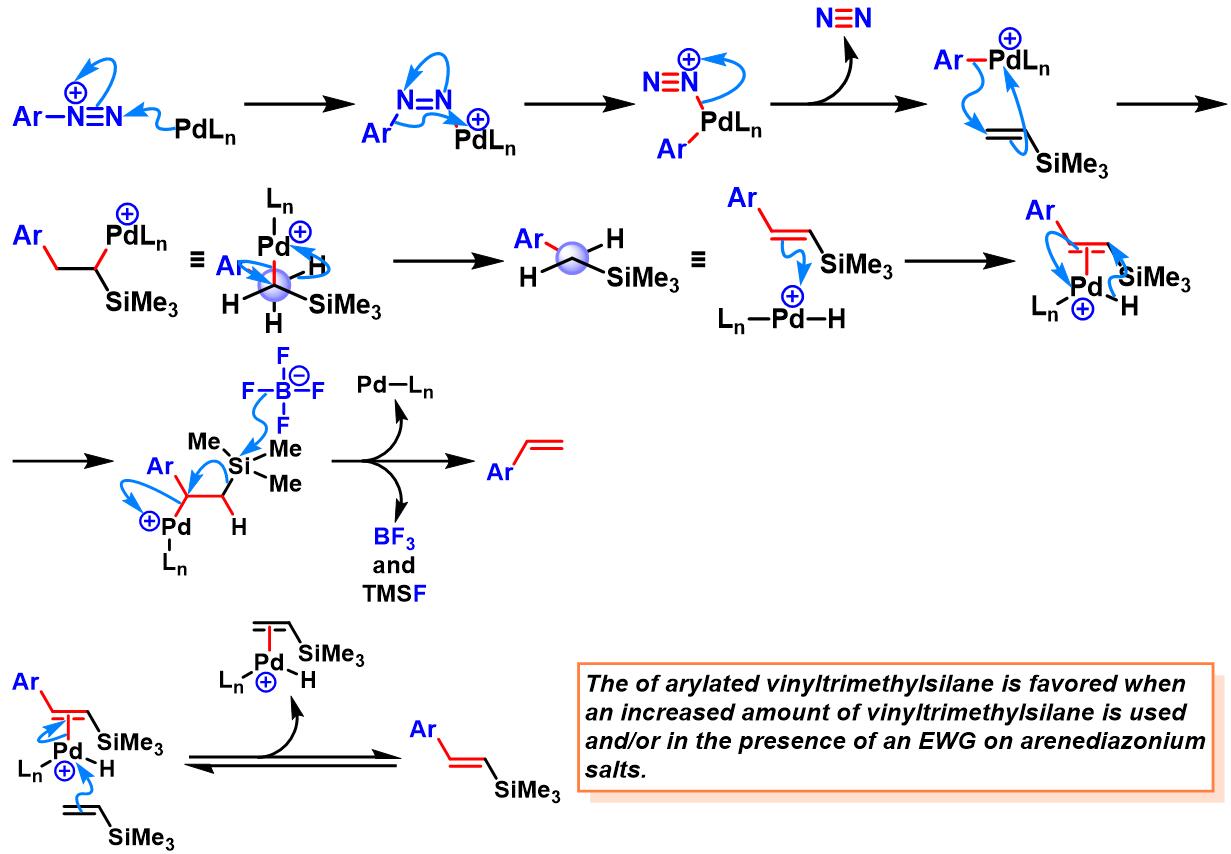
烯烃参与的Heck-Matsuda反应[1]-[7], [11]-[12]
乙烯基三甲基硅烷参与的Heck-Matsuda反应[8]
N-亚硝基-N-芳基乙酰胺异构化原位生成芳香重氮盐[9]
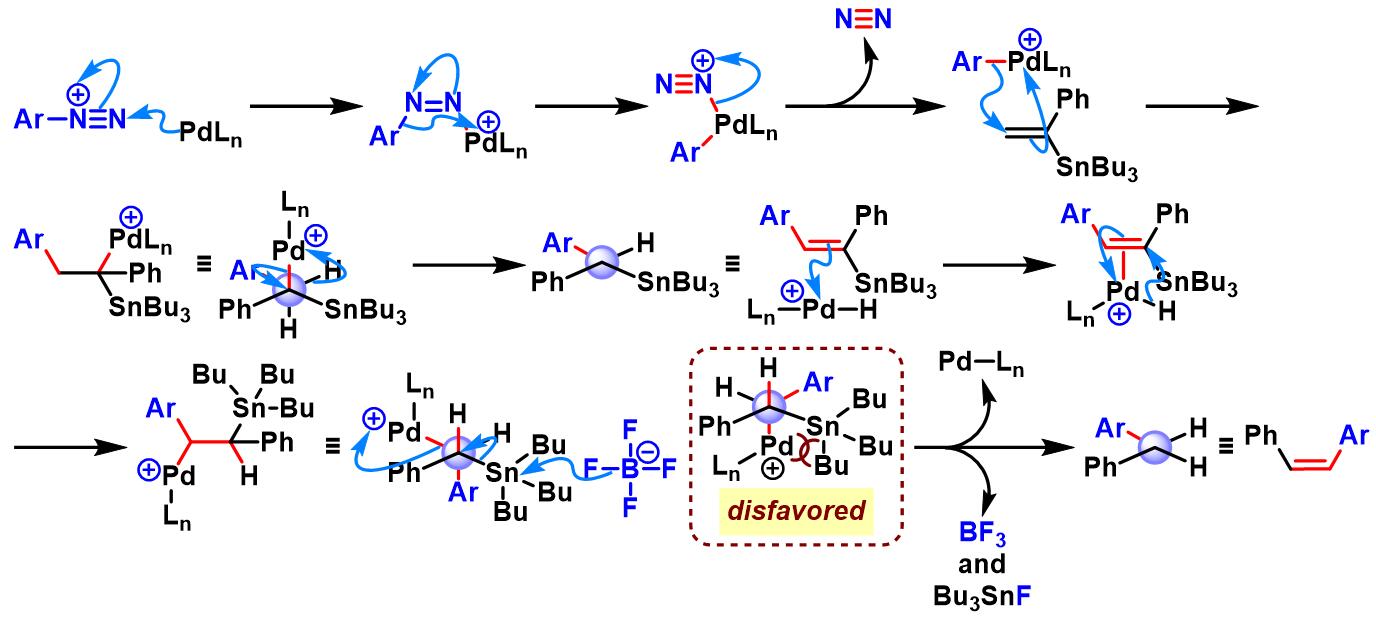
α-苯乙烯基锡烷参与的Heck-Matsuda反应[10]
参考文献
- [1] Sutton, D. Chem. Rev. 1993, 93, 995. doi: 10.1021/cr00019a008.
- [2] R. B. King, J. Organomet. Chem. 1995, 500, 187. doi: 10.1016/0022-328X(95)00504-J.
- [3] R. Yamashita, K. Kikukawa, F. Wada, T. Matsuda, J. Organomet. Chem. 1980, 201, 463. doi: 10.1016/S0022-328X(00)87932-2.
- [4] A. Pla-Quintana, A. Roglans, ARKIVOC 2005, ix, 51. doi: 10.3998/ark.5550190.0006.907.
- [5] F.-X. Felpin, K. Miqueu, J.-M. Sotiropoulos, E. Fouquet, O. Ibarguren, J. Laudien, Chem.-Eur. J. 2010, 16, 5191. doi: 10.1002/chem.200903050 .
- [6] N. Susperregui, K. Miqueu, J.-M. Sotiropoulos, F. Le Callonnec, E. Fouquet, F.-X. Felpin, Chem.-Eur. J. 2012, 18, 7210. doi: 10.1002/chem.201200444.
- [7] A. H. L. Machado, H. M. S. Milagre, L. S. Eberlin, A. A. Sabino, C. R. D. Correia, M. N. Eberlin, Org. Biomol. Chem. 2013, 11, 3277. doi: 10.1039/C3OB40142A.
- [8] K. Kikukawa, K. Ikenaga, K. Kono, K. Toritani, F. Wada, T. Matsuda, J. Organomet. Chem. 1984, 270, 277. doi: 10.1016/0022-328X(84)80374-5.
- [9] K. Kikukawa, M. Naritomi, G. He, F. Wada, T. Matsuda, J. Org. Chem. 1985, 50, 299. doi: 10.1021/jo00203a003.
- [10] K. Kikukawa, H. Umekawa, T. Matsuda, J. Organomet. Chem. 1986, 311, C44. doi: 10.1016/0022-328X(86)80264-9.
- [11] K. S. Reddy, B. Siva, S. D. Reddy, N. R. Naresh, T.V. Pratap, B. V. Rao, Y. Hong, B. V. Kumar, A. K. Raju, P. M. Reddy, A. Hu, Molecules 2020, 25, 2199. doi: 10.3390/molecules25092199.
- [12] A. A. Sabino, A. H. L. Machado, C. R. D. Correia, M. N. Eberlin, Angew. Chem. Int. Ed. 2004, 43, 2514. doi: 10.1002/anie.200353076.
反应实例
共轭聚合物的合成[1]-[2]
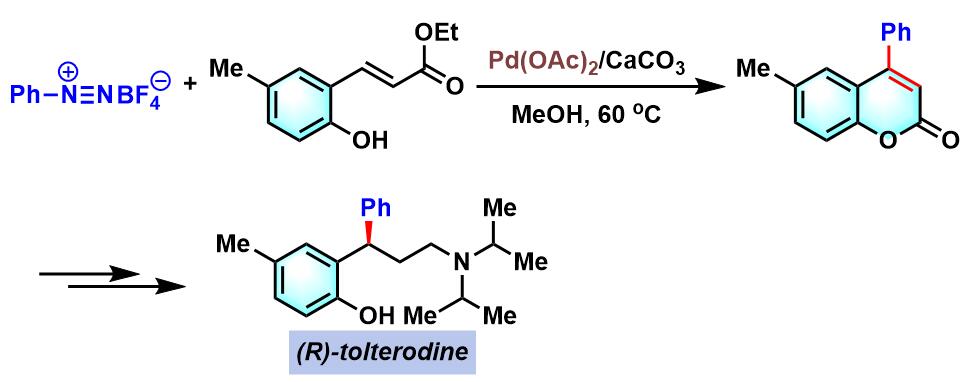
(R)-tolterodine的合成[3]
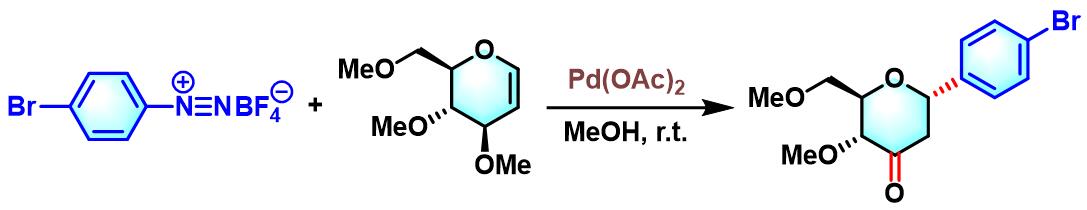
芳基C-糖苷的合成[4]
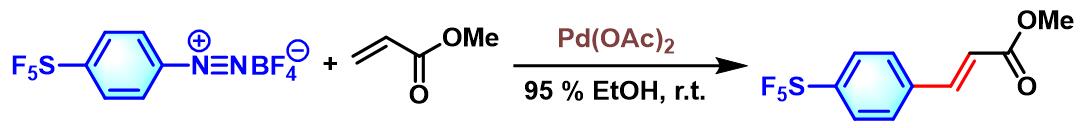
芳基SF5化合物的合成[5]
实验步骤
烯基化合物参与的Heck-Matsuda反应
室温下,向钯催化剂 (0.02 eq.)、乙酸钠 (3 eq.)、烯基化合物(2 eq.)的乙腈溶液 (浓度为 0.625M)中加入四氟硼酸芳香重氮盐 (1 eq.),将上述反应混合物进行搅拌。此时,观察到有大量气体 (氮气)产生。当气体不再产生时,向上述反应混合物中加入饱和碳酸钠溶液,再继续搅拌1h。随后,加入适量乙醚进行萃取。将合并的有机相依次通过饱和氯化钠溶液洗涤与无水硫酸镁干燥。减压除去溶剂后,将粗产物通过硅胶柱色谱或通过减压蒸馏进行纯化,获得相应偶联产物。
参考文献
- [1] F. Babudri, G. M. Farinola, L. C. Lopez, M. G. Martinelli, F. Naso, J. Org. Chem. 2001, 66, 3878. doi: 10.1021/jo001795v.
- [2] R. Ancora, F. Babudri, G. M. Farinola, F. Naso, R. Ragni, Eur. J. Org. Chem. 2002, 4127. doi: 10.1002/1099-0690(200212)2002:24<4127::aid-ejoc4127>3.0.co;2-z.
- [3] D. A. Barancelli, A. G. Salles, J. G. Taylor, C. R. D. Correia, Org. Lett. 2012, 14, 6036. doi: 10.1021/ol302923f.
- [4] A. K. Singh, J. Kandasamy, Org. Biomol. Chem. 2018, 16, 5107. doi: 10.1039/C8OB01393D.
- [5] T. Okazaki, K. K. Laali, S. D. Bunge, S. K. Adas, Eur. J. Org. Chem. 2014, 1630. doi: 10.1002/ejoc.201301538.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.