概要
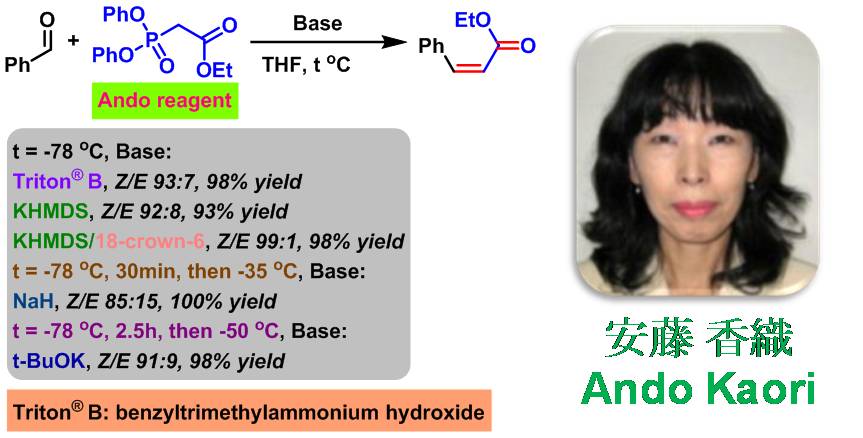
Ando烯基化 (Ando olefination) 又称为Ando-Wittig反应 (Ando-Wittig reaction), 是在强碱性条件下(如Triton® B (或称为TritonTM B, Triton B )、氢化钠、叔丁醇钾或KHMDS),通过乙氧羰基甲基二苯基膦酸酯试剂 (文献中称为Ando试剂或Ando膦酸酯)与醛作用,获得(Z)-α,β-不饱和酯的反应[1]。该反应在1995年由日本Ryukyu大学教育学院 (College of Education, University of the Ryukyu, 琉球大学教育学部)的Ando (Ando Kaori, 安藤 香織)研究组首次报道[1]。
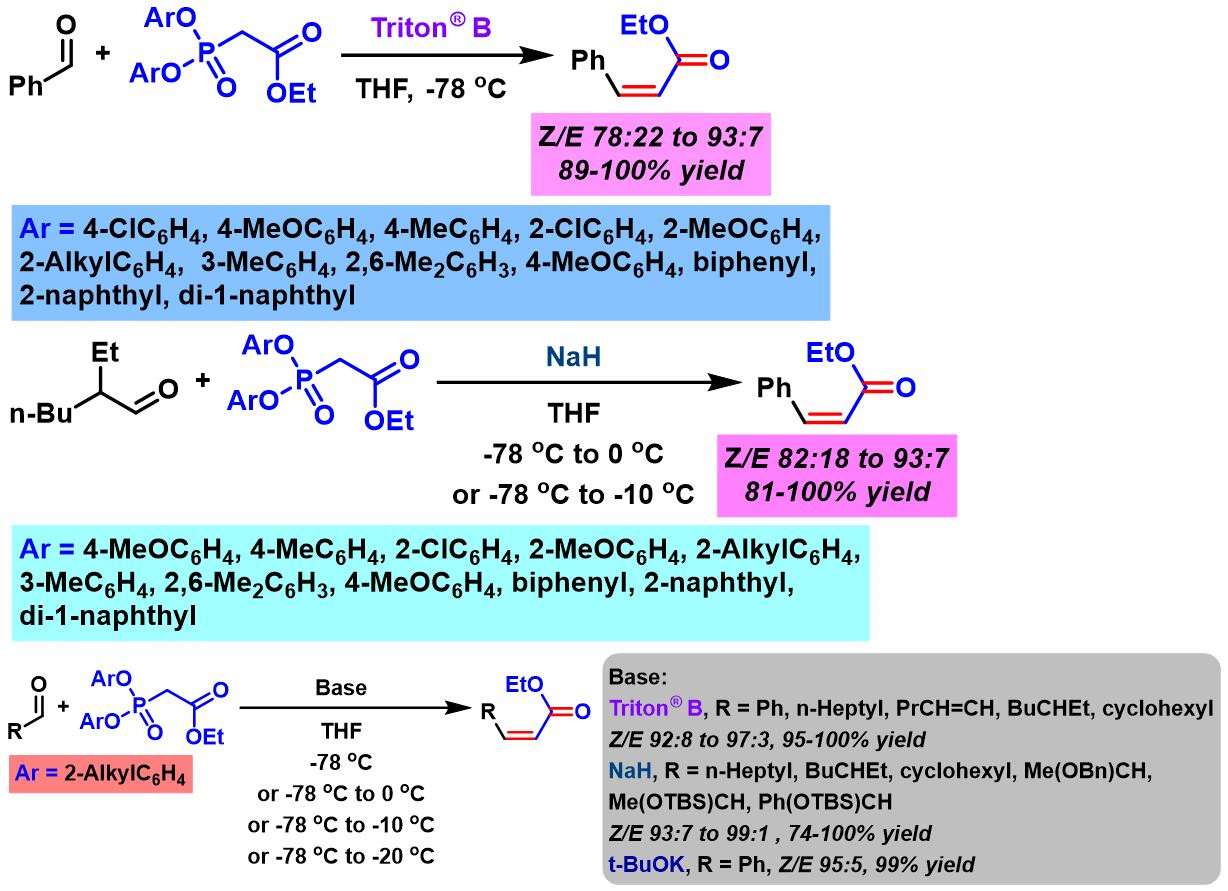
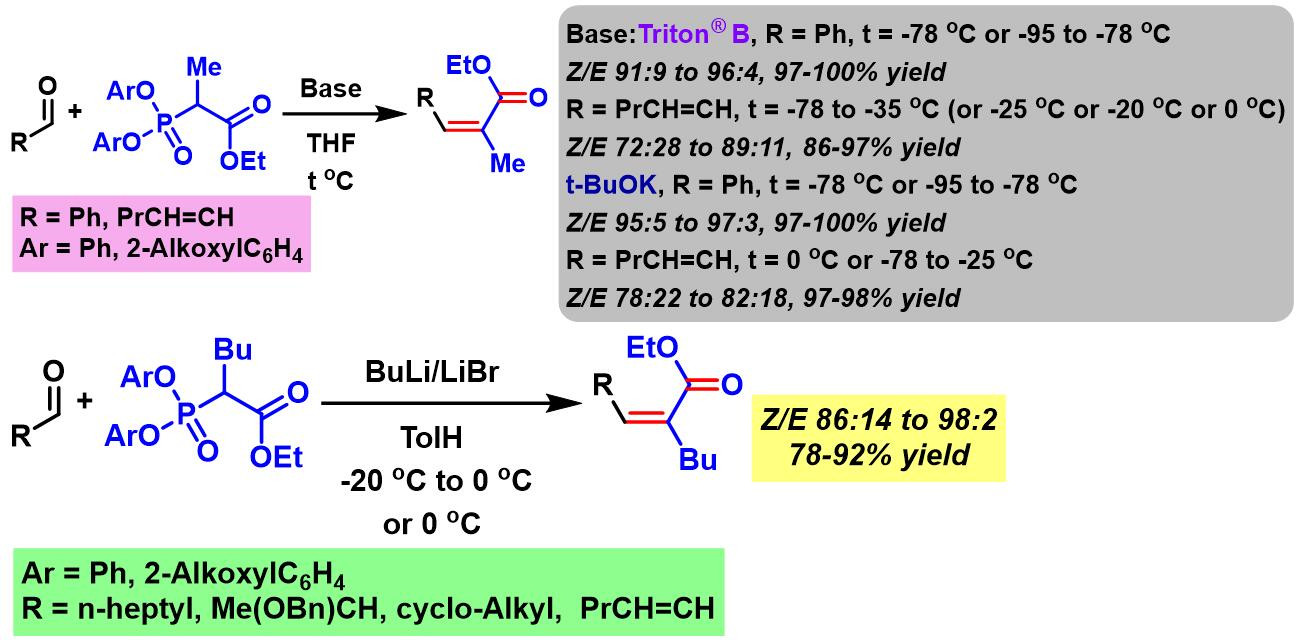
 1997年,Ando继续对上述反应进行深入研究,将底物扩展至各类脂肪醛,并将最初的二苯基膦酸酯试剂扩展至各种二芳基膦酸酯 (diaryl phosphonate) [2]。
1997年,Ando继续对上述反应进行深入研究,将底物扩展至各类脂肪醛,并将最初的二苯基膦酸酯试剂扩展至各种二芳基膦酸酯 (diaryl phosphonate) [2]。
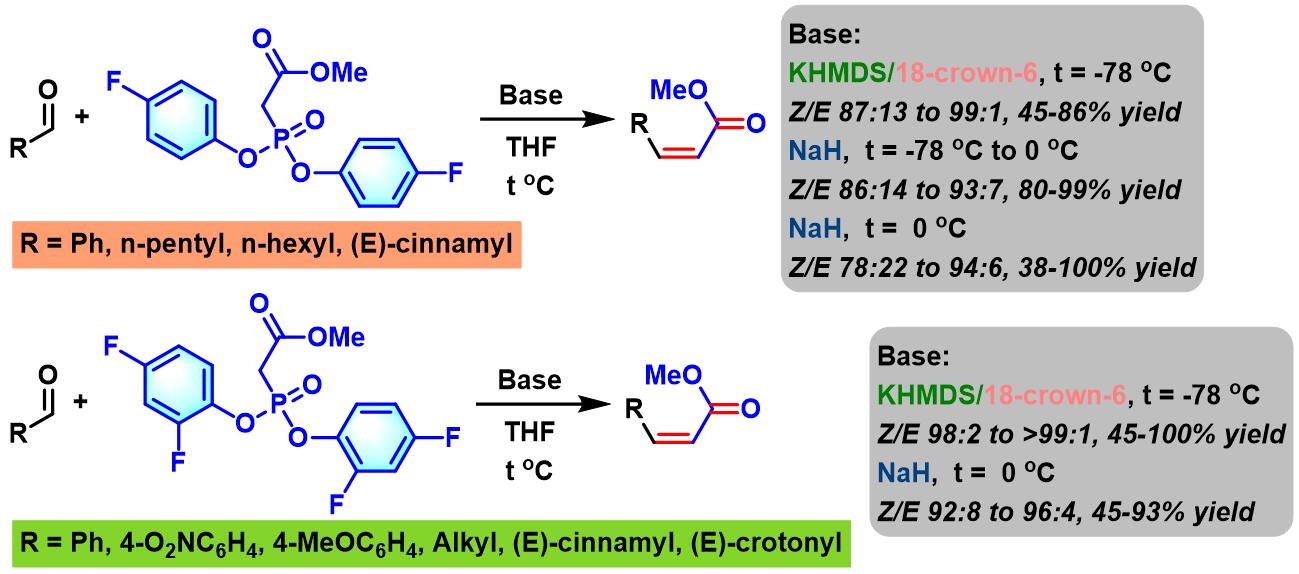
之后,J. Motoyoshiya (Motoyoshiya Jiro, Department of Chemistry, Faculty of Textite Science and Technology, Shinshu University本吉谷 二郎,信州大学繊維学部素材開発化学科)发现采用二氟代芳基膦酸酯试剂,同样可以获得优良的(Z)-立体选择性[3]。
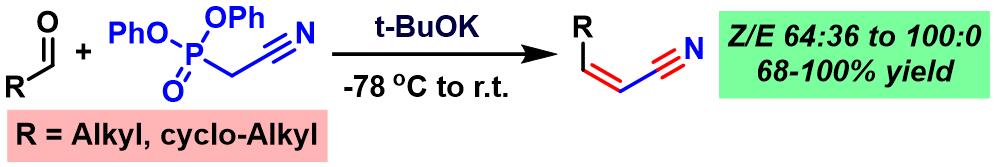
1998年,T. Y. Zhang采用氰甲基二苯基膦酸酯试剂,成功将上述反应条件应用于(Z)-α,β-不饱和腈的合成[4]。
同时,Ando进一步采用乙氧羰基甲基α-取代的二芳基膦酸酯试剂,顺利实现α-取代的(Z)-α,β-不饱和酯的合成[5]。
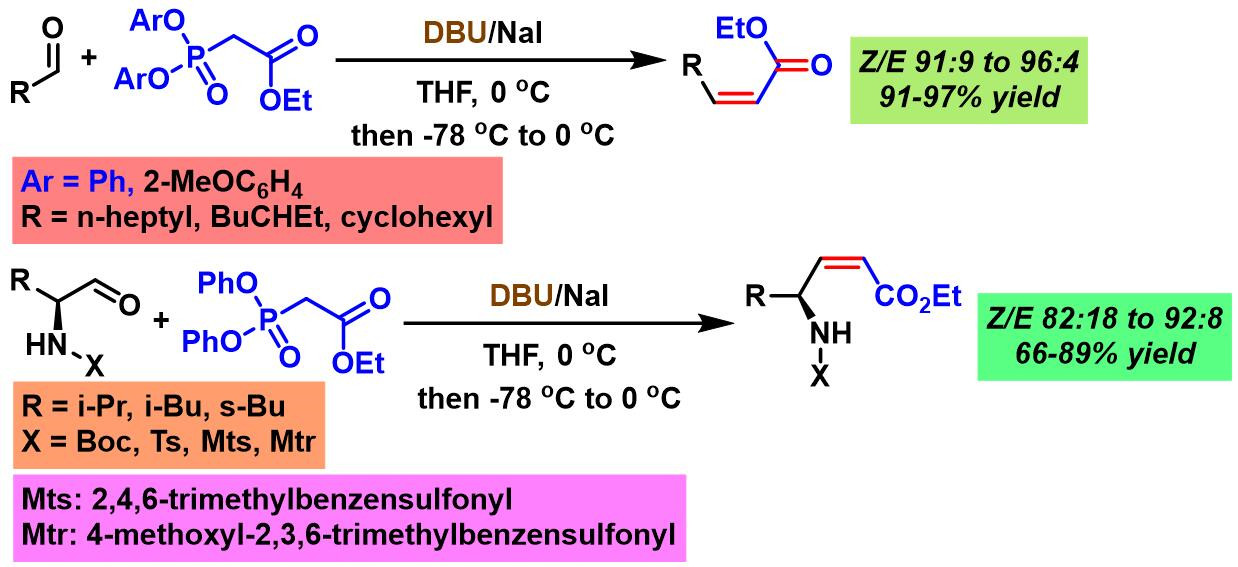
2000年,Ando采用新发展的DBU/NaI碱体系,将底物范围扩展至各种对碱敏感的醛,并获得优良的产率与立体选择性[6]。
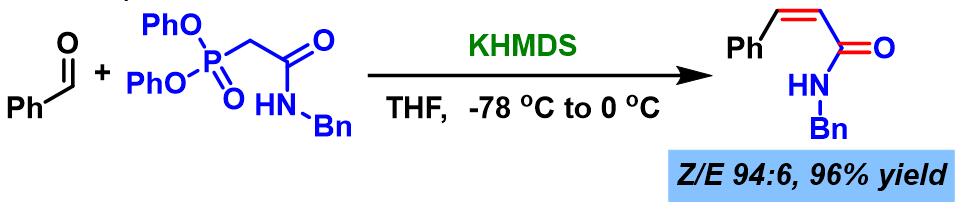
2002年,S. Kojima (Kojima Satoshi, Department of Chemistry, Faculty of Science, Hiroshima University, 小島 聡志, 広島大学理学部化学科)进一步将Ando试剂应用于(Z)-α,β-不饱和酰胺的合成[7]。
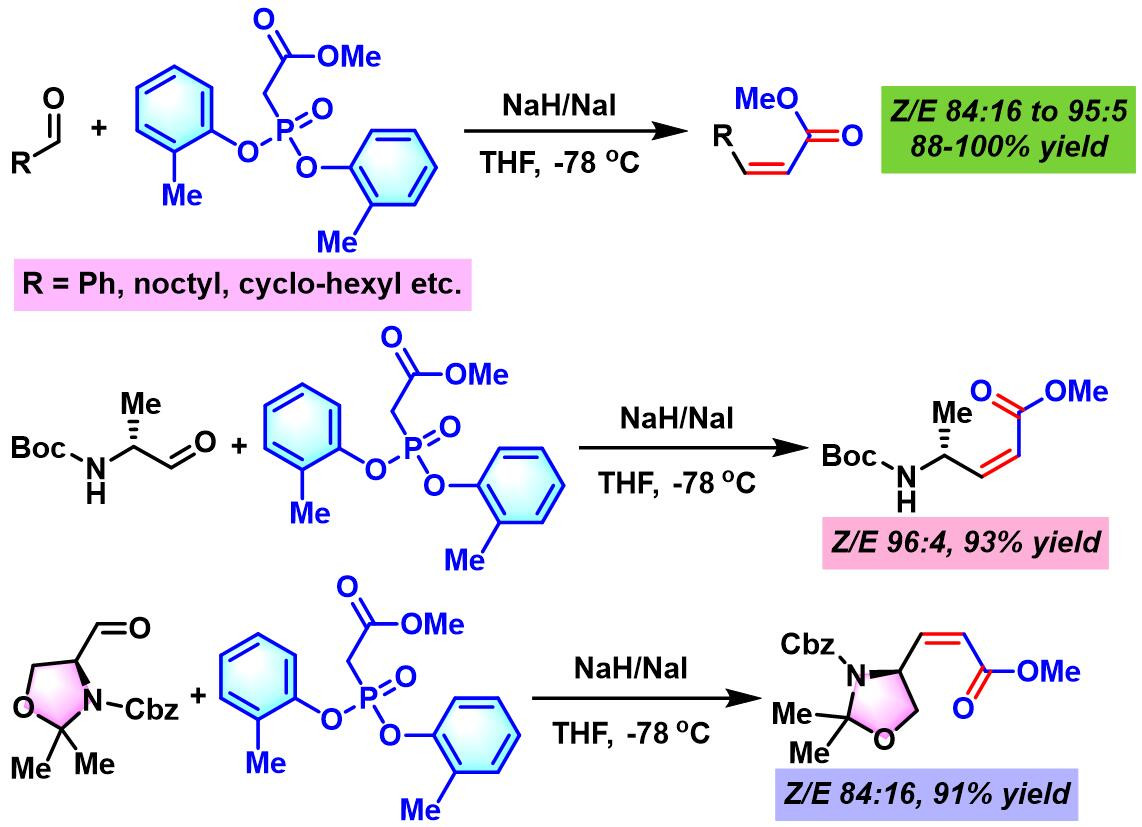
2003年,P. M. Pihko研究室发现采用NaH/NaI体系, 可以更好地适用于各类对碱敏感的醛,并获得优良的产率与立体选择性[8]。
之后,F. P. Touchard采用TMG (tetramethyl guanidine)/NaI碱体系,将Ando试剂进一步扩展至联芳基膦酸酯,并获得优良的产率及(Z)-选择性[9]。
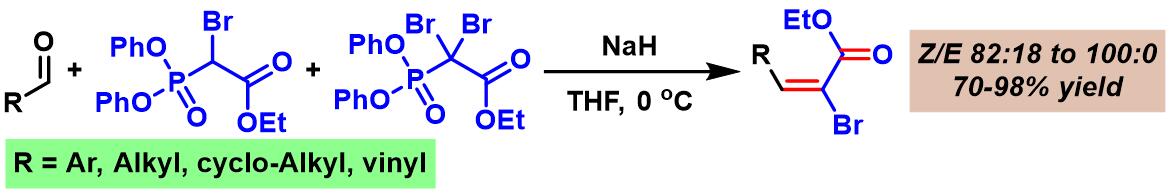
2004年,R. Brückner采用一溴及二溴取代的Ando膦酸酯参与上述烯基化过程。然而,意外地发现与上述反应过程相反的立体选择性,并顺利获得(E)- α-溴代丙烯酸酯类化合物[10]。
2010年,Ando 进一步将DBU/NaI碱体系应用于分子内烯基化过程,顺利完成各类(Z)-α,β-不饱和大环内酯骨架的构建[16]。
Ando烯基化反应具有优良的产率、广泛的底物适用范围及优良的立体选择性。目前,该反应已成为合成(Z)-α,β-不饱和化合物的强有力的方法[11]-[12]。同时,Ando烯基化反应已经广泛应用于各类天然产物全合成的关键步骤[13]-[15]。
基本文献
- [1] K. Ando, Tetrahedron Lett. 1995, 36, 4105. doi: 10.1016/0040-4039(95)00726-S.
- [2] K. Ando, J. Org. Chem. 1997, 62, 1934. doi: 10.1021/jo970057c.
- [3] K. Kokin, J. Motoyoshiya, S. Hayashi, H. Aoyama, Synth. Commun. 1997, 27, 2387. doi: 10.1080/00397919708004100
- [4] T. Y. Zhang, J. C. OʹToole, J. M. Dunigan, Tetrahedron Lett. 1998, 39, 1461. doi: 10.1016/S0040-4039(97)10836-X.
- [5] K. Ando, J. Org. Chem. 1998, 63, 8411. doi: 10.1021/jo981337a.
- [6] K. Ando, T. Oishi, M. Hirama, H. Ohno, T. Ibuka, J. Org. Chem. 2000, 65, 4745. doi: 10.1021/jo000068x.
- [7] S. Kojima, T. Hidaka, Y. Ohba, and K. Ohkata, Phosphorus Sulfur Silicon and the Related Elements, 2002, 177, 729. doi: 10.1080/10426500210268.
- [8] P. M. Pihko, T. M. Salo, Tetrahedron Lett. 2003, 44, 4361. doi: 10.1016/S0040-4039(03)00935-3.
- [9] F. P. Touchard, Eur. J. Org. Chem. 2005, 9, 1790. doi: 10.1002/ejoc.200400769.
- [10] T. Olpp, R. Br Mckner, Synthesis 2004, 2135. doi: 10.1055/s-2004-831166.
- [11] K. Ando, J. Org. Chem. 1999, 64, 8406. doi: 10.1021/jo9907181.
- [12] K. Ando, Synlett, 2001, 1272. doi: 10.1055/s-2001-16072.
- [13] D. Enders, J. L. Vicario, A. J ob, M. Wolberg, M. Müller, Chem. Eur. J. 2002, 8, 4272. doi: 10.1002/1521-3765(20020916)8:18<4272::AID-CHEM4272>3.0.CO;2-K.
- [14] J. T. Feutrill, M. J. Lilly, M. A. Rizzacasa, Org. Lett. 2002, 4, 525. doi: 10.1021/ol017092x.
- [15] H. Masaki, J. Maeyama, K. Kamada, T. Esumi, Y. Iwabuchi, S. Hatakeyama, J. Am. Chem. Soc. 2000, 122, 5216. doi: 10.1021/ja000817s.
- [16] K. Ando, K. Narumiya, H. Takada, T. Teruya, Org. Lett. 2010, 12, 1460. doi: 10.1021/ol100071d.
反应机理
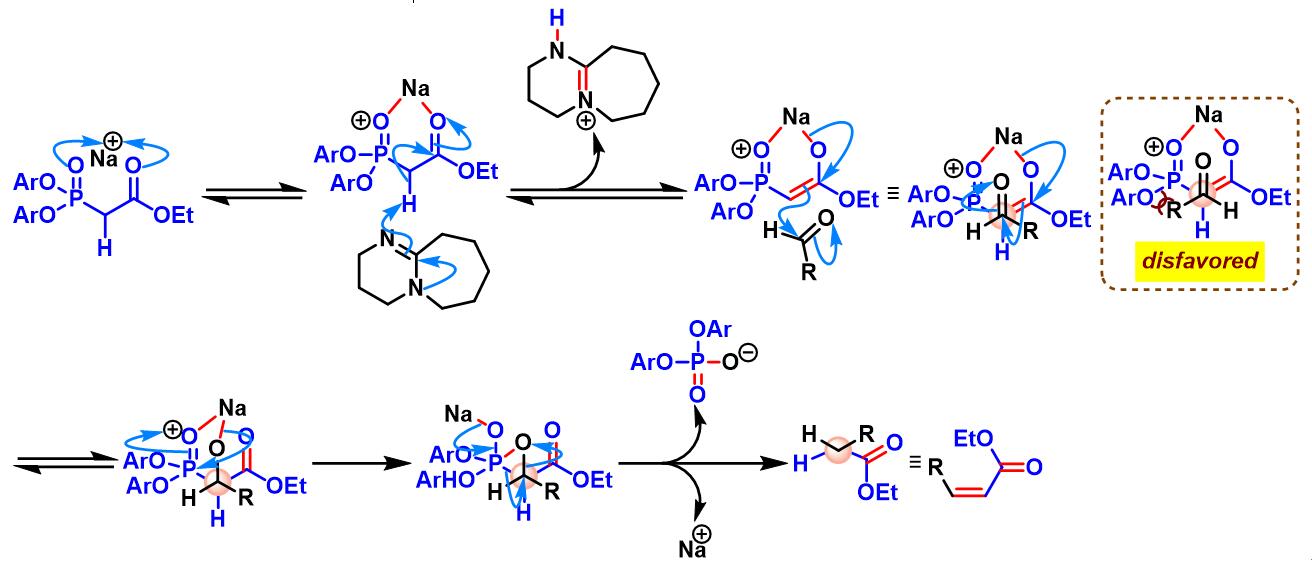
负离子碱参与的Ando烯基化
DBU参与的Ando烯基化
TMG参与的Ando烯基化:采取与DBU促进的烯基化反应相同的机理。
一溴及二溴取代的Ando膦酸酯参与的Ando烯基化
参考文献
- [1] K. Kokin, K. Iitake, Y. Takaguchi, H. Aoyama, S. Hayashi, J. Motoyoshiya, Phosphorus, Sulfur Silicon and the Related Elements, 1998, 133, 21. doi: 10.1080/10426509808032451.
- [2] K. Ando, J. Org. Chem. 1997, 62, 1934. doi: 10.1021/jo970057c.
- [3] K. Ando, J. Org. Chem. 1998, 63, 8411. doi: 10.1021/jo981337a.
- [4] K. Ando, T. Oishi, M. Hirama, H. Ohno, T. Ibuka, J. Org. Chem. 2000, 65, 4745. doi: 10.1021/jo000068x.
反应实例
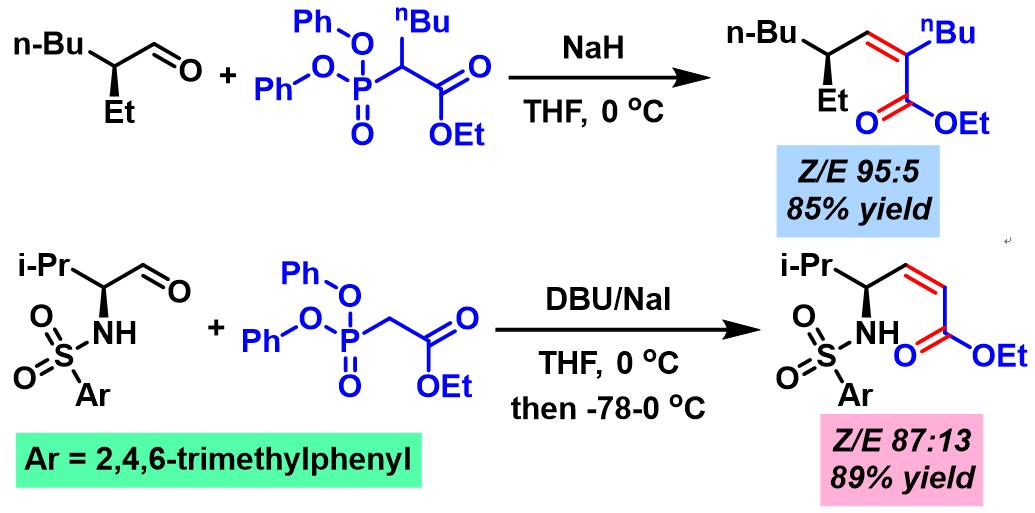
(Z)-α,β-不饱和酯的合成[1]-[2]
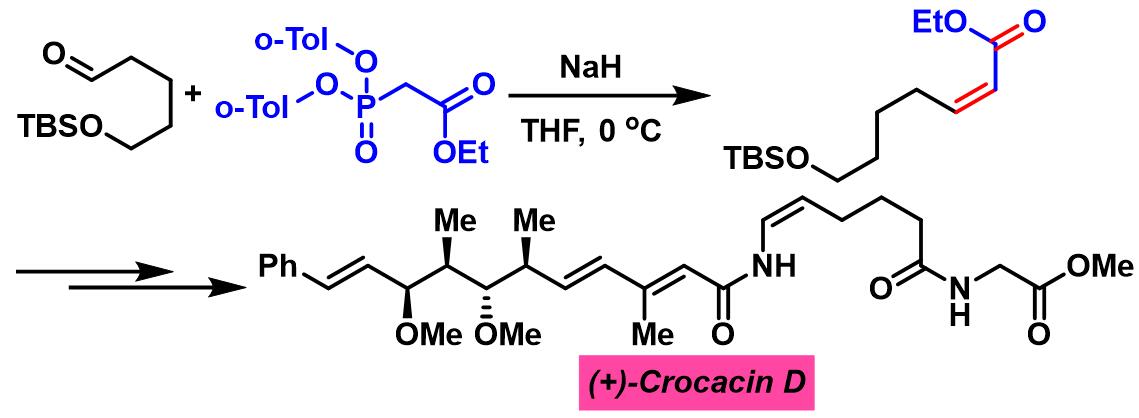
(+)-Crocacin D的全合成[3]
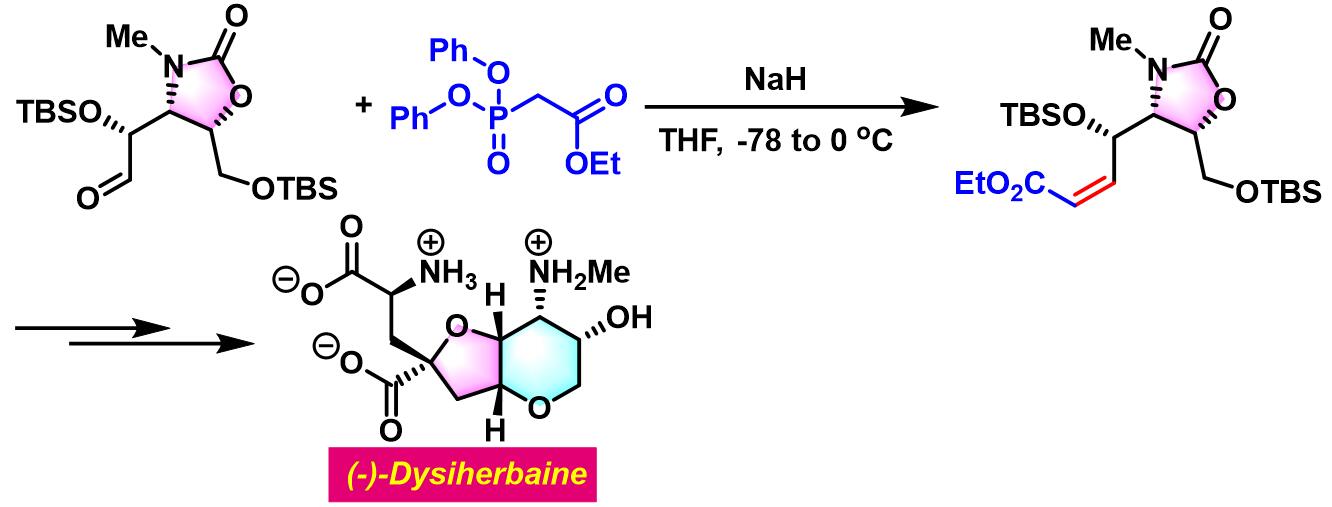
(-)-Dysiherbaine的全合成[4]
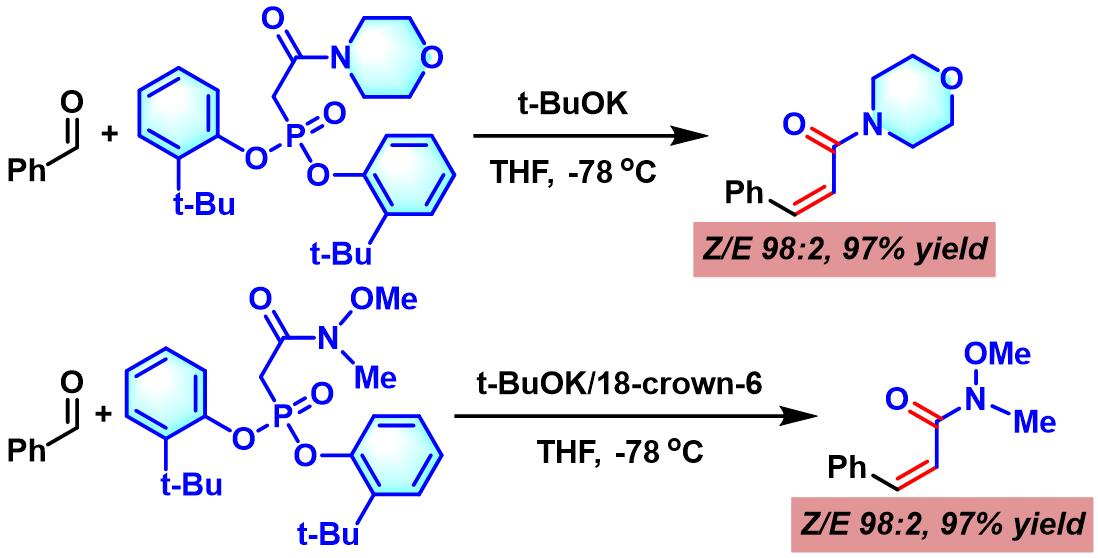
(Z)-α,β-不饱和酰胺的合成[5]
实验步骤
Triton® B或氢化钠参与的Ando烯基化
在-78 °C,氩气气氛下,将芳基膦酸酯 (1 eq. )溶于无水THF (浓度为0.05 M),加入碱 (Triton® B, NaH)之后,将上述混合物搅拌15 min-1h (取决于不同结构的芳基膦酸酯)。随后,再加入醛 (1.1 eq.)。之后,在1-2 h之内,将上述反应混合物逐渐升至所需温度。继续搅拌,直至反应结束。反应结束后,加入饱和氯化铵溶液淬灭反应。淬灭完成后,加入乙酸乙酯进行萃取。将合并的有机相依次通过水及饱和食盐水进行洗涤,再通过无水硫酸镁干燥后,减压除去溶剂。将残余物通过硅胶柱色谱分离纯化后,获得相应烯基化产物。
KHMDS参与的Ando烯基化
在-78 °C,氩气气氛下,将KHMDS (0.5 M 甲苯溶液, 1 eq.)滴加至含有18-冠-6 (5 eq.)的芳基膦酸酯 (1 eq. )的无水THF溶液 (浓度为0.05 M)中。之后,将上述混合物搅拌1h后,再加入醛(1.1 eq.)的无水THF溶液 (底物浓度为0.5 M)。继续搅拌,直至反应结束。反应结束后,将反应混合物升至室温,再加入饱和氯化铵溶液淬灭反应。淬灭完成后,加入乙醚进行萃取。将合并的有机相依次通过水及饱和食盐水洗涤,再通过无水硫酸钠干燥后,减压除去溶剂。将残余物通过硅胶柱色谱分离纯化 (苯作为洗脱剂)后,获得相应烯基化产物。
叔丁醇钾参与的Ando烯基化
在-78 °C,氩气气氛下,将t-BuOK (1 M THF溶液, 1 eq.)滴加至芳基膦酸酯 (1 eq. )的无水THF溶液 (浓度为0.05 M)中。将上述混合物搅拌30 min后,再升温至-65 °C,随后,加入醛 (1.eq. )。对于固体醛,可以通过无水THF (维持底物浓度为0.5 M)溶解后,采用注射器进行滴加。再将上述反应混合物在-78 °C下搅拌10 min后,升至所需温度,继续搅拌,直至反应结束。反应结束后,将反应混合物在室温下,加入饱和氯化铵溶液淬灭反应。淬灭完成后,加入乙醚进行萃取。将合并的有机相依次通过水及饱和食盐水洗涤,再通过无水硫酸钠干燥后,减压除去溶剂。将残余物通过硅胶柱色谱或通过重结晶纯化后,获得相应烯基化产物。
正丁基锂参与的Ando烯基化
在0 °C,氩气气氛下,向芳基膦酸酯 (1 eq. )的无水甲苯溶液 (浓度为0.05 M)中加入溴化锂(3.3 eq. )后,再滴加正丁基锂 (1 M THF溶液, 1.4 eq.)。将上述混合物搅拌30 min后,再加入醛 (1.1 eq. )。后将上述反应混合物在0°C下继续搅拌,直至反应结束。反应结束后,将反应混合物在室温下,加入饱和氯化铵溶液淬灭反应。淬灭完成后,加入乙醚进行萃取。将合并的有机相依次通过水及饱和食盐水洗涤,再通过无水硫酸钠干燥后,减压除去溶剂。将残余物通过硅胶柱色谱或通过重结晶纯化后,获得相应烯基化产物。
DBU/碘化钠的Ando烯基化
在0 °C,氩气气氛下,向芳基膦酸酯 (1 eq. )的无水THF溶液 (浓度为0.1 M)中加入碘化钠 (1.2 eq.)与DBU (1.1 eq.)。将上述混合物搅拌10 min后,再冷却至-78°C,随后,加入醛 (1.1 eq. )。搅拌10 min后,将上述反应混合物缓慢升温至0°C,继续搅拌,直至反应结束。反应结束后,将反应混合物在室温下,加入饱和氯化铵溶液淬灭反应。淬灭完成后,加入乙醚进行萃取。将合并的有机相依次通过水及饱和食盐水洗涤,再通过无水硫酸钠干燥后,减压除去溶剂,将残余物通过硅胶柱色谱或通过重结晶纯化后,获得相应烯基化产物。
氢化钠/碘化钠参与的Ando烯基化
在0 °C,氩气气氛下,向芳基膦酸酯 (1.3 eq. )的无水THF溶液 (浓度为0.11 M)中加入碘化钠 (1 eq.)。将上述混合物搅拌5 min后,再加入氢化钠(1.3 eq.)。将上述反应混合物冷却至-78°C后,加入醛 (1 eq. )。将上述反应混合物维持-78°C,继续搅拌,直至反应结束。反应结束后,将反应混合物在室温下,加入半饱和的氯化铵溶液淬灭反应。淬灭完成后,加入乙醚进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。 将残余物通过硅胶柱色谱或通过重结晶纯化后,获得相应烯基化产物。
NaI/TMG参与的Ando烯基化
在室温,氩气气氛下,将芳基膦酸酯 (1.1 eq. )与碘化钠 (1.3 eq.)溶于无水THF (膦酸酯浓度为0.05 M)中。再将上述混合物冷却至0 °C后,加入TMG (1.2 eq.)。搅拌30 min后,将上述反应混合物冷却至-78°C。最后,加入醛 (1 eq. )。维持-78°C,继续搅拌,直至反应结束。反应结束后,将反应混合物在室温下,加入半饱和的氯化铵溶液淬灭反应。淬灭完成后,加入甲苯进行萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。 将残余物通过硅胶柱色谱或通过重结晶纯化后,获得相应烯基化产物。
一溴及二溴取代的Ando膦酸酯参与的Ando烯基化
在0 °C,氩气气氛下,向一溴及二溴取代Ando膦酸酯 (1.1 eq. )的无水THF溶液 (浓度为0.5-1g /mL)中分批加入NaH (1.2 eq.)。将上述反应混合物搅拌10 min后,加入醛 (1 eq. )。维持-78°C,继续搅拌,直至反应结束。反应结束后,将反应混合物在室温下,加入水进行淬灭。淬灭完成后,再加入MTBE萃取。将合并的有机相通过无水硫酸钠干燥后,减压除去溶剂。残余物通过硅胶柱色谱或通过重结晶纯化后,获得相应烯基化产物。
参考文献
- [1] K. Ando, J. Org. Chem. 1998, 63, 8411. doi: 10.1021/jo981337a.
- [2] K. Ando, T. Oishi, M. Hirama, H. Ohno , T. Ibuka, J. Org. Chem. 2000, 65, 4745. doi: 10.1021/jo000068x.
- [3] J. T. Feutrill, M. J. Lilly, M. A. Rizzacasa, Org. Lett. 2002, 4, 525. doi: 10.1021/ol017092x.
- [4] H. Masaki, J. Maeyama, K. Kamada, T. Esumi, Y. Iwabuchi, S. Hatakeyama, J. Am. Chem. Soc. 2000, 122, 5216. doi: 10.1021/ja000817s.
- [5] K. Ando, S. Nagaya, Y. Tarumi, Tetrahedron Lett. 2009, 50, 5689. doi: 10.1016/j.tetlet.2009.07.130.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.