本文作者 石油醚
概要
Tim J. Donohoe,英国牛津大学化学系教授和牛津大学莫德林学院研究员,有机化学家,课题组主页:http://donohoe.chem.ox.ac.uk/
经历
- 1985-1989年 巴斯大学获得学士学位(Professor T. J. Gallagher)
- 1989-1992年 牛津大学获得博士学位(Prof. S. G. Davies)
- 1993-1994年 博士后研究(Prof. P. D. Magnus FRS)
- 1994-2000年 曼彻斯特大学化学系讲师
- 2000-2001年 曼彻斯特大学化学系读者
- 2001-2004年 牛津大学化学讲师和莫德林学院研究员
- 2004-至今 牛津大学化学系教授和莫德林学院研究员
- 2006-2011年 牛津大学有机化学系主任
获奖经历
- 2015 Editor of Tetrahedron Letters
- 2014 EPSRC Established Career Fellow
- 2014 Royal Society of Chemistry: Charles Rees Award
- 2012 AstraZeneca, GlaxoSmithKline, Pfizer & Syngenta Prize for Process Chemistry Research
- 2011 Royal Society of Chemistry: Synthetic Organic Chemistry Award
- 2006 Royal Society of Chemistry: Corday-Morgan Medal
- 2002 AstraZeneca Award for Organic Chemistry
- 2001 Novartis Young Investigator Award
- 2000 Pfizer Academic Award
- 1998 Glaxo Wellcome award for Innovative Chemistry
- 1998 – 2001 Associate Editor (UK) for the journal Tetrahedron Letters
研究方向
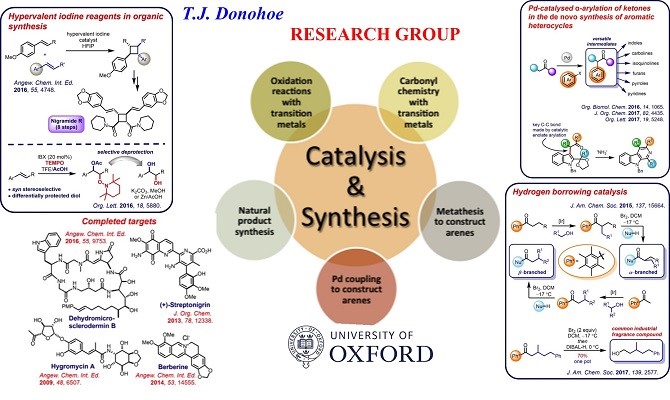
Donohoe小组的研究兴趣在于有机化学对医学和天然产物领域的贡献,以及开发用于有机合成和不对称合成的新方法,利用发展的化学方法来制造具有特殊生物活性的天然产物。
目前在天然产物全合成,转移氢化,氧化,部分还原,钯催化的芳基化等多个方面做出突出的研究。
1. 天然产物全合成1-3
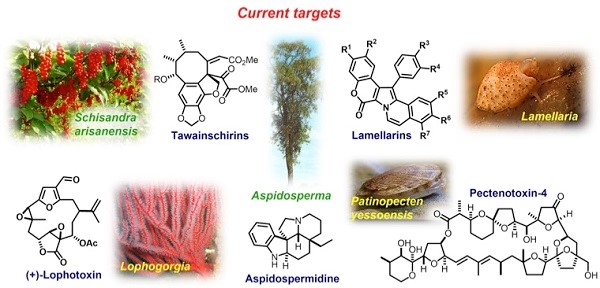
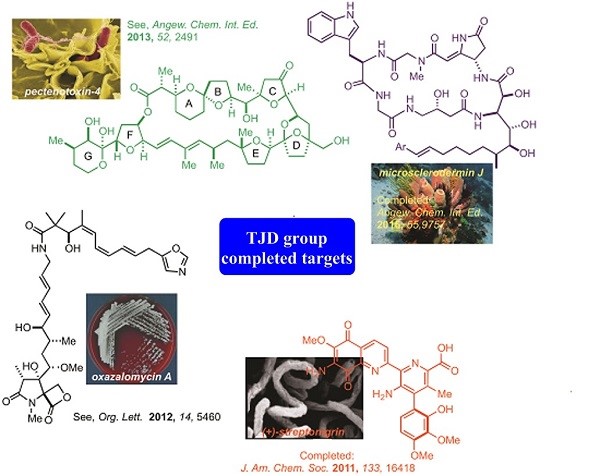
Donohoe小组的研究兴趣在于有机化学对医学和天然产物领域的贡献并开发新方法来对具有生物活性的分子的全合成(Fig.1)。Donohoe小组在有机分子选择性官能化方面的发展了许多新反应,并应用于全合成领域,高效的完成了复杂天然产物的全合成。其中包括:pericosine B, sylvaticin, cis-sylvaticin, hygromycin, dehydromicrosclerodermin B, secosyrin 1, australite, cyclindricine B, lactacystin-β-lactone, deoxypukolide, muscopyridine, streptonigrin and the berberine alkaloids.(Fig.2)
Figure 1 目前的合成目标
Figure 2 已完成的合成目标
2. 转移氢化
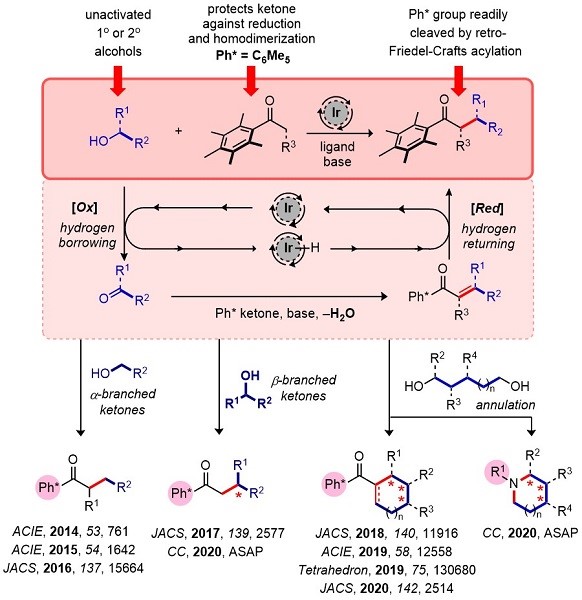
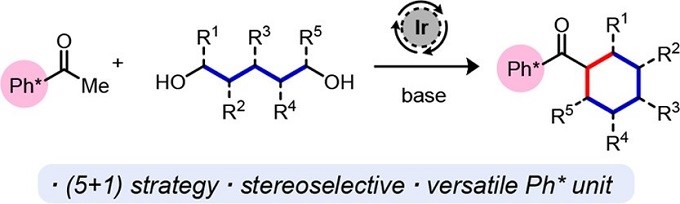
目前,Donohoe小组在转移氢化领域变得活跃起来。转移氢化是形成C-C和C-N键的强大催化方法,并且只能将水作为副产物。最初的工作集中于甲醇在烯醇化烷基化中的作用,而最近的研究已经开发了五甲基苯(Ph *)基团,它是借氢位烷基化反应中强大多用途取代基。Donohoe小组应用转移氢化的方法,构建了一系列具有手性的化合物4-11。
Figure 3 转移氢化
3. 氧化反应
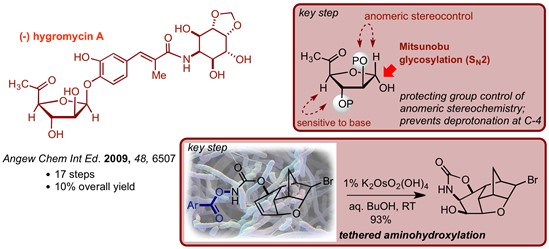
Donohoe小组另外一个研究主题是用催化试剂控制烯烃的氧化。Donohoe教授对烯丙基氨基甲酸酯的束缚氨基羟基化的研究以及对机理的做了详细的解释,并将新的一组基于N-O的再氧化剂引入到催化氨基羟基化反应中得到了一种功能更强大,产率更高的氨基羟基化方法。 Donohoe教授将这种方法以特别有效的方式制备氨基环醇(-)-潮霉素的合成。最终通过使用Mitsunobu糖基化反应以仅17个线性步骤(和10%的总收率)完成了天然产物的合成,从而形成了具有良好立体选择性的困难的糖苷键。
Figure 4 氧化反应
对催化由二醇和氨基醇形成四氢呋喃环和吡咯烷环结构的研究表明,利用Os(IV)-(VI)对可以避免Os(VIII)的存在。并发现了OMs置换/氢化物转移序列,然后在分子内捕获氧离子以形成反式THF(由氘标记支持)。在天然产物(+)-顺式-sylvaticin和(+)-sylvaticin的合成中使用了双氧化环化和氢化物转移的组合反应12-16。
Figure 4 氧化反应
4. 选择性还原17-18
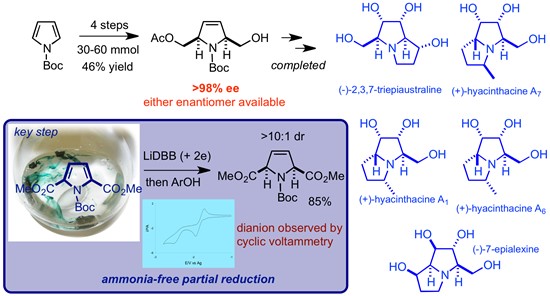
Donohoe教授一直在开发使用单电子还原剂(如(催化)LiDBB)部分还原芳香族杂环的兴趣。目前的工作已经能够以选择性和高收率的方式还原吡咯,吡啶和呋喃,通过这种化学方法制备的杂环对于天然(和药用)产品合成具有很大的潜力。课题组部分还原的方法已经在复杂分子的合成中得到了应用。如包括1-epiaustraline, hyacinthcine A1, omuralide and KSM-2690 B. Current targets include cylindricine A and hyacinthacine家族等。
Figure 5 部分还原
其他
1. Chem-station对其题为“[5 + 1]环化催化合成有取代的环己烷”的工作做了介绍。
2. Angew 对Tim J. Donohoe进行了专题介绍。
参考文献
- [1] Donohoe, T. J., Jones, C. R. & Barbosa, L. C. A.Total Synthesis of (±)-Streptonigrin: De Novo Construction of a Pentasubstituted Pyridine using Ring-Closing Metathesis. J. Am. Chem. Soc. (2011) 133, 16418-16421, doi:10.1021/ja207835w.
- [2] Gatland, A. E., Pilgrim, B. S., Procopiou, P. A. & Donohoe, T. J.Short and Efficient Syntheses of Protoberberine Alkaloids using Palladium-Catalyzed Enolate Arylation. Angew. Chem. Int. Ed. (2014) 53, 14555-14558, doi:10.1002/anie.201409164.
- [3] Donohoe, T. J., Jones, C. R., Kornahrens, A. F., Barbosa, L. C. A., Walport, L. J., Tatton, M. R., Baker, D. B.Total Synthesis of the Antitumor Antibiotic (±)-Streptonigrin: First- and Second-Generation Routes for de Novo Pyridine Formation Using Ring-Closing Metathesis. J. Org. Chem. (2013) 78, 12338-12350, doi:10.1021/jo402388f.
- [4] Armstrong, R. J., Akhtar, W. M., Young, T. A., Duarte, F. & Donohoe, T. J.Catalytic Asymmetric Synthesis of Cyclohexanes by Hydrogen Borrowing Annulations. Angew. Chem. Int. Ed. (2019) 58, 12558-12562, doi:10.1002/anie.201907514.
- [5] Smith, L. B., Armstrong, R. J., Matheau-Raven, D. & Donohoe, T. J.Chemo- and Regioselective Synthesis of Acyl-Cyclohexenes by a Tandem Acceptorless Dehydrogenation-[1,5]-Hydride Shift Cascade. J. Am. Chem. Soc. (2020) 142, 2514-2523, doi:10.1021/jacs.9b12296.
- [6] Grozavu, A., Hepburn, H. B., Smith, P. J., Potukuchi, H. K., Lindsay-Scott, P. J. & Donohoe, T. J.The reductive C3 functionalization of pyridinium and quinolinium salts through iridium-catalysed interrupted transfer hydrogenation. Nat. Chem. (2019) 11, 242-247, doi:10.1038/s41557-018-0178-5.
- [7] Akhtar, W. M., Armstrong, R. J., Frost, J. R., Stevenson, N. G. & Donohoe, T. J.Stereoselective Synthesis of Cyclohexanes via an Iridium Catalyzed (5 + 1) Annulation Strategy. J. Am. Chem. Soc. (2018) 140, 11916-11920, doi:10.1021/jacs.8b07776.
- [8] Akhtar, W. M., Cheong, C. B., Frost, J. R., Christensen, K. E., Stevenson, N. G. & Donohoe, T. J.Hydrogen Borrowing Catalysis with Secondary Alcohols: A New Route for the Generation of β-Branched Carbonyl Compounds. J. Am. Chem. Soc. (2017) 139, 2577-2580, doi:10.1021/jacs.6b12840.
- [9] Frost, J. R., Cheong, C. B., Akhtar, W. M., Caputo, D. F. J., Stevenson, N. G. & Donohoe, T. J.Strategic Application and Transformation of ortho-Disubstituted Phenyl and Cyclopropyl Ketones To Expand the Scope of Hydrogen Borrowing Catalysis. J. Am. Chem. Soc. (2015) 137, 15664-15667, doi:10.1021/jacs.5b11196.
- [10] Shen, D., Poole, D. L., Shotton, C. C., Kornahrens, A. F., Healy, M. P. & Donohoe, T. J.Hydrogen-Borrowing and Interrupted-Hydrogen-Borrowing Reactions of Ketones and Methanol Catalyzed by Iridium. Angew. Chem. Int. Ed. (2015) 54, 1642-1645, doi:10.1002/anie.201410391.
- [11] Chan, L. K. M., Poole, D. L., Shen, D., Healy, M. P. & Donohoe, T. J.Rhodium-Catalyzed Ketone Methylation Using Methanol Under Mild Conditions: Formation of α-Branched Products. Angew. Chem. Int. Ed. (2014) 53, 761-765, doi:10.1002/anie.201307950.
- [12] Roushanbakhti, A., Liu, Y., Winship, P. C. M., Tucker, M. J., Akhtar, W. M., Walter, D. S., Donohoe, T. J.Cobalt versus Osmium: Control of Both trans and cis Selectivity in Construction of the EFG Rings of Pectenotoxin 4. Angew. Chem. Int. Ed. (2017) 56, 14883-14887, doi:10.1002/anie.201708278.
- [13] Donohoe, T. J. & Lipiński, R. M.Interplay of Cascade Oxidative Cyclization and Hydride Shifts in the Synthesis of the ABC Spiroketal Ring System of Pectenotoxin-4. Angew. Chem. Int. Ed. (2013) 52, 2491-2494, doi:10.1002/anie.201208919.
- [14] Donohoe, T. J. & Pullin, R. D. C.Natural product synthesis as a challenging test of newly developed methodology. Chem. Commun. (2012) 48, 11924-11938, doi:10.1039/C2CC36040C.
- [15] Donohoe, T. J., Harris, R. M., Williams, O., Hargaden, G. C., Burrows, J. & Parker, J.Concise Syntheses of the Natural Products (+)-Sylvaticin and (+)-cis-Sylvaticin. J. Am. Chem. Soc. (2009) 131, 12854-12861, doi:10.1021/ja9049959.
- [16] Donohoe, T. J., Harris, R. M., Burrows, J. & Parker, J.Total Synthesis of (+)-cis-Sylvaticin: Double Oxidative Cyclization Reactions Catalyzed by Osmium. J. Am. Chem. Soc. (2006) 128, 13704-13705, doi:10.1021/ja0660148.
- [17] Pilgrim, B. S. & Donohoe, T. J.Osmium-Catalyzed Oxidative Cyclization of Dienes and Their Derivatives. J. Org. Chem. (2013) 78, 2149-2167, doi:10.1021/jo302719y.
- [18] Donohoe, T. J., O’Riordan, T. J. C., Peifer, M., Jones, C. R. & Miles, T. J.Asymmetric Synthesis of the Fully Elaborated Pyrrolidinone Core of Oxazolomycin A. Org. Lett. (2012) 14, 5460-5463, doi:10.1021/ol302541j.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
























No comments yet.