本文作者:孙苏赟
第一部分 基本概述和三类反应
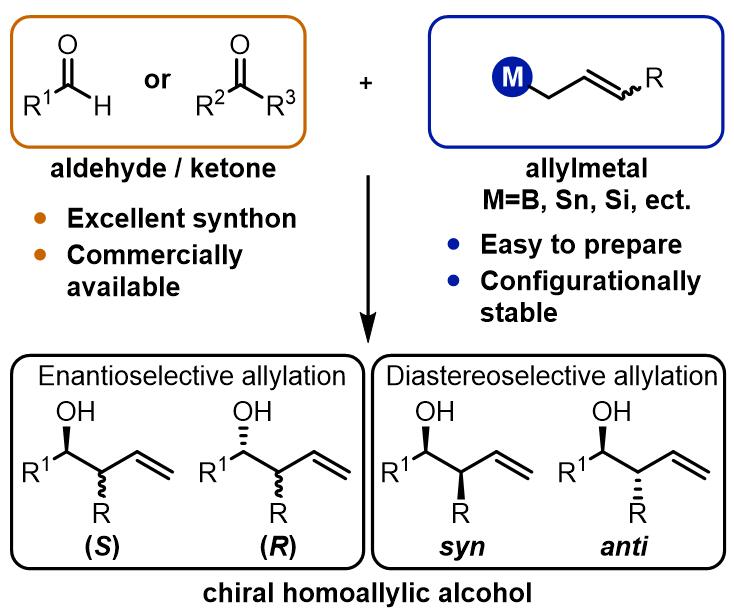
羰基化合物是有机合成中很有用的官能团,制备也非常容易,其烷基化过程和aldol反应我在之前已经有了详细的介绍。这里介绍的羰基化合物的烯丙基化反应:
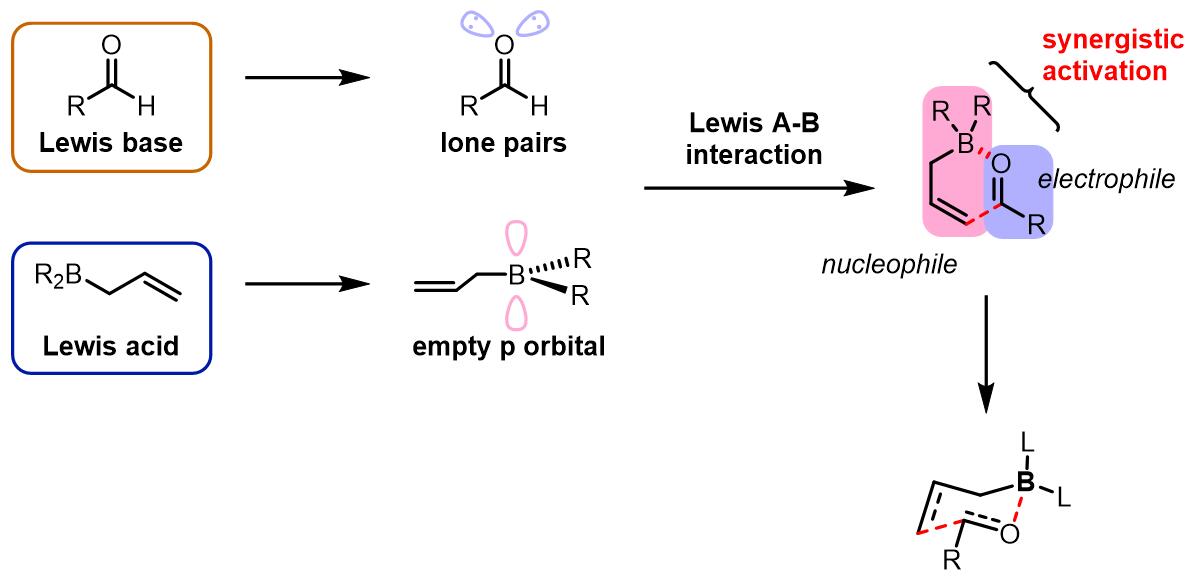
通常此类反应会有手性Lewis酸和Lewis碱参与作为催化剂。一方面Lewis酸和羰基的作用和Lewis碱和烯丙基金属试剂的作用会分别增加两个组分的亲核性和亲电性而促进反应的进行,另一方面可以使得反应具有较高的立体化学选择性:
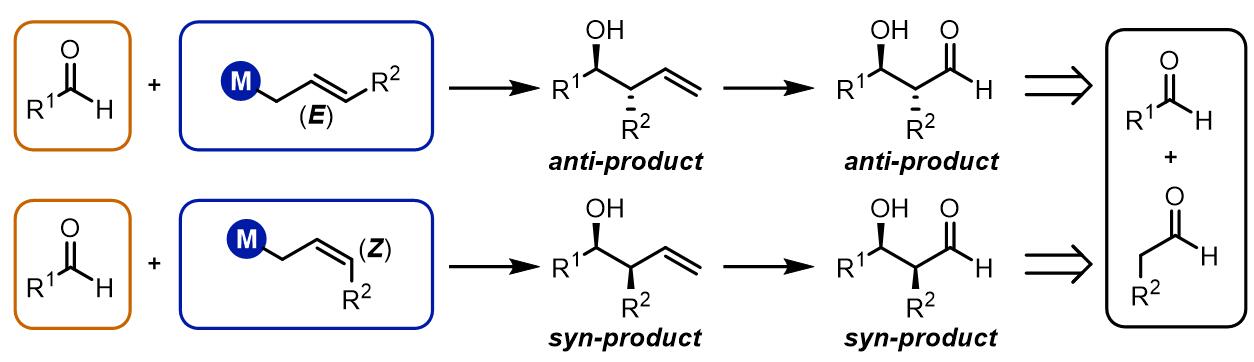
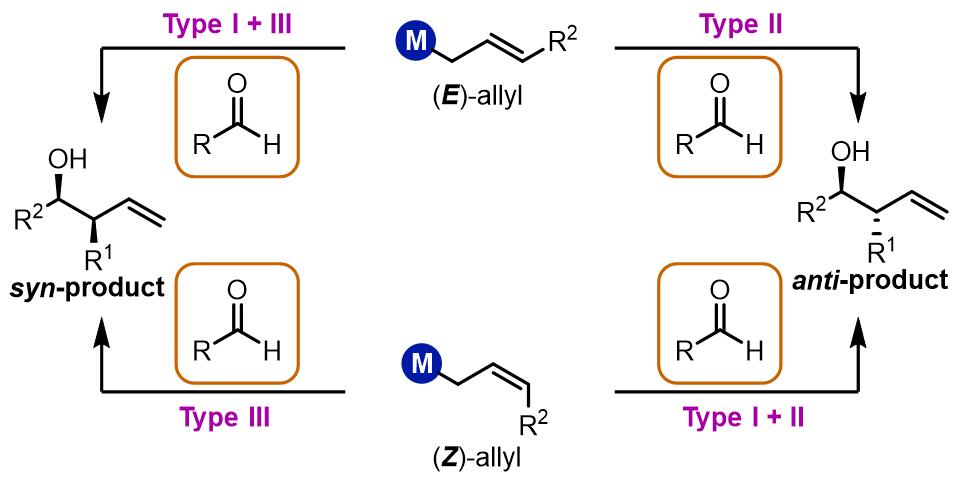
从结果上来看,烯丙基化的羰基化合物在合成中具有羟基和双键双重反应位点,反应产物的立体化学和Aldol缩合是类似的,可以追溯到对应的Aldol缩合的两组分:
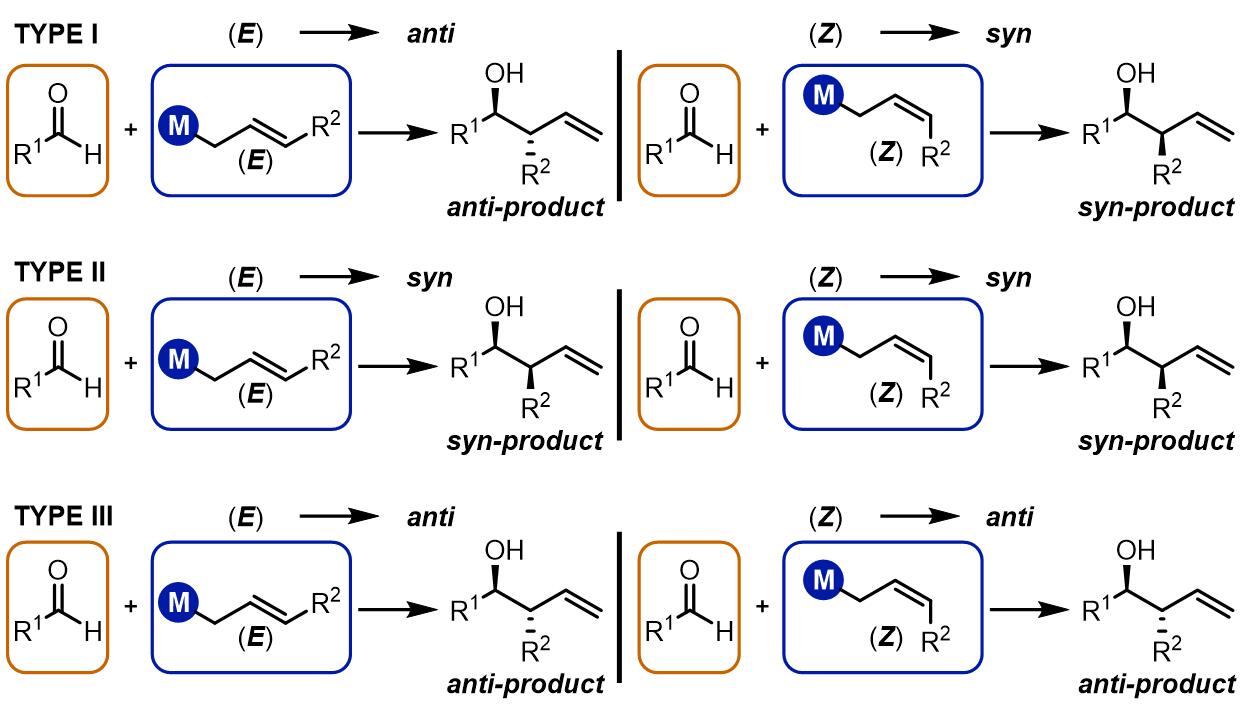
三类烯丙基化反应
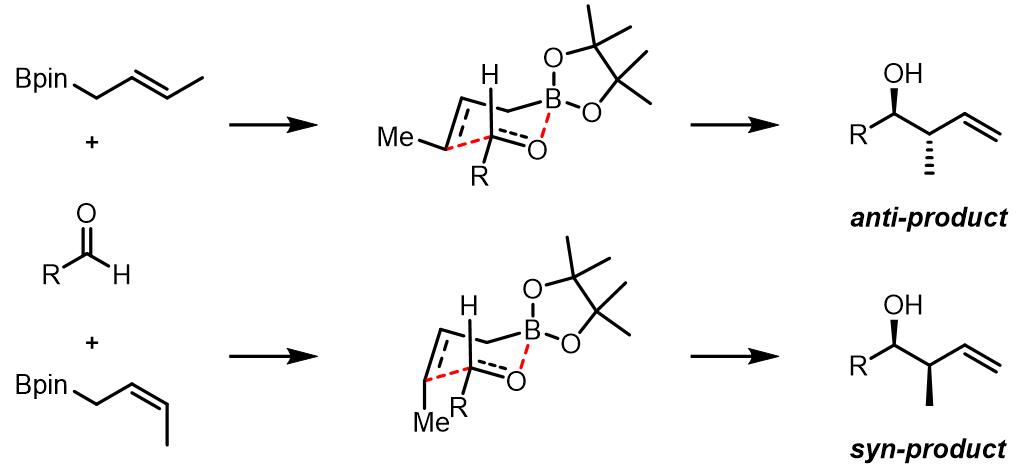
根据烯丙基双键的不同构型得到syn/anti-不同的产物,烯丙基化大致有三类:第一类是E构型得到反式产物,Z构型得到顺式产物,此类反应通常金属试剂为烷基硼试剂,硅试剂和锡试剂等,反应过程是六元环过渡态。第二类是烷基锡试剂和硅试剂等,无论什么构型的双键都会得到顺式产物,反应机理是非环状过渡态;第三类是使用铬试剂、钛试剂和锆试剂等的反应,反应经理六元环过渡态,产物是立体专一的反式产物。
(1) 第一类烯丙基化[1, 2]
通常第一类烯丙基化常通过硼试剂实现。硼原子具有两个空轨道,而羰基氧有两对孤对电子,因此在此过程中硼和氧可以进行很好的Lewis酸碱作用,但是硼氧键相对较短,配位作用不强。
反应选择性如下:
(2) 第二类烯丙基化
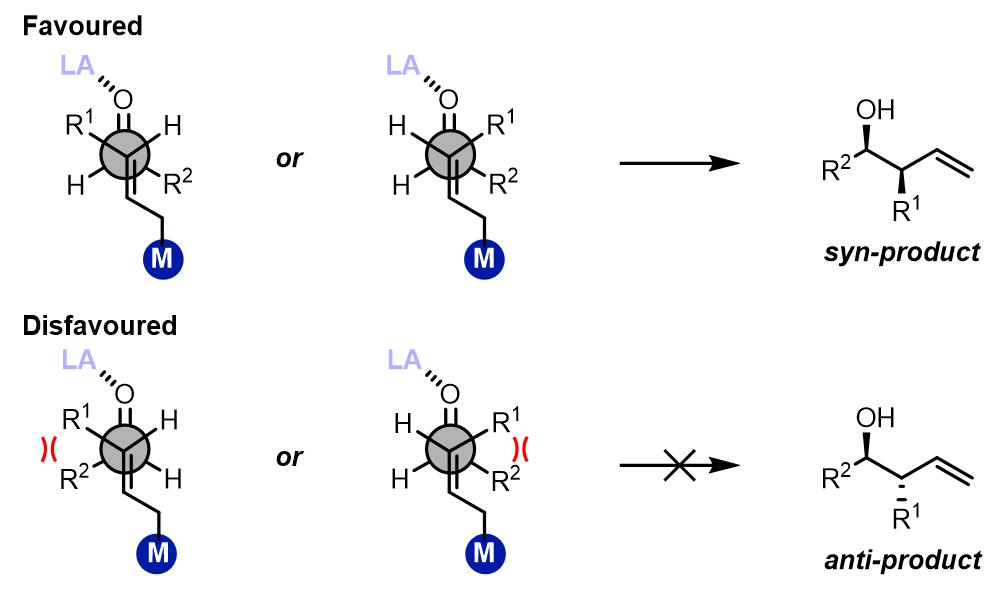
第二类烯丙基化反应的产物是立体专一的anti-产物,通常通过烷基锡试剂实现。因为硅和锡Lewis酸性较小,因此反应的过渡态是非环状过渡态。并且反应中羰基化合物的活性较低,因此通常需要额外添加Lewis酸而提升底物的反应活性。
通常反应过渡态有synclinal和anti-perilanar两种可能的过渡态:
在第一种过渡态中,主要是由底物的位阻效应来决定的:
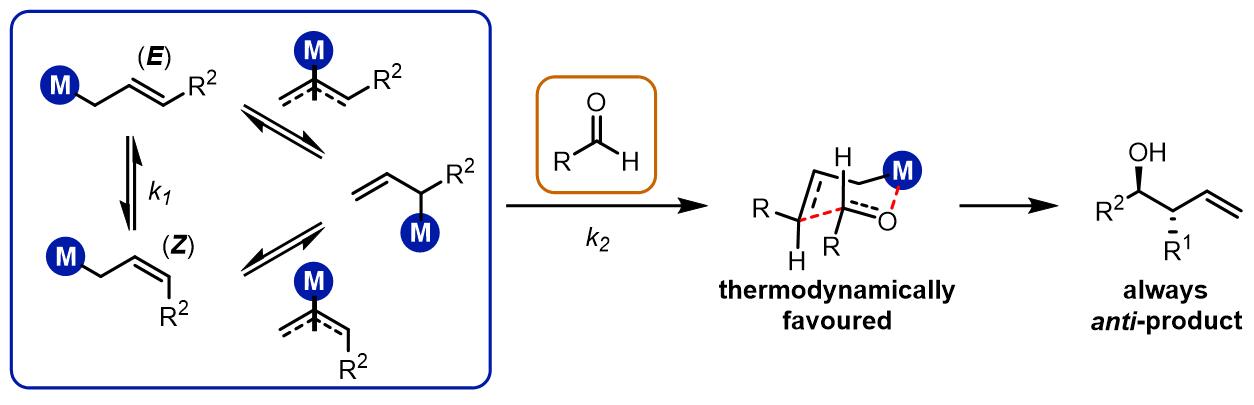
(3) 第三类烯丙基化
第三类烯丙基化的产物是立体专一的anti-产物,通常反应中有过渡金属参与和烯丙基结构配位,动力学关系如下:
例如使用铬试剂参与的反应即为Nozaki-Hiyama-Kishi反应[3]。
三类烯丙基化的小节:
以上的烯丙基化主要在讨论非对映异构选择性,那么为了引入对映异构选择性,后续地又发明了很多种手性烯丙基化试剂和手性配体参与反应,在之后会有详细的讨论。
参考文献
- [1] J. Am. Chem. Soc. 1984, 106, 7970-7971, doi: 10.1021/ja00337a053
- [2] J. Am. Chem. Soc. 1986, 108, 3422-3434, doi: 10.1021/ja00272a043
- [3] J. Am. Chem. Soc. 1977, 99, 3179-3181, doi: 10.1021/ja00451a061
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.