本文作者:陈十五
导读
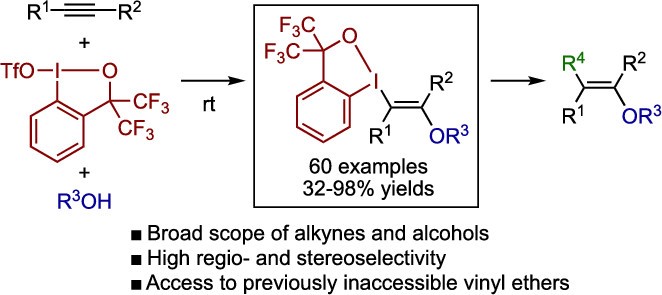
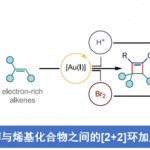
近日,南洋理工大学Yoshikai课题组(Yoshikai教授和吴俊良教授为共同通讯作者)在美国化学会志(Journal of the American Chemical Society)报道了通过环状三价碘亲电试剂和醇对炔的反式1,2-双官能化反应,该反应能以很高的区域和立体选择性合成多取代的乙烯基醚类化合物,还可以兼容各种内炔和端炔,以及各种醇。产物中1,2-苯并碘氧杂茂环部分可以作为通用的合成前体,用于合成结构多样且难以通过其他方式合成的乙烯基醚类化合物。醇的C-O键活化在有机合成中具有重要的作用,由于存在较高的键能从而导致合成上具有一定的难度。
Stereoselective Access to Highly Substituted Vinyl Ethers via trans- Difunctionalization of Alkynes with Alcohols and Iodine(III) Electrophile
Wei Ding, Jinkui Chai, Chen Wang, Junliang Wu,* and Naohiko Yoshikai* J. Am. Chem. Soc. ASAP DOI: 10.1021/jacs.0c04140
正文
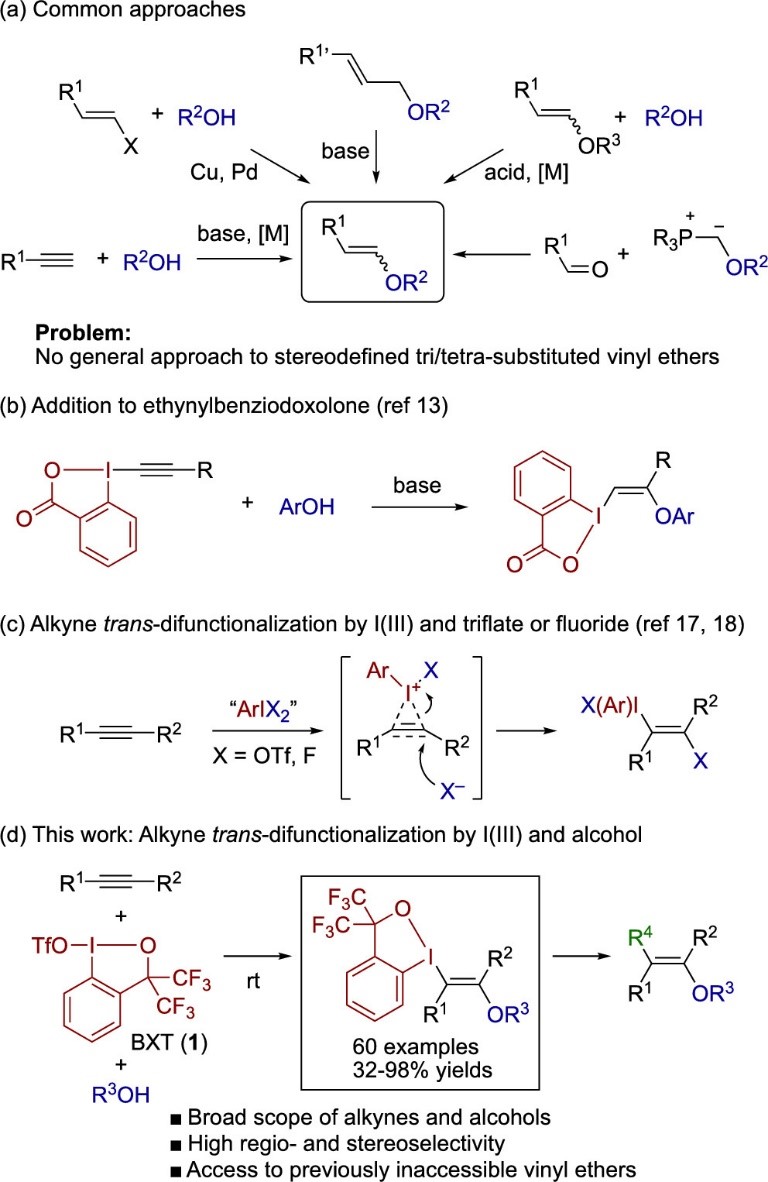
乙烯基醚类化合物一类富电子的烯烃,在有机合成以及高分子化学中被广泛使用。它们常被用于有价值的C-C键的构筑,比如环加成和克莱森重排反应,并被继续探索发展有机方法学。目前发展了多种合成乙烯基醚的方法,包括炔烃的加氢烷氧基化反应,烯基卤化物或硼酸酯与醇之间的C-O偶联反应,酸或金属催化的乙烯基醚交换,烯丙基醚的异构化和Horner−Wittig烯烃化(图1a)。尽管如此,多取代乙烯基醚的立体选择性合成仍然是一个艰巨的挑战,这大大限制了这类化合物在立体控选择性合成三级和四级碳的应用。加氢烷氧基化早已为人所知并且仍然是均相催化中积极研究的主题,但是其底物主要局限于末端炔烃。炔基1,2-苯并碘氧杂茂环酮已被证明可以与苯酚实现立体选择性加成,得到带有1,2-苯并碘氧杂茂环酮的乙烯基醚类化合物(图1b),而这种乙烯基醚的合成需要单独制备每种碘试剂,并且无法得到四取代的衍生物。
图1 乙烯基醚的合成方法
与上述已知方法不同,将醇立体选择性加成到被亲电试剂(E+)活化的炔烃上似乎是一种使用单一试剂制备高度取代乙烯基醚的高效方法,并且基团“E”还能用于后续衍生化。但是,目前尚未有人报道使用普通的卤素亲电试剂(例如溴,碘和N-卤代琥珀酰亚胺)对未活化的末端炔烃和内部炔烃进行转化。因此作者将注意力转移到三价碘物种上,它可以作为潜在的亲电试剂。三氟甲磺酸酯或氟代的碘鎓试剂可作为三价碘亲电试剂促进炔烃和原位生成的亲核试剂发生反式双官能化(图1c),但是所得的乙烯基三氟甲磺酸酯向相应醚的转化并不简单。此前作者就报告了Zhdankin类型的苯并碘氧杂茂环三氟甲磺酸酯(BXT,1)作为三价碘亲电试剂,以促进自身带有亲核基团的炔烃发生成环双官能团化,可以合成大量带有苯并碘氧杂茂环的杂芳烃和稠环芳烃。在本篇工作中,作者报道了一种使用BXT和醇对炔烃的立体选择性反式1,2-双官能化,合成高度取代的乙烯基醚的方法(图1d)。该方法适用于各种内部和末端炔烃,以及各种醇,在温和且无金属的条件下,以良好产率获得相应的β-λ3-碘基乙烯基醚。产物的三价碘基团可以很容易地用于后续转化获得结构多样的乙烯基醚,而这些乙烯基醚很难通过现有方法合成。
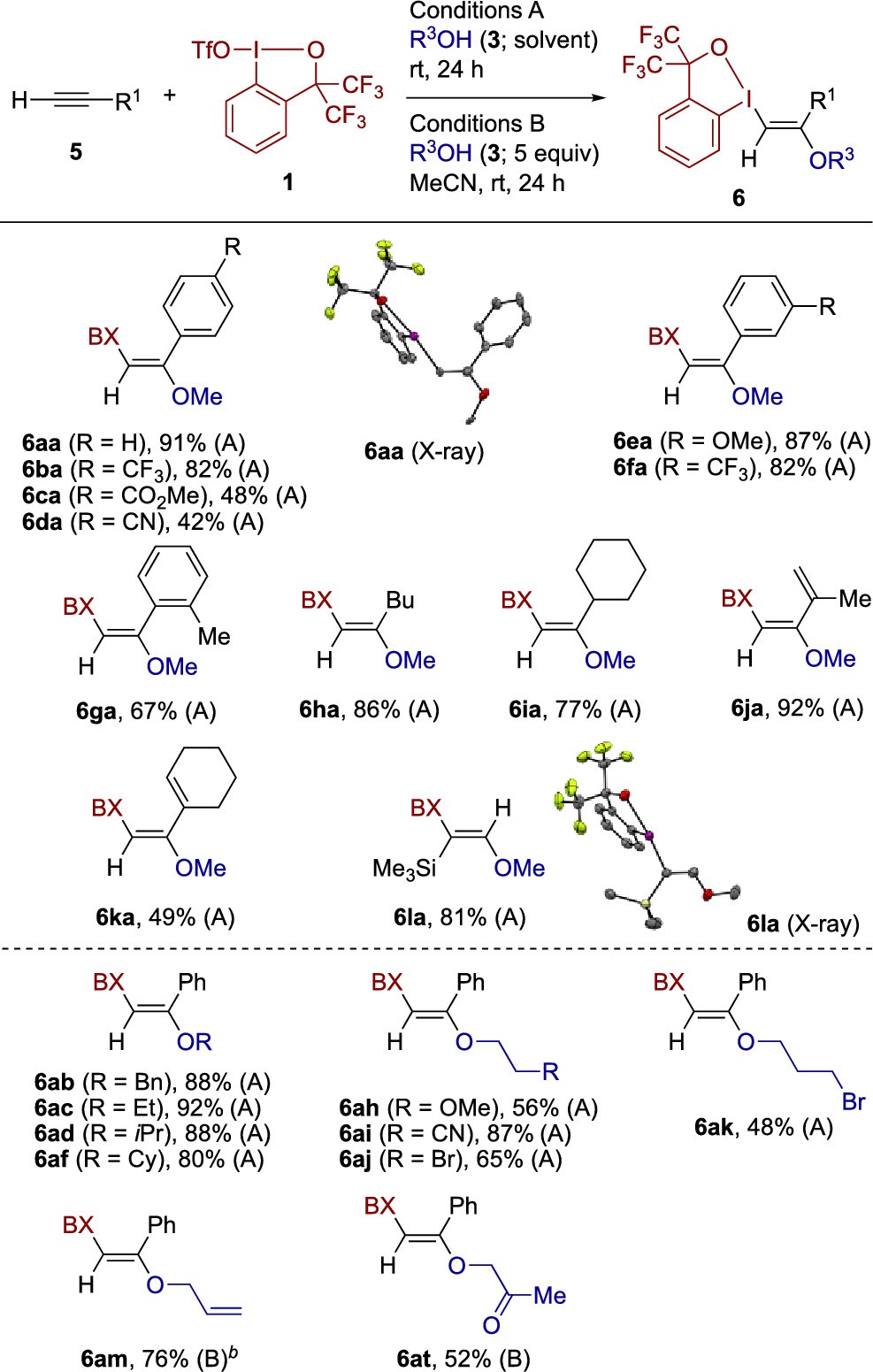
图2 模型反应测试
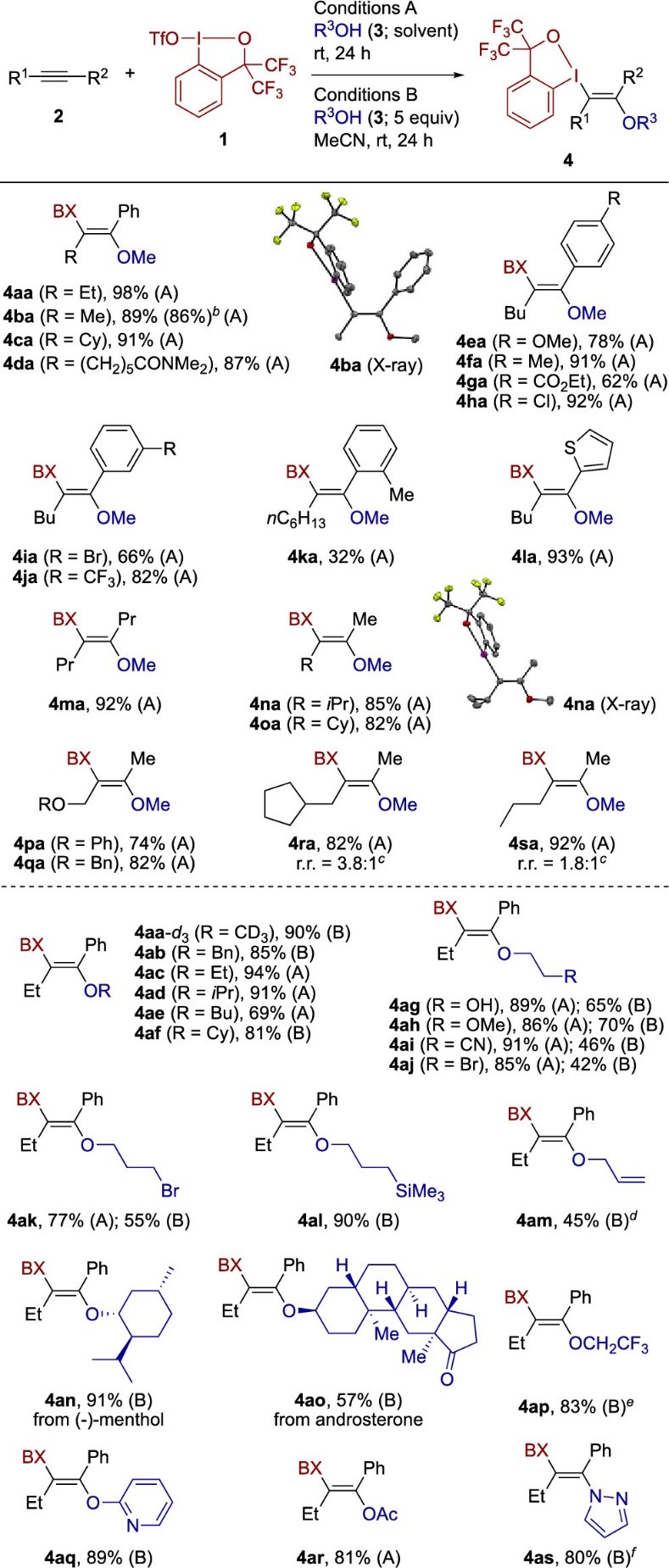
作者使用1-苯基-1-丁炔(2a,0.1 mmol)作为模型底物,在室温下使用2当量的MeOH(3a,0.5 mL)进行双官能化反应,以98%收率制得反式产物β-λ3-碘基乙烯基醚4aa(图2a)。可以通过常规硅胶色谱法纯化产物4aa,在暴露在空气中一个月的时间里仍十分稳定没有分解。其他醇也可以高效参与反应,使用5当量的苯甲醇(图2,3b)在MeCN中以87%的收率得到所需的产物4ab。最终筛选出A,B两种反应条件,分别是以醇作为当量试剂或者以醇为溶剂。对于这上述两种条件,使用1-1.2当量的化合物1都可以以合理的产率(68-78%)获得所需的产物。无机碱(如碳酸盐)的添加会产生轻微或较大的负面影响,而有机碱会完全抑制反应。化合物1不会吸潮,能够以十克级大量合成,并且能在室温下保存一个月以上,然而由2-碘苯甲酸衍生的类似试剂,它相当吸潮,不能参与目前碘醚化反应。
图3 内炔类底物适用性研究
得到最优的反应条件后,作者进一步探索了内炔的底物范围(图3)。各种各样的芳基烷基炔烃在MeOH溶剂中反应,以中等至极好的收率和单一的反式加成选择性,得到相应的β-λ3-碘代乙烯基醚。1-苯基-1丙炔的反应可以克级进行,而不影响收率(86%)。供电子基团,例如甲氧基(4ea)和甲基(4fa),以及吸电子基团,例如酯基(4ga),氯离子(4ha),溴离子(4ia)和三氟甲基(4ja),均可以很好兼容。
图4 醇类底物适用性研究
接下来,作者研究了不同醇底物适用性。2a与CD3OD底物的反应能以90%的产率得到产物4aa-d3。各种伯醇和仲醇均能参与反应,并以中等至良好的产率得到了相应的乙烯基醚。对于醇底物上的官能团,该反应可兼容例如羟基(4ag),甲氧基(4ah),氰基(4ai),溴(4aj,4ak),甲硅烷基(4al),烯丙基(4am)和羰基(4ao),而且在使用醇作为溶剂的条件A下,一些官能化的醇的产率反而更高。天然存在的醇,例如(-)薄荷醇和雄甾烷酮也适合目前的反应(4an,4ao)。该反应的底物范围还可以扩展到末端炔烃(图4)。BXT和MeOH能对各种芳基乙炔实现区域选择性和立体选择性的双官能团化反应,并以中等至高收率得到相应的乙烯基醚。
作者认为该反应涉及了下面步骤。三氟甲磺酸根从BXT上解离下来得到BX阳离子,BX阳离子对炔的亲电活化作用,然后发生反式Markovnikov加成。作者还进行DFT计算,计算结果支持该反应机理。利用19F NMR在MeOH中对4-三氟甲基苯乙炔底物的动力学研究表明反应速率与底物1b和5b的均呈现一级动力学关系,这证实了限速的反式碘代醚化加成步骤是反应的决速步骤。由于庞大的吸电子碘基对空间阻碍和电子诱导作用,乙烯基醚产物在强酸性HOTf的存在下仍稳定存在。
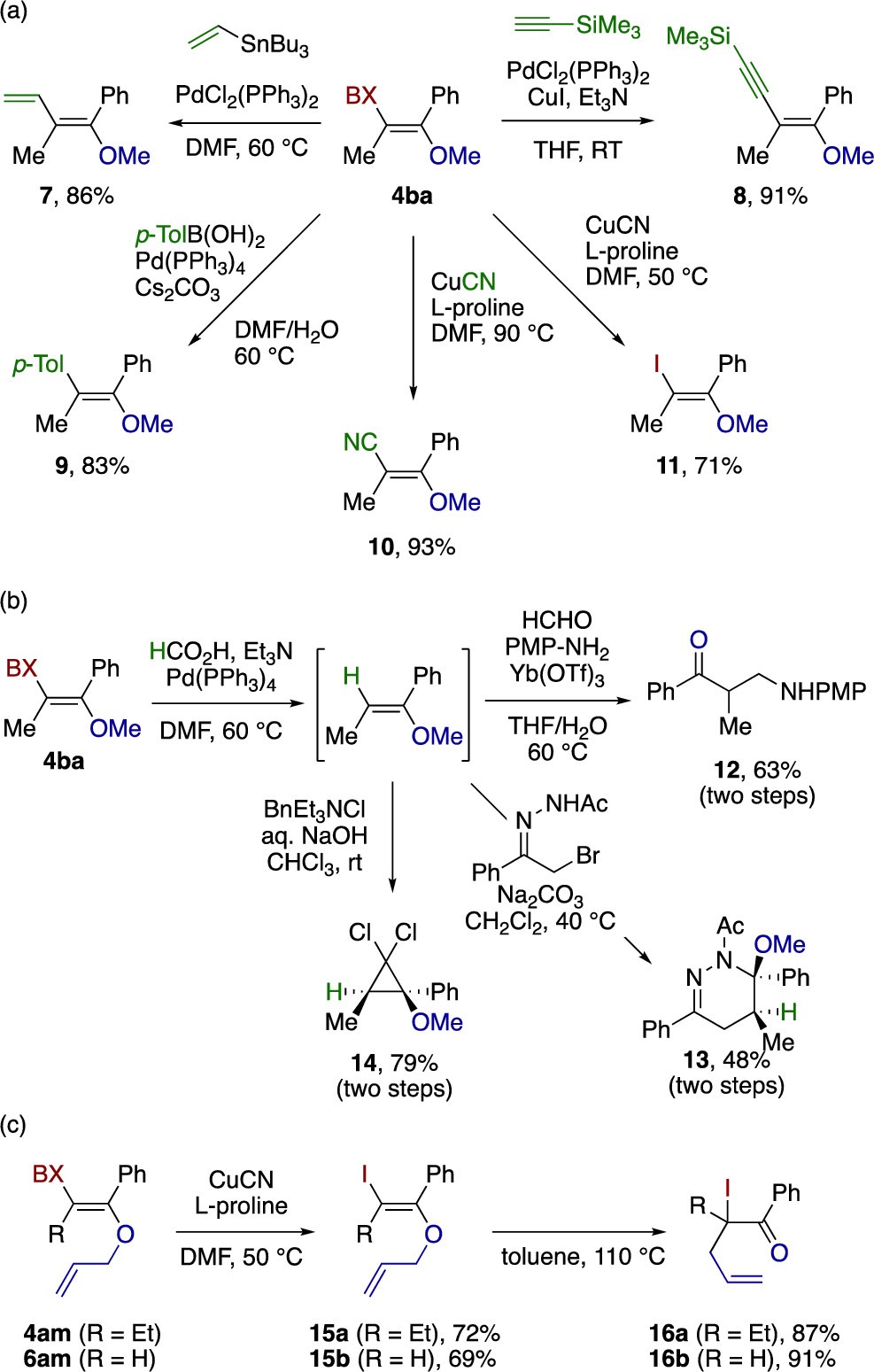
图5 产物的衍生化
通过本方法获得的乙烯基醚进一步转化为其他具有立体选择性高度取代的乙烯基醚。如图5a所示,产物4ba顺利地参与了Pd催化的Stille, Sonogashira, and Suzuki−Miyaura偶联反应得到共轭乙烯基醚7,8,9。此外,Rosnmund-von Braun氰化反应和苯并碘氧杂茂环的还原反应可以在不同温度下选择性地实现。作者分别在90℃和50℃以良好的产率获得了β-氰基和-碘基乙烯基醚10和11。4ba中BX部分的Pd催化加氢脱卤反应也很顺利实现,产物进一步参与了三氟甲磺酸镱催化的Mannich反应,Diels-Alder反应和环丙烷化反应(图5b)。此外4am和6am还能进行铜参与的还原反应和克莱森重排(图5c)。
结语
Yoshikai课题组已经开发了环状λ3-碘试剂和醇对炔烃的区域和立体选择性双官能化反应,该方法学可以作为通用的方法来合成多取代的乙烯基醚类化合物。该反应可以在简单温和的条件下进行,并能兼容各种内炔和端炔,以及广泛的醇类化合物。产物的苯并碘氧杂茂环部分可以后期参与各种转化,从而高效合成立体控制的多取代乙烯基醚。作者预期,通过这种方法可获得的以前难以想象的立体控制的乙烯基醚,这不仅会增加现有乙烯基醚合成方法的范围和实用性,还将促进其新的转化方法学的发展。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.