作者:苏打水
导读:
近日,加拿大Toronto大学S. O. Kelley研究组开发了一种无试剂化的、基于核酸适配体的分子“钟摆”型多功能电化学生物传感器。在电极上使用刚性双链DNA构建“倒置钟摆”分子模型,DNA的两条单链分别连接核酸适配体和氧化还原探针,目标分子的存在将干扰“钟摆”的摆动速度,最终通过计时安培法实现目标物的实时监测。
Monitoring Cardiac Biomarkers with Aptamer‐Based Molecular Pendulum Sensors.
Mahmud, D. Chang, J. Das, S. Gomis, F. Foroutan, J. B. Chen, L. Pandey, C. D. Flynn, H. Yousefi, A. Geraili, H. J. Ross, E. H. Sargent, S. O. Kelley,
Angew. Chem. Int. Ed. 2023, ASAP. doi: 10.1002/anie.202213567.
正文:
疾病的快速诊断和个性化治疗在临床医学中占据关键环节,传统的检测手段虽然能够准确给出检测结果,但分析过程十分复杂、费时、昂贵,且局限于实验室中。基于芯片构建的无试剂、手持式、可穿戴、可植入的电化学生物传感器给疾病检测提供了良好思路[1]。
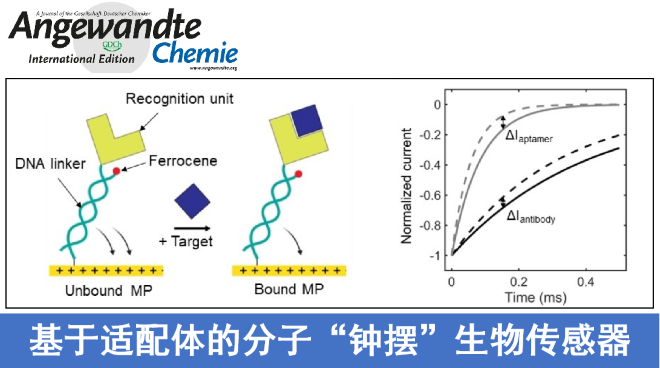
这里,Toronto大学S. O. Kelley研究组报道了一种新的基于适配体的电化学分析技术,构建“分子钟摆”(Molecular Pendulums,MPs)型电化学生物传感器(Figure 1,A-C),将带负电荷的刚性双链DNA锚定在一个硫醇化的金电极上[2],DNA的其中一条单链用于连接生物识别元件,如抗体或适配体;另一条链用于共轭氧化还原报告分子二茂铁。传感器的信号转导及输出是基于电场诱导目标分析物与带负电荷的DNA链间的静电结合,同时二茂铁在靠近电极表面时被氧化,此策略有效规避了传统传感器中Debye长度的限制[3],能够直接输出电化学响应信号。电极识别物质的时间快慢受目标分析物调制,在存在目标分析物的情况下,目标分析物与适配体识别元件特异性结合,增加传感器上的溶剂阻力,干扰MP的摆动速度,增长电极识别时间,从而根据计时安培法获得特征时间常数(τ)的变化实现目标分析物的精确定量[3-4]。
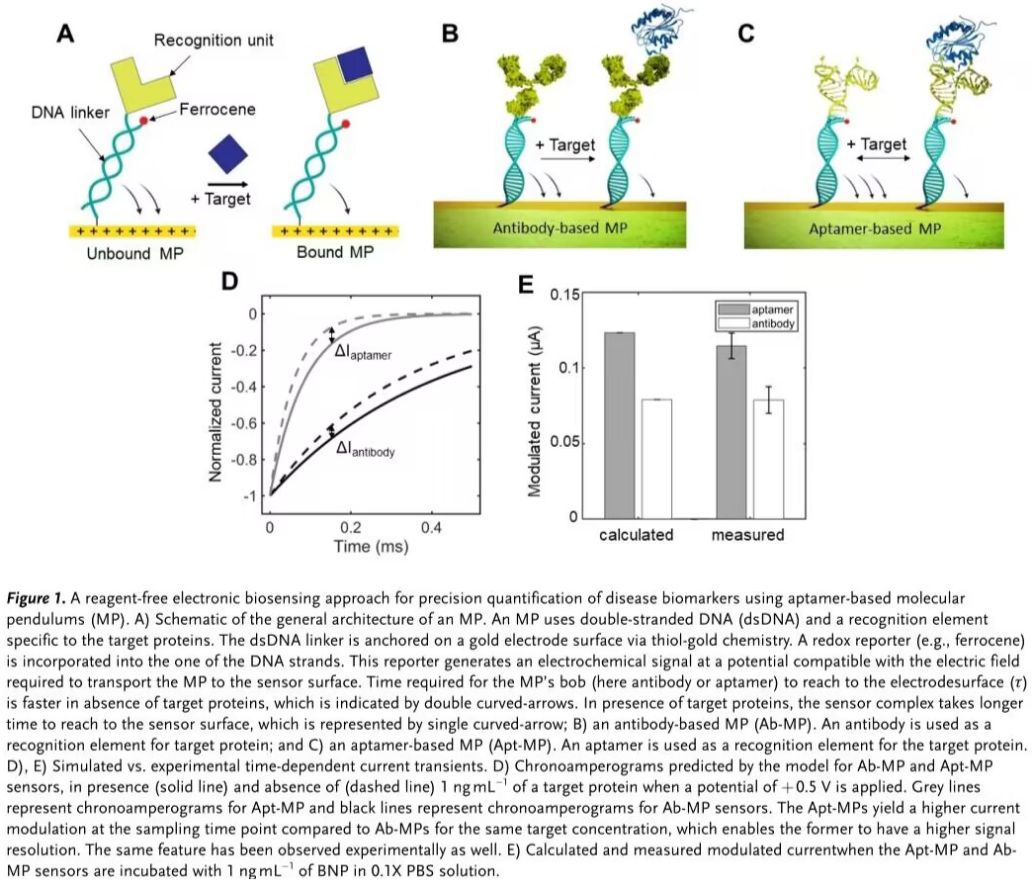
研究人员首先通过建模对比适配体-分子“钟摆”(Apt-MP)生物传感器与抗体-分子“钟摆”(Ab-MP)生物传感器的响应时间,Figure 1D显示的实时安培轨迹显示,在特定时间点上,Apt-MP生物传感器具有更强的信号分辨率和更高的归一化调制电流(ΔI)。同时Figure 1E显示的模型预测结果证明,当两个MP传感器与相同数量的目标蛋白孵育时,Apt-MP传感器产生了更高的ΔI。
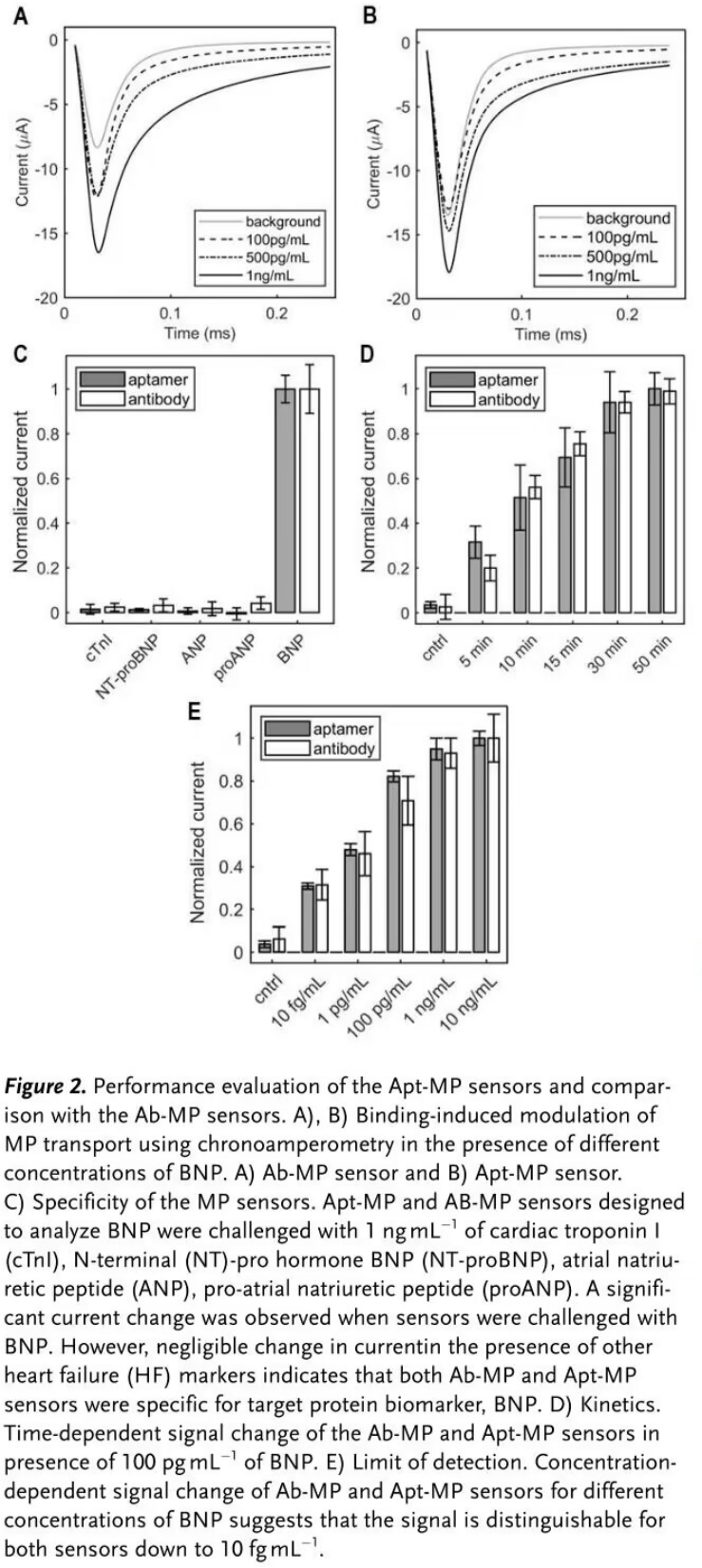
接着,分别构建了Apt-MP传感器与Ab-MP传感器来诊断心衰标志物B型利钠肽(BNP),以比较两种传感器的分析性能(Figure 2)。
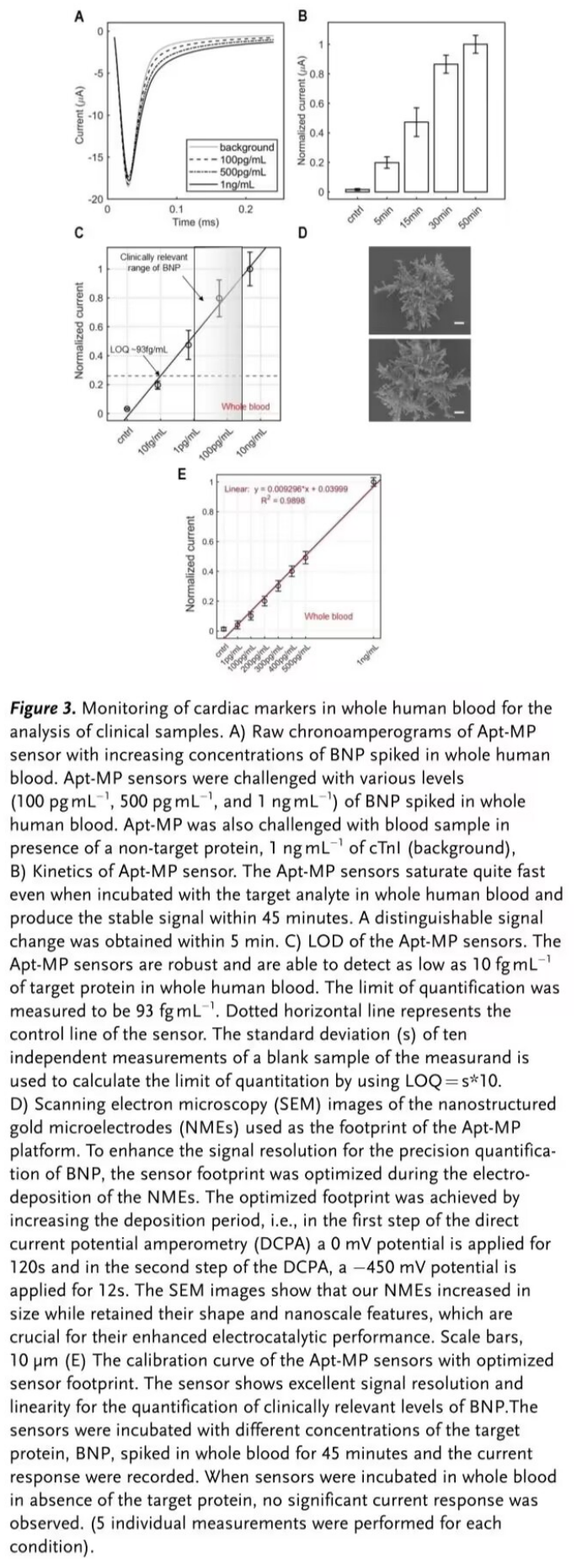
之后,通过向人全血中加标BNP进一步探究该传感器在人全血中的检测性能(Figure 3)。
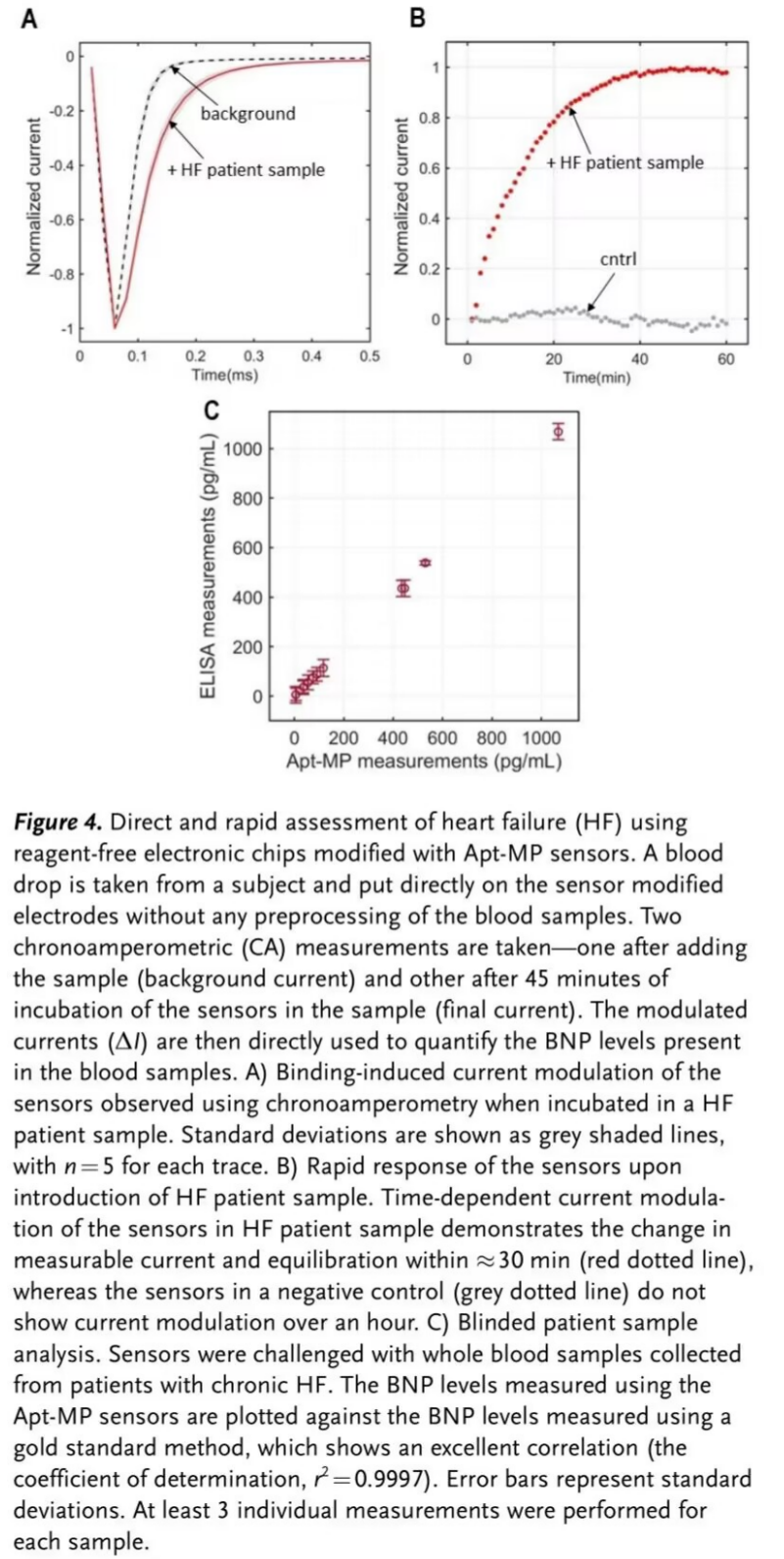
随后,对真实心衰患者血液样本中的BNP进行检测,并将检测结果与商业化ELISA试剂盒的检测结果进行对比。上述结果证明该传感器能够准确地评估患者的生理机能(Figure 4)。
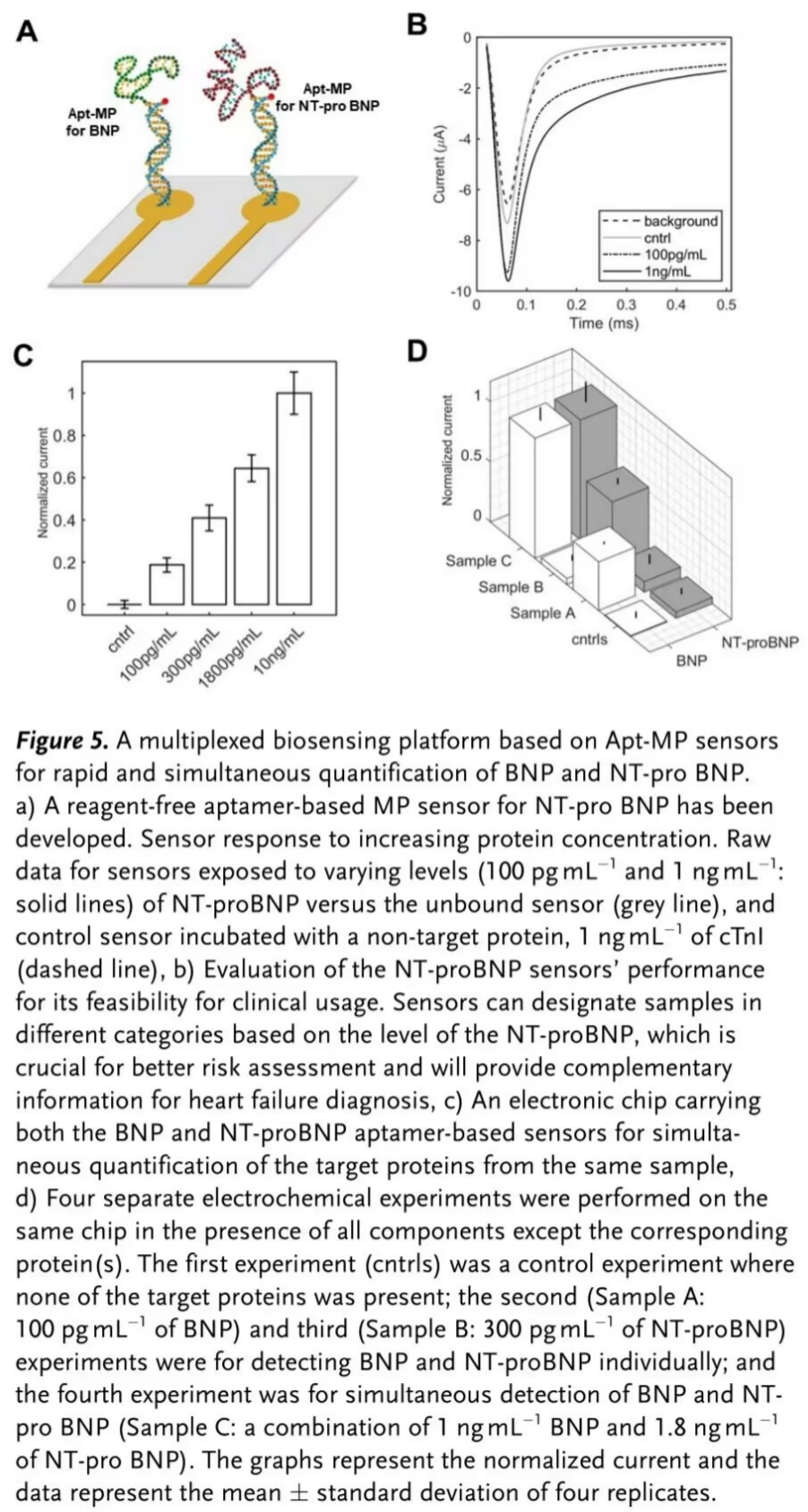
最后,通过将不同目标物识别的Apt-MPs锚定在同一电子芯片上的空间分离电极上,实现了Apt-MP传感器的多路复用[5](Figure 5)。
总结:
Toronto大学S. O. Kelley研究组开发了一种无试剂的电化学生物传感技术,用于自动精确定量全血样本中不同的蛋白质生物标记物。其提出的MP传感策略将一个活性场介导的传感器复合物施加于电极表面,使传感器能够准确地转导超过Debye长度的生物识别事件,保证其在复杂的生物样本中仍保持其高性能。鉴于适配体在生化分析中相对于抗体的显著优势,再结合适配体选择技术的快速发展,该传感平台为开发新兴的生物传感技术提供了一个潜在的有价值的工具[6]。
参考文献:
- [1] M. Kessel, Nat. Biotechnol. 2014, 32, 513. doi: 10.1038/nbt.2930.
- [2] J. C. Love, L. A. Estroff, J. K. Kriebel, R. G. Nuzzo, G. M. Whitesides, Chem. Rev. 2005, 105, 1103. doi: 10.1021/cr0300789.
- [3] J. Das, S. Gomis, J. B. Chen, H. Yousefi, S. Ahmed, A. Mahmud, W. Zhou, E. H. Sargent, S. O. Kelley, Nat. Chem. 2021, 13, 428. doi: 10.1038/s41557-021-00644-y. [4] H. Yousefi, A. Mahmud, D. Chang, J. Das, S. Gomis, J. B. Chen, H. Wang, T. Been, L. Yip, E. Coomes, Z. Li, S. Mubareka, A. McGeer, N. Christie, S. Gray-Owen, A. Cochrane, J. M. Rini, E. H. Sargent, S. O. Kelley, J. Am. Chem. Soc. 2021, 143, 1722. doi: 10.1021/jacs.0c10810.
- [5] W. Gao, S. Emaminejad, H. Y. Y. Nyein, S. Challa, K. Chen, A. Peck, H. M. Fahad, H. Ota, H. Shiraki, D. Kiriya, D.-H. Lien, G. A. Brooks, R. W. Davis, A. Javey, Nature 2016, 529, 509. 10. doi: 1038/nature16521.
- [6] S. Song, L. Wang, J. Li, C. Fan, J. Zhao, TrAC. Trends Anal. Chem. 2008, 27, 108. doi: 10.1016/j.trac.2007.12.004.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.