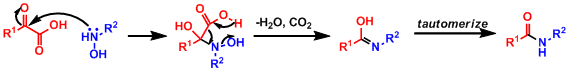- 概要
α-酮酸与羟基胺混合得到肽键(酰胺)的反应。
该反应能够在温和的条件下进行,而且对官能团的选择性比较高。同时,该反应的操作也很简便,副产物水与二氧化碳也很容易除去,是一个非常环保的反应。
该反应中的底物在与无保护的胺或者羧酸在共存的情况下也可以进行选择性的缩合反应,这也是该反应的一个特点。在肽键合成中经常会出现的α-差向异构化问题在该条件下是不容易发生的。
- 基本文献
・Bode, J. W.; Fox, R. M.; Baucom, K. D. Angew. Chem. Int. Ed. 2006, 45, 1248. doi:10.1002/anie.200503991
・Carrillo, N..; Davalos, E. A.; Russak, J. A.; Bode, J. W. J. Am. Chem. Soc. 2006, 128, 1452. DOI: 10.1021/ja057706j
- 反应机理
- 反应实例
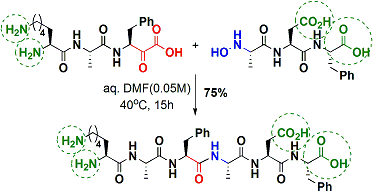
无保护的胺・羧酸共存下的肽键合成实例
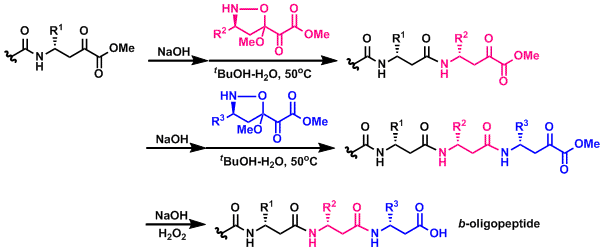
使用手性恶唑烷衍生物进行连续β-多肽合成
- 实验步骤
N-[(1S)-1-Phenylethyl]-benzeneacetamide的合成[1]
在氮气保护下,在装备有搅拌子的的500mL圆底烧瓶中加入苯丙酮酸(4.75g, 28.9mmol, 1.0 eq)的DMF溶液(289mL)。搅拌5分钟后,在室温下一次性加入N-hydroxy-(S)-1-phenylethylamine oxalate (9.20 g, 40.5 mmol, 1.4 eq)。反应溶液升温到40℃,持续搅拌直到反应结束。反应后的溶液旋转蒸发(50℃、10mmHg)浓缩到20mL,得到黄色母液后冷却到室温。然后用乙醚(200mL)稀释,并且加入1N盐酸水溶液(200mL)萃取。得到的有机层再用1N盐酸水溶液(200mL)萃取干净。把水层合并后,用乙醚(3×200mL)再次萃取。再把有机层合并,用饱和NaHCO3(200mL)萃取洗净。洗完后的水层再次用乙醚(2×200mL)逆萃取。把所有的有机层合并,用饱和食盐水(400mL)洗净后,用无水硫酸钠干燥。滤过后,有机层蒸发(40℃、20mmHg)浓缩,真空泵(2mmHg)干燥,得到黄色的粘稠性油状的粗产物。粗产物用硅胶柱(SiO2, 280 g)上样,用30%醋酸乙酯/正己烷的淋洗精制,得到白色固体状目标产物 (5.92-5.96 g, 収率85-86%)。
- 实验技巧
- 参考文献
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载