本文作者:石油醚
概要
Jennifer M. Schomaker, 出生于美国密歇根州,美国威斯康辛大学化学系教授,有机化学家。
课题组主页: https://schomaker.chem.wisc.edu/
经历
- 1990年-1994年 萨基诺谷州立大学获得学士学位
- 1994年-1998年 中央密歇根大学获得硕士学位 (Professor Thomas J. Delia)
- 2001年-2006年 密歇根州立大学获得博士学位 (Professor Babak Borhan)
- 2007年-2009年 加州大学伯克利分校NIH博士后研究助理
- (Professors Robert G. Bergman and F. Dean Toste)
- 2009年-至今 美国威斯康辛大学化学系教授
获奖经历
- Somojai Miller Visiting Professorship, UC-Berkeley 2019
- Vilas Faculty Mid-Career Award, UW-Madison 2018
- UW 2020 Award: All-Optical Electrophysiology-Electrophysiology without Electrodes.”
- Co-principal investigator 2018
- Kavli Fellow 2016
- French-American Chemical Society XVI invited speaker 2016
- Leo Paquette Legacy Symposium invited speaker, Ohio State University 2016
- Michigan State University Recent Alumni Award, College of Natural Science 2015
- American Chemical Society WCC Rising Star Award 2014
- Early Excellence profiled in the Journal of Physical Organic Chemistry 2013
- ACS Division of Organic Chemistry Early Academic Investigator Symposium 2013
- Michigan State University Distinguished Alumni Lecturer 2013
- Invited speaker for the inaugural Cal Meyers Memorial Organic Symposium 2013
- Invited speaker for Organic Chemistry Day, the University of Missouri at Columbia 2013
- NSF-CAREER Award 2013-2018
- Sloan Research Fellow 2013-2015
- Thieme Chemistry Journal Award 2010
- Ruth L. Kirschstein National Research Service Award Research Training Grant (NIH) 2007–2009
- American Chemical Society, Division of Organic Chemistry Graduate Fellowship 2004
- Dow Chemical Company Foundation Graduate Fellowship 2004
- Michigan State University Distinguished Graduate Fellowship 2001-2005
- Central Michigan University Outstanding Thesis and Dissertation Award 1998
- Dow AgroSciences Inventor Award 1997
- Central Michigan University Graduate Research Fellowship 1996
- DowElanco Inventor’s Award 1993-94, 1996
- Dow Chemical Michigan Division Research and Development Inventor Award 1993
- Dow Chemical Company Special Recognition Award, Agricultural Chemicals & Process 1992
研究方向
Schomaker小组学生的创造力和兴趣爱好驱使他们探索了各种不同的研究方向。这些研究领域包括方法学发展,具有生物活性的天然和非天然产物的全合成,药物化学,计算化学,碱金属和贵重金属催化剂的设计,对于调控化学选择性和对映选择性的C-H胺化反应的银催化剂的设计合成以及生物正交标记的新试剂。
1. 新的复杂胺化学反应的研究–氧化烯胺化反应
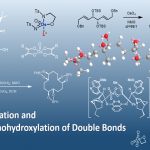
通过与核糖体结合而表现出生物活性的天然产物和药物通常含有复杂的胺基序,这些胺基序列通常嵌入相邻的含杂原子的立体中心阵列中。然而,用常规方法来构建密集功能化和立体化学丰富的胺基序合成还是具有很大的挑战性。(Fig.1)
Figure 1 天然产物中的胺基序列
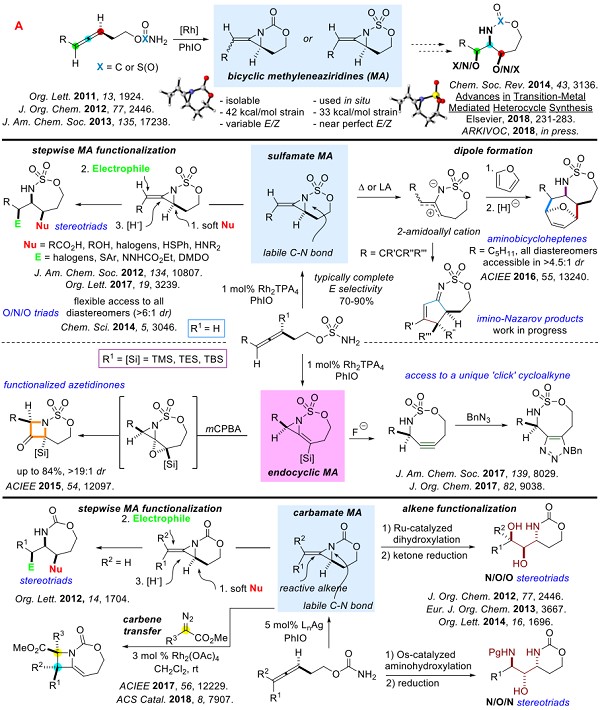
为了快速设计并提供新型含胺分子骨架新方法的需要,Schomaker小组利用联烯类化合物作为灵活方便的起始材料开发了含胺分子骨架合成的方法1-7。一个简单的化学,区域和立体选择性的分子氮杂环丙烷提供了关键的二环亚甲基氮丙啶中间体。这些中间体易于操作,可为新的胺化学区域中提供显着的多样性。下面的方案重点介绍了Schomaker小组从丙二烯前体获得的一些转化。(Fig.2)
Figure 2 含胺化合物的合成
2. 结合核糖体的分子的设计和合成5,7,8
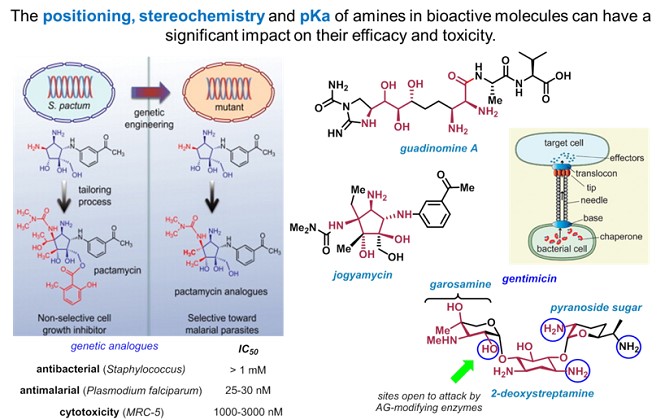
大多数与核糖体结合来抑制蛋白质合成的药物来自天然产物来源,包括四环素类、氨基糖苷类抗生素和大环内酯类抗生素。核糖体的复杂性和基于天然产物的分子中进行结构-活性关系研究的困难激发了人们对识别核糖体的兴趣:1)能够与核糖体结合,2)在人类核糖体上显示出结合病原体的选择性,(3)可以轻松地使用通用的合成方法进行操作,以进行结构-活性关系研究,从而深入了解如何将有用的功能引入新的分子骨架。研究表明,抗疟疾和抗肿瘤的氨基环戊醇天然产物 Pactamycin 的核心发生微小变化,可显著降低对哺乳动物细胞的毒性。Schomaker小组目前正在针对 Jogyamycin 的类似物来确定哪些结构特征有助于毒性,以便调整人类核糖体与病原体结合的选择性。此外,还正在致力于 Jogyamycin 的第一次全合成,该合成利用关键的串联 Ichikawa/[3.3]-sigmatropic重排策略来安装两个邻氨基的立体中心。(Fig.3)
Figure 3 结合核糖体的分子
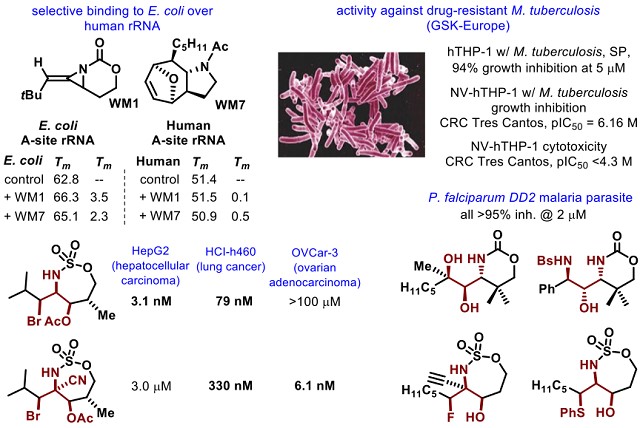
对Schomaker小组新的胺化合物库的一小部分的协作研究发现,这些化合物显示出与人rRNA选择性结合至大肠杆菌A位点 rRNA 的特性,激发了与UW药物化学中心和其他合作者进一步开展SAR和ADMET/PK研究的兴趣。通过对抗癌、抗结核和抗疟活性的有希望的结果进一步研究,以确定与核糖体的结合是否是主要的作用机制。(Fig.4)
Schomaker小组对研究阿霉素(DOX)的类似物产生了极大的兴趣。阿霉素是一种有效的抗肿瘤药物,显示出显着的心脏毒性和其他副作用。 有人提出将合理设计的双环氨基糖引入糖苷配基中,以提高结合特异性并降低蒽环类抗生素对此类化合物中的毒性。 除了上述工作外,Schomaker小组继续寻找具有立体化学复杂以及有趣的分子结构的分子,这些分子结构可能通过与核糖体结合而显示出生物活性的选择性。
Figure 4 胺化合物库活性研究
3. 高度取代碳环的非对映体和对映体选择性合成方法2,7,9
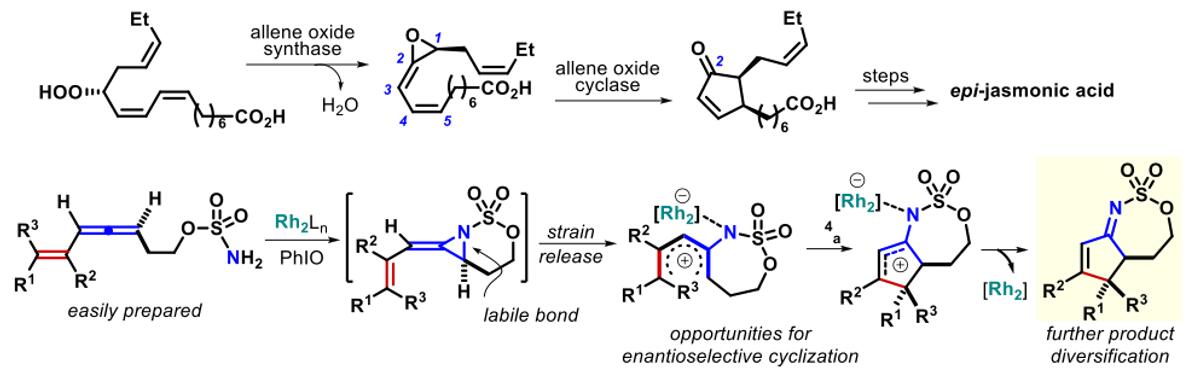
除了在氧化丙二烯胺化方面的工作外,Schomaker教授使用丙二烯为C3合成子来制备高度取代的碳环化合物。目前正在研究的项目受到具有潜在神经保护活性的分子的启发(包括双叶内酯和天然产物的环烷二萜家族成员),例如,受丙二烯环化氧化酶将亚甲基环氧化物环化为环戊烯酮的生物合成途径的启发,开发了一种将共轭亚烯转化为α,β-不饱和环戊烯胺的方法。未来的方向包括促进对映体选择性的“imino-Nazarov”反应的研究以及该方法在药物和天然产品中的应用。(Fig.5)
Figure 5 高取代碳环的合成
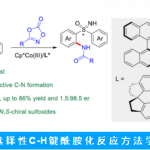
4. 催化剂控制的C-H官能团化3,10-17
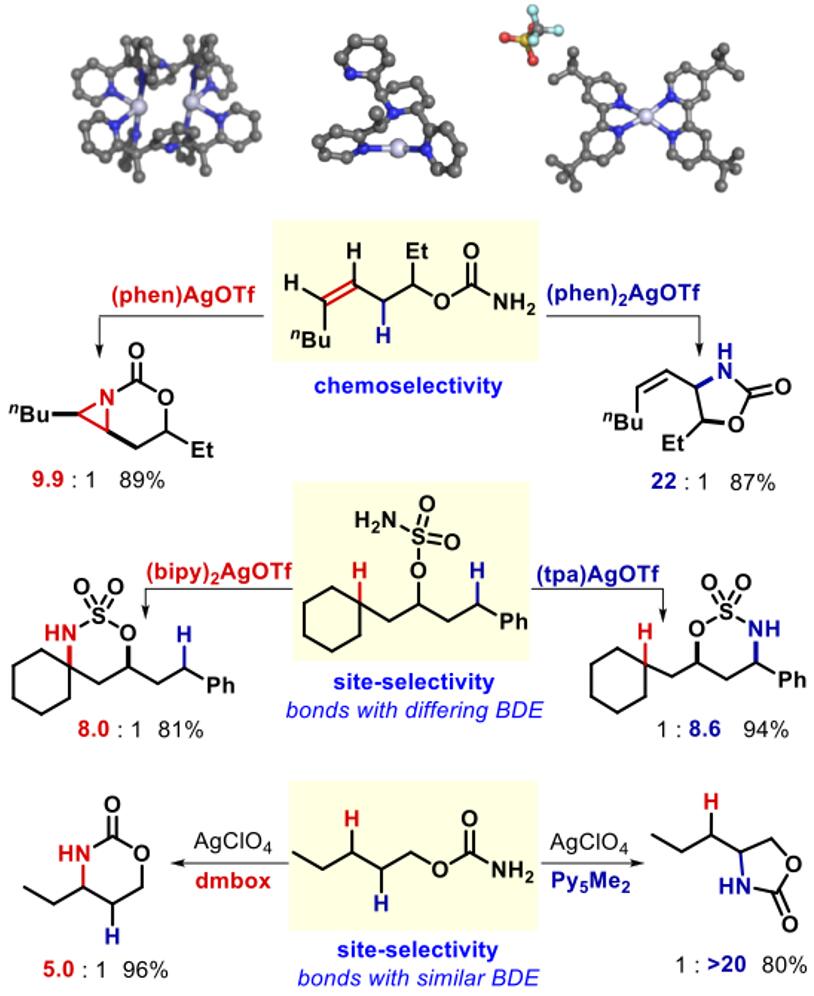
C-H键普遍存在于有机化合物中,虽然在利用底物控制实现C-H官能团化反应的选择性方面取得了重大进展。但除了酶的进化之外,可预测和可调控的催化剂或试剂控制的C-H 酰胺化反应是罕见的。设计用于在多个不同反应活性C-H键 存在的条件下对某一个C-H键官能团化为目标的催化剂,为实现复杂分子的合成提供了新的策略以及为C-H键活化开拓了新的领域。,Schomaker小组一直致力于银催化氮宾转移反应的实验和计算研究来应对这一领域的长期挑战,其中Ag(I)配合物中的配位几何结构的多样性使得C-H键向新的C-N键转化时具有独特的、可调控的化学、区域和立体选择性。到目前为止,已经设计并成功证明银催化剂能够实现以下能力:1)对化学选择性氮宾转移的可控性调节,以促进氮杂环丙烷化或C-H键的插入;2)可调控位点选择性的C-H键胺化;3)对映选择性分子内氮杂环丙烷化反应。目前正在进行的项目着重于扩展可调控的,定点选择性的分子间氮宾转移的反应的研究,设计用于氮宾转移的新型不对称催化剂,对复杂分子进行后期酰胺化以及将课题组的设计概念扩展至其他金属以转化X-H和C-H键到新的X-C和C-X键。(Fig.6)
Figure 6 Ag(I)催化C-H官能团化
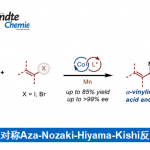
5. CuI催化的卤素迁移18-20
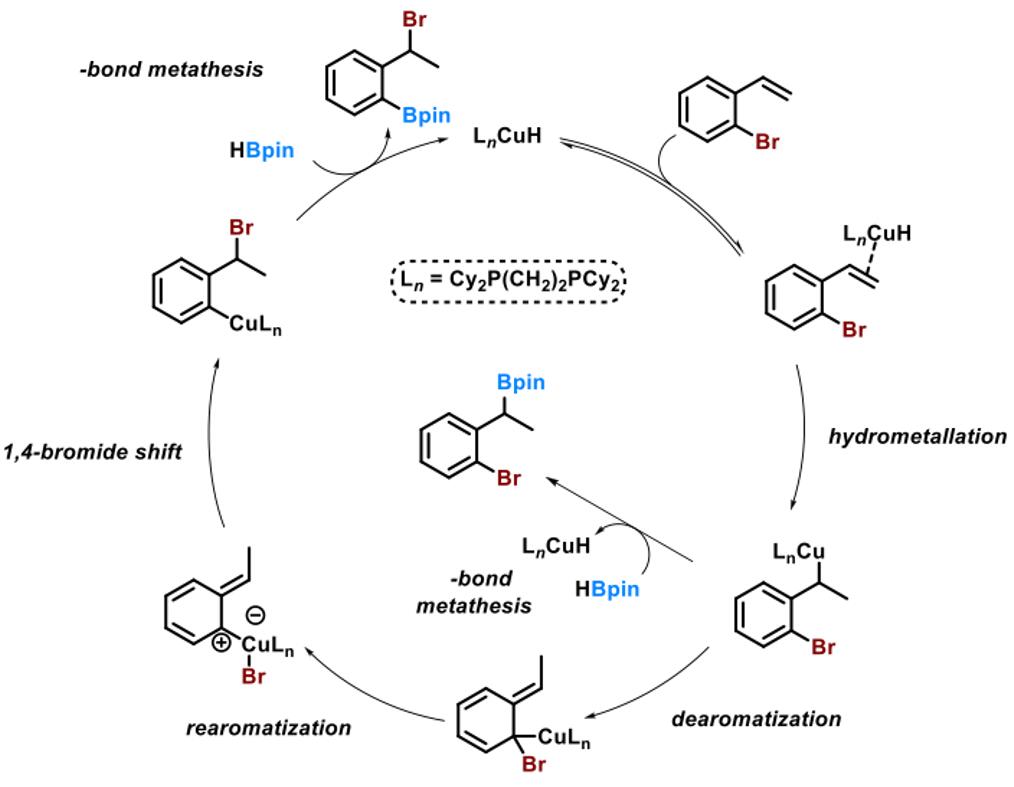
2012年,Schomaker小组报道一种不寻常的铜催化1,3–卤素迁移反应和机理研究。通过计算化学发现是经过Cu(I)-芳基物种进行的。(Fig.7)
Figure 7 铜催化1,3–卤素迁移反应机理
当前的工作重点是利用关键的Cu(I)-芳基物种进行其他转化,如添加其他偶联试剂和金属交换/交叉偶联反应中。例如,当苯乙烯衍生物的加氢和硼化反应被其他人探索时,Schomakr教授认为这种网状交叉亲电偶合是一种允许卤素保留并通过铜催化进行的偶联的反应。(Fig.8)
Figure 8 Cu(I)-芳基物种的转化应用
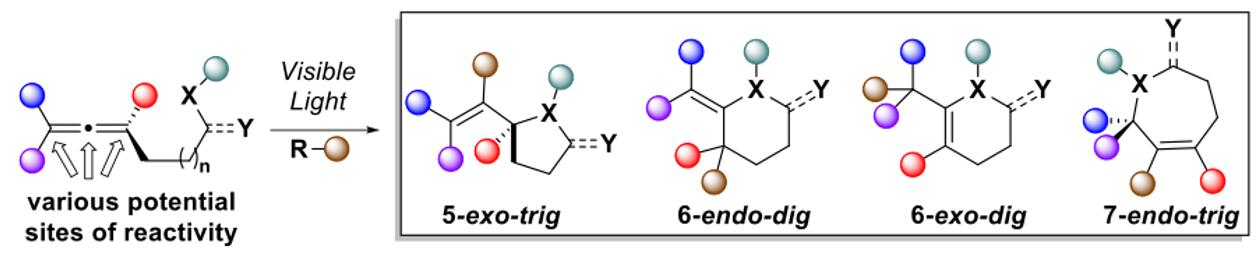
6. 氮杂环丙烷叶立德合成N–杂环的策略6,21-23
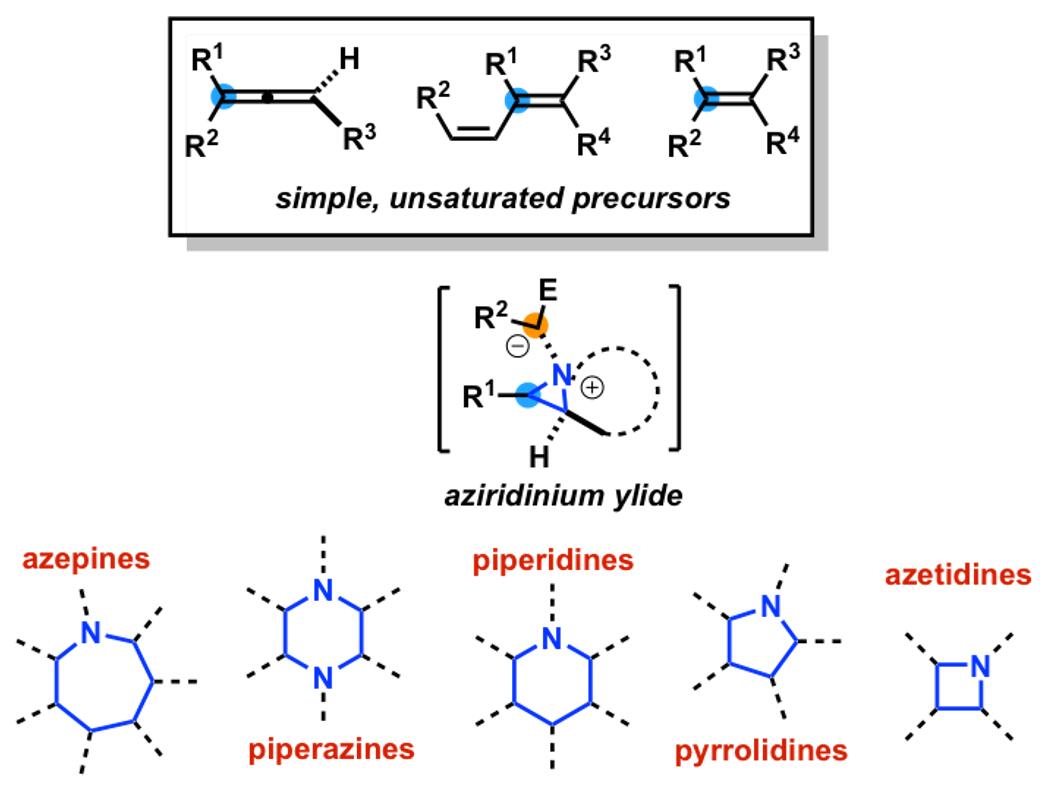
尽管N–杂环合成的合成方法很广泛,但从简单的前体合成立体化学复杂的4-7元环的通用方法却很少见。为了满足上面的需求,Schomaker小组正在探索使用简单易得前体氮杂环丙烷叶立德为中介进行串级氮宾/卡宾转移反应来对N–杂环合成。该方法吸引人的地方主要在于简单的前体,利用之前不可接近的化学键的断开的能力,氮宾卡宾转移催化剂可用性,复杂分子的快速组装,温和的反应条件以及在不对称领域强大的潜力。(Fig. 9)
Figure 9 N–杂环的合成
7. 新型可调式生物标记试剂24,25
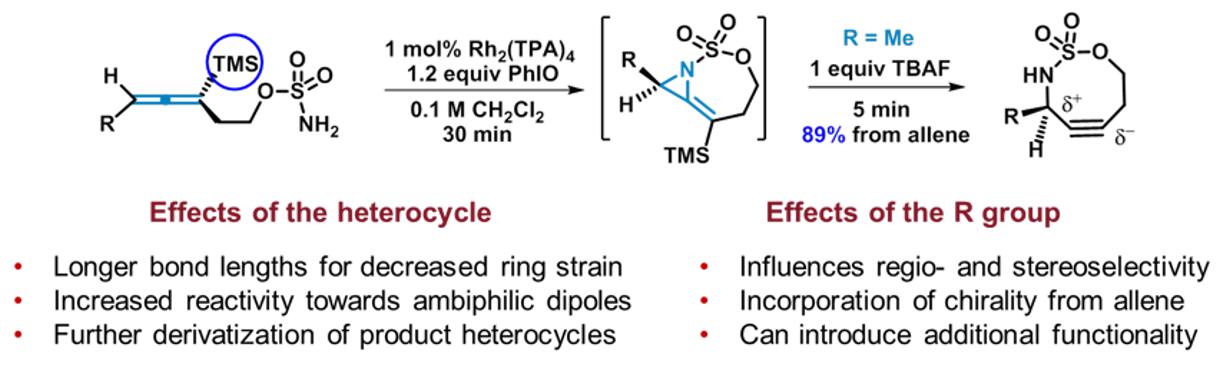
Schomaker小组已经报道了杂环环辛基(SNO-OCTs)与其他用于双正交标记的环炔相比,具有不同寻常的性质。(Fig.10)
Figure 10 新型可调式生物标记试剂的合成
目前,Schomaker教授与Raines小组合作,准备了第二代SNO-OCT,并正在研究其在活细胞中相互排斥的生物正交标记的实用性。 未来将探索设计师SNO-OCT在制备药物-抗体结合物中的潜力,以及通过将SNO-OCT掺入生物构件(例如蛋白质,DNA和RNA)中作为体内研究的探针,来应用这种性质独特骨架分子。(Fig.11)
Figure 11 SNO-OCT试剂的应用
8. 联烯中添加自由基26
与向烯烃中添加自由基相比,联烯类化合物中添加自由基及其类似物研究确很少。Schomaker教授目前正在研究向联烯类化合物中添加各种已经被报道的自由基源,目的是实现反应可调控性和选择性的策略,以使人们能够立即获得高度功能化的合成砌块(Fig. 12)。
Figure 12 联烯中添加自由基
其他
Chem-station还对Schomaker教授的工作做过介绍(动态的”化学选择性催化胺基化)
以上图片均来自Schomaker教授课题组主页
参考文献
- [1] Boralsky, L. A., Marston, D., Grigg, R. D., Hershberger, J. C. & Schomaker, J. M. Allene Functionalization via Bicyclic Methylene Aziridines. Org. Lett. (2011) 13, 1924-1927, doi:10.1021/ol2002418.
- [2] Adams, C. S., Boralsky, L. A., Guzei, I. A. & Schomaker, J. M. Modular Functionalization of Allenes to Aminated Stereotriads. J. Am. Chem. Soc. (2012) 134, 10807-10810, doi:10.1021/ja304859w.
- [3] Rigoli, J. W., Weatherly, C. D., Alderson, J. M., Vo, B. T. & Schomaker, J. M. Tunable, Chemoselective Amination via Silver Catalysis. J. Am. Chem. Soc. (2013) 135, 17238-17241, doi:10.1021/ja406654y.
- [4] Adams, C. S., Weatherly, C. D., Burke, E. G. & Schomaker, J. M. The conversion of allenes to strained three-membered heterocycles. Chem. Soc. Rev. (2014) 43, 3136-3163, doi:10.1039/C3CS60416K.
- [5] Adams, C. S., Grigg, R. D. & Schomaker, J. M. Complete stereodivergence in the synthesis of 2-amino-1,3-diols from allenes. Chem. Sci. (2014) 5, 3046-3056, doi:10.1039/C4SC01214C.
- [6] Burke, E. G. & Schomaker, J. M. Oxidative Allene Amination for the Synthesis of Azetidin-3-ones. Angew. Chem. Int. Ed. (2015) 54, 12097-12101, doi:10.1002/anie.201504723.
- [7] Gerstner, N. C., Adams, C. S., Tretbar, M. & Schomaker, J. M. Stereocontrolled Syntheses of Seven-Membered Carbocycles by Tandem Allene Aziridination/[4+3] Reaction. Angew. Chem. Int. Ed. (2016) 55, 13240-13243, doi:10.1002/anie.201606195.
- [8] Gerstner, N. C. et al. Diastereoselective Synthesis of the Aminocyclitol Core of Jogyamycin via an Allene Aziridination Strategy. Org. Lett. (2016) 18, 284-287, doi:10.1021/acs.orglett.5b03453.
- [9] Corbin, J. R., Ketelboeter, D. R., Fernández, I. & Schomaker, J. M. Biomimetic 2-Imino-Nazarov Cyclizations via Eneallene Aziridination. J. Am. Chem. Soc. (2020) 142, 5568-5573, doi:10.1021/jacs.0c02441.
- [10] Rigoli, J. W. et al. Chemoselective Allene Aziridination via Ag(I) Catalysis. Org. Lett. (2013) 15, 290-293, doi:10.1021/ol303167n.
- [11] Alderson, J. M., Phelps, A. M., Scamp, R. J., Dolan, N. S. & Schomaker, J. M. Ligand-Controlled, Tunable Silver-Catalyzed C–H Amination. J. Am. Chem. Soc. (2014) 136, 16720-16723, doi:10.1021/ja5094309.
- [12] Scamp, R. J., Jirak, J. G., Dolan, N. S., Guzei, I. A. & Schomaker, J. M. A General Catalyst for Site-Selective C(sp3)–H Bond Amination of Activated Secondary over Tertiary Alkyl C(sp3)–H Bonds. Org. Lett. (2016) 18, 3014-3017, doi:10.1021/acs.orglett.6b01392.
- [13] Dolan, N. S., Scamp, R. J., Yang, T., Berry, J. F. & Schomaker, J. M. Catalyst-Controlled and Tunable, Chemoselective Silver-Catalyzed Intermolecular Nitrene Transfer: Experimental and Computational Studies. J. Am. Chem. Soc. (2016) 138, 14658-14667, doi:10.1021/jacs.6b07981.
- [14] Corbin, J. R. & Schomaker, J. M. Tunable differentiation of tertiary C–H bonds in intramolecular transition metal-catalyzed nitrene transfer reactions. Chem. Commun. (2017) 53, 4346-4349, doi:10.1039/C7CC01235G.
- [15] Alderson, J. M., Corbin, J. R. & Schomaker, J. M. Tunable, Chemo- and Site-Selective Nitrene Transfer Reactions through the Rational Design of Silver(I) Catalysts. Acc. Chem. Res. (2017) 50, 2147-2158, doi:10.1021/acs.accounts.7b00178.
- [16] Huang, M., Yang, T., Paretsky, J. D., Berry, J. F. & Schomaker, J. M. Inverting Steric Effects: Using “Attractive” Noncovalent Interactions To Direct Silver-Catalyzed Nitrene Transfer. J. Am. Chem. Soc. (2017) 139, 17376-17386, doi:10.1021/jacs.7b07619.
- [17] Ju, M. et al. Tunable catalyst-controlled syntheses of β- and γ-amino alcohols enabled by silver-catalysed nitrene transfer. Nat. Catal. (2019) 2, 899-908, doi:10.1038/s41929-019-0339-y.
- [18] Grigg, R. D., Van Hoveln, R. & Schomaker, J. M. Copper-Catalyzed Recycling of Halogen Activating Groups via 1,3-Halogen Migration. J. Am. Chem. Soc. (2012) 134, 16131-16134, doi:10.1021/ja306446m.
- [19] Van Hoveln, R. J., Schmid, S. C., Tretbar, M., Buttke, C. T. & Schomaker, J. M. Formal asymmetric hydrobromination of styrenes via copper-catalyzed 1,3-halogen migration. Chem. Sci. (2014) 5, 4763-4767, doi:10.1039/C4SC02040E.
- [20] Van Hoveln, R. et al. Mechanistic Studies of Copper(I)-Catalyzed 1,3-Halogen Migration. J. Am. Chem. Soc. (2015) 137, 5346-5354, doi:10.1021/ja511236d.
- [21] Schmid, S. C., Guzei, I. A. & Schomaker, J. M. A Stereoselective [3+1] Ring Expansion for the Synthesis of Highly Substituted Methylene Azetidines. Angew. Chem. Int. Ed. (2017) 56, 12229-12233, doi:10.1002/anie.201705202.
- [22] Schmid, S. C., Guzei, I. A., Fernández, I. & Schomaker, J. M. Ring Expansion of Bicyclic Methyleneaziridines via Concerted, Near-Barrierless [2,3]-Stevens Rearrangements of Aziridinium Ylides. ACS. Catal. (2018) 8, 7907-7914, doi:10.1021/acscatal.8b02206.
- [23] Eshon, J. et al. Intermolecular [3+3] ring expansion of aziridines to dehydropiperi-dines through the intermediacy of aziridinium ylides. Nat. Commun. (2020) 11, 1273, doi:10.1038/s41467-020-15134-x.
- [24] Burke, E. G., Gold, B., Hoang, T. T., Raines, R. T. & Schomaker, J. M. Fine-Tuning Strain and Electronic Activation of Strain-Promoted 1,3-Dipolar Cycloadditions with Endocyclic Sulfamates in SNO-OCTs. J. Am. Chem. Soc. (2017) 139, 8029-8037, doi:10.1021/jacs.7b03943.
- [25] Burke, E. G. & Schomaker, J. M. Synthetic Applications of Flexible SNO-OCT Strained Alkynes and Their Use in Postpolymerization Modifications. J. Org. Chem. (2017) 82, 9038-9046, doi:10.1021/acs.joc.7b01506.
- [26] Liu, L., Ward, R. M. & Schomaker, J. M. Mechanistic Aspects and Synthetic Applications of Radical Additions to Allenes. Chem. Rev. (2019) 119, 12422-12490, doi:10.1021/acs.chemrev.9b00312.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



























No comments yet.