作者:石油醚
导读:
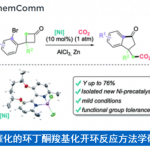
近日,美国斯克利普斯研究所的Phil S. Baran教授团队在J. Am. Chem. Soc.上,以 “Convergent Total Synthesis of (−)-Cyclopamine” 为题,报道了生物碱环巴胺(Cyclopamine)天然产物的全合成路线。其中,关键步骤主要涉及卤代环化过程 (halocyclization process);Tsuji-Trost环化 (Tsuji–Trost cyclization); 后期环闭合复分解(RCM)反应 (late-stage ring-closing metathesis (RCM) reaction)。
“Convergent Total Synthesis of (−)-Cyclopamine.
Manolis Sofiadis, Dongmin Xu, Anthony J. Rodriguez, Benedikt Nissl, Sebastian Clementson, Nadia Nasser Petersen, and Phil S. Baran*
J. Am. Chem. Soc., 2023, ASAP. doi: 10.1021/jacs.3c09085.”
正文:
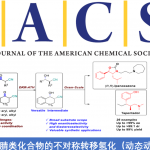
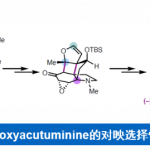
环巴胺(Cyclopamine)(1)是由美国化学家Richard F. Keller及其同事于1968年从美国加利福尼亚的百合科植物中北美山藜芦(Veratrum californicum)中分离获得的一种具有特殊化学结构和显著生物活性的异甾体类生物碱 (Figure 1A)[1],并且其作为一种潜在的抗肿瘤新药在世界范围内掀起了研究热潮[2]。目前,仅有Giannis等人报道了环巴胺的半合成[3],而其他科学家对其类似物Jervine(2)的合成报道较多。近日,Phil S. Baran教授团队报道了生物碱环巴胺(Cyclopamine)(16步最长线性路线)天然产物的全合成路线。并发表于J. Am. Chem. Soc.上。
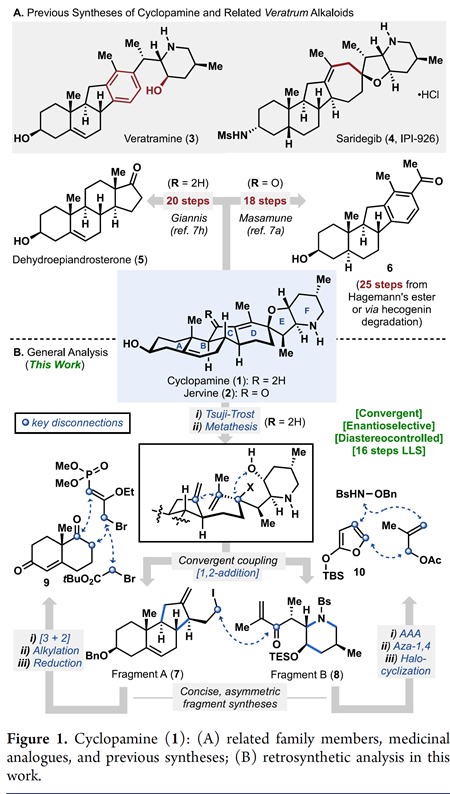
首先,环巴胺(Cyclopamine)(1)具有特殊的骨架(Figure 1B),即C-nor-D-homo甾体骨架、完全取代的螺环四氢呋喃骨架、独特的Trans-6,5-EF环系统和中心四取代烯烃。基于其特殊的骨架,作者对环巴胺(Cyclopamine)(1)进行了相关的逆合成分析(Figure 1D),即砌块(7)可由(S)-Wieland–Miescher ketone (9)经[3+2]环加成烷基化和还原三步完成,而砌块(8)则由2-siloxyfuran (10)经、不对称烯丙基烷基化、aza-Michael加成和halocyclization三步完成。ABC三环砌块(7)和砌块(8)通过非对映选择性1,2-加成获得关键的中间体。最后关键的中间体通过后期的Tsuji–Trost环化构建螺环四氢呋喃环和闭环复分解(RCM)反应构建中心四取代烯烃,即可完成环巴胺(Cyclopamine)(1)的全合成。
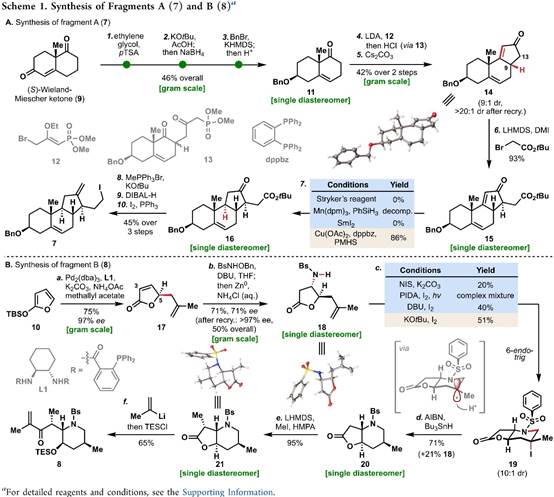

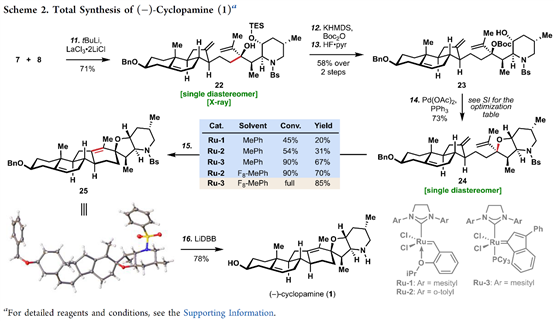

总结,Phil S. Baran教授团队在J. Am. Chem. Soc.上,以 “Convergent Total Synthesis of (−)-Cyclopamine” 为题,通过16步线性最长步骤完成了生物碱环巴胺(Cyclopamine)的全合成。其中,关键步骤主要涉及卤代环化过程 (Halocyclization process);Tsuji-Trost环化 (Tsuji–Trost cyclization); 后期环闭合复分解(RCM)反应 (Late-stage ring-closing metathesis (RCM) reaction)。
参考文献:
- [1] R. F. Keller, Phytochemistry 1968, 7, 303. doi:10.1016/S0031-9422(00)86328-1.
- [2] M. R. Tremblay, A. Lescarbeau, M. J. Grogan, E. Tan, G. Lin, B. C. Austad, L.-C. Yu, M. L. Behnke, S. J. Nair, M. Hagel, K. White, J. Conley, J. D. Manna, T. M. Alvarez-Diez, J. Hoyt, C. N. Woodward, J. R. Sydor, M. Pink, J. MacDougall, M. J. Campbell, J. Cushing, J. Ferguson, M. S. Curtis, K. McGovern, M. A. Read, V. J. Palombella, J. Adams, A. C. Castro, J. Med. Chem. 2009, 52, 4400. doi:10.1021/jm900305z.
- [3] A. Giannis, P. Heretsch, V. Sarli, A. Stößel, Angew. Chem. Int. Ed. 2009, 48, 7911. doi:10.1002/anie.200902520.
- [4] B. A. Baker, Ž. V. Bošković, B. H. Lipshutz, Org. Lett. 2008, 10, 289. doi:10.1021/ol702689v.
- [5] F. Richard, S. Aubert, T. Katsina, L. Reinalda, D. Palomas, R. Crespo-Otero, J. Huang, D. C. Leitch, C. Mateos, S. Arseniyadis, Nat. Synth 2022, 1, 641. doi:10.1038/s44160-022-00109-1.
- [6] A. Krasovskiy, F. Kopp, P. Knochel, Angew. Chem. Int. Ed. 2006, 45, 497. doi:10.1002/anie.200502485.
- [7] A. He, N. Sutivisedsak, C. D. Spilling, Org. Lett. 2009, 11, 3124. doi:10.1021/ol900980s.
- [8] Y. Wang, T. Nagai, I. Watanabe, K. Hagiwara, M. Inoue, J. Am. Chem. Soc. 2021, 143, 21037. doi:10.1021/jacs.1c11038.
- [9] R. R. Hill, S. D. Rychnovsky, J. Org. Chem. 2016, 81, 10707. doi:10.1021/acs.joc.6b01748.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.



















No comments yet.