本文作者:漂泊
汞是唯一的液态金属元素,它具有很好的导热性,因此常用作温度计,但是由于其良好的挥发性,汞也具有一定的毒性,使用时必须多加小心。人体摄入汞过多可能会导致水俣病。此外,我们生活中常见的日光灯也含有汞,汞灯是一种非常重要的紫外光源。雷汞则是一种重要的起爆药。
汞的基本物理性质
| 分类 | 第ⅡB族▪金属 |
| 原子序号・原子量 | 80 (200.59) |
| 电子配置 | 5d106s2 |
| 密度 | 13.595 g/cm3 |
| 熔点 | -39 oC |
| 沸点 | 356.7 oC |
| 色・形状 | 银白色液态金属 |
| 丰度 | 0.08ppm(地壳) |
| 发现者 | 古人 |
| 主要的同位素 | 196Hg, 198Hg, 199Hg, 200Hg, 201Hg, 202Hg, 204Hg |
| 用途例 | 温度计、汞灯、雷管 |
| 前后的元素 | 金-汞-铊 |
汞的发现
汞在很早的时候就进入了人类的视野。在古代,朱砂是一种非常常见的颜料,我国殷墟出土的甲骨文上涂有朱砂,欧洲人也将此明亮的红色颜料用来装饰洞穴,它具有鲜红的色泽。道士们也常用朱砂炼丹,因此朱砂又名丹砂、赤砂。朱砂就是天然的硫化汞(HgS)。它在空气中煅烧可以得到液态的汞,因为形似液态的银,故称为水银。但是生成的水银容易挥发,不易收集,而且操作人员会易发生汞中毒。人们吸取经验教训后改用密闭方式制汞,有的是密闭在竹筒中,有的是密闭的石榴罐中。
古代人对于液态的金属汞非常感兴趣,在东方,道士们用汞冶炼仙丹;在西方,炼金术士们认为水银是一切金属的共同化身——是一种组成一切金属的“元素”。据记载及相关调查结果,秦始皇兵马俑中含有大量的水银,这些水银被用作模拟墓室内壮观的“江河湖海”。此外,在公元前1500年的埃及坟墓中也发现了一小管水银。 [1-4]

金属汞
温度计
温度计是我们生活中非常常用的物品。在众多的温度计当中,水银温度计更是常见,它是我们最为常用的体温计。水银温度计的原理跟大多数温度计一样,利用的都是受热膨胀的原理。水银作为唯一的一种液态金属,具有很好的导热性,它的凝固点是-39℃,沸点是356.7℃,测量温度范围可从-39℃到357℃,是一种非常宽范围的温度计,比煤油温度计宽很多。
常用的水银温度计,是由一个盛有水银的玻璃泡,毛细管,刻度和温标等组成的。由于水银温度计有热惯性,所以应该在温度计达到稳定状态后读数。读数时应在温度凸形弯月面的最高切线方向读取,目光直视。
水银温度计是玻璃制品,需格外小心,若不慎将水银温度计打破,需及时处理:首先用卡纸或其他工具将细小的水银珠赶成较大的水银珠,然后装到装满水的容器中进行液封,避免其挥发,再在温度计破裂水银洒落处撒上硫粉,汞会和硫反应生成不挥发的硫化汞,这样可以处理难以除去的小汞珠。此外还应注意通风,尽量减少水银对人体的伤害。 [5-6]
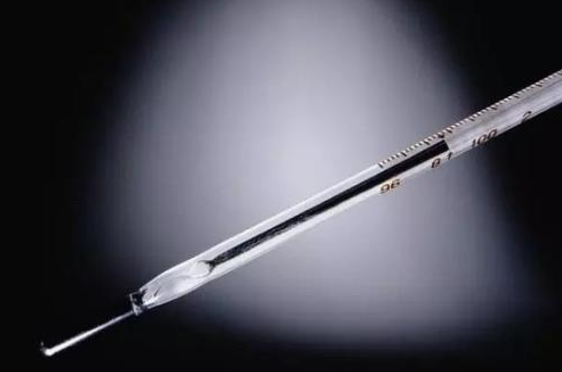
水银温度计
汞灯与日光灯
汞灯是利用汞放电时产生汞蒸气获取可见光的电光源。汞灯可分为低压汞灯、高压汞灯和超高压汞灯三种。低压汞灯工作时汞蒸气压小于一个大气压,此时汞原子主要辐射波长为253.7nm的紫外线。
我们生活中常见的日光灯就是低压汞灯。日光灯的工作原理如下:220伏的电压加到启辉器的两极后,立即使启辉器中的惰性气体电离,产生辉光放电。辉光放电的热量使双金属片受热膨胀,接通电路。灯丝很快被电流加热,发射出大量电子。这时,由于启辉器两极闭合,两极间电压为零,辉光放电消失,管内温度降低;双金属片自动复位,两极断开,电流切断。由于电流突然切断,镇流器产生很大的自感电动势,与电源电压叠加后作用于管两端。灯丝受热时发射出来的大量电子,在灯管两端高电压作用下,以极大的速度由低电势端向高电势端运动。在加速运动的过程中,碰撞管内氩气分子,使之迅速电离。氩气电离生热,热量使水银产生蒸气,随之水银蒸气也被电离,并发出强烈的紫外线。在紫外线的激发下,管壁内的荧光粉发出近乎白色的可见光。
常用的日光灯灯管内壁涂以卤磷酸钙荧光粉,它可以将汞产生的紫外线转变为可见光。节能型荧光灯内壁涂有稀土元素三基色荧光粉(由氧化钇(发红光,峰值波长为611nm)、多铝酸镁(发绿光,峰值波长为541nm)和多铝酸镁钡(发蓝光,峰值波长为450nm)按一定比例混合成),发光效率更高。
汞灯常用于霓虹灯广告牌以及其他大型彩灯。在现代集成电路的加工过程中,经常需要进行光刻操作,常用汞灯作为紫外线发射源实现对光刻胶的曝光。此外,低压汞灯还能发出非常窄的光谱线,在光谱学中,这可以用于校准光谱位置。[7-10]

水俣病
1956年,日本水俣湾附近出现了一种奇怪的病。这种病症最初出现在猫身上,被称为“猫舞蹈症”。病猫步态不稳,抽搐、麻痹,甚至跳海死去,被称为“自杀猫”。随后不久,此地也发现了患这种病症的人。患者由于脑中枢神经和末梢神经被侵害,轻者口齿不清、步履蹒跚、手足麻痹,重者会神经失常,身体弯弓高叫,直至死亡。症状如上。这种“怪病”就是日后轰动世界的“水俣病”。
“水俣病”的罪魁祸首是当时水俣湾附近的化工厂,在氯乙烯和醋酸乙烯在制造过程中要使用含汞(Hg)的催化剂,这使排放的废水含有大量的汞。工厂所选的催化剂氯化汞和硫酸汞本身虽然也有毒,但毒性不很强。然而它们在海底泥里能够通过一种叫甲基钴氨素的细菌作用变成毒性十分强烈的甲基汞。甲基汞每年能以1%速率释放出来,对上层海水形成二次污染,长期生活在这里的鱼虾贝类最易被甲基汞所污染,据测定水俣湾里的海产品含有汞的量已超过可食用量的50倍,随着这些被污染的鱼虾通过食物链进入人体。甲基汞被肠胃吸收,侵害脑部和身体其他部分。进入脑部的甲基汞会使脑萎缩,侵害神经细胞,破坏掌握身体平衡的小脑和知觉系统。孕妇如果吃了被甲基汞污染的海产品后,也可能引起婴儿患先天性水俣病,就连一些健康者(可能是受害轻微,无明显病症)的后代也难逃恶运。许多先天性水俣病患儿,都存在运动和语言方面的障碍,其病状酷似小儿麻痹症。因此,为了避免悲剧的再次发生,所有的工业污水都应经过处理再排放。[11]
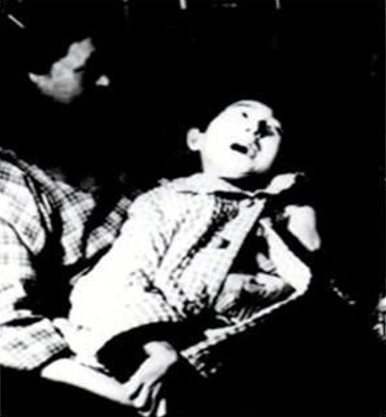
水俣病患者
雷汞
雷汞[Hg(ONC)2]是一种非常重要的起爆剂。它又称雷酸汞,是最早发现和使用的一种起爆药。根据制取的方法不同,有白色和灰色两种结晶,纯的雷汞是白色晶体,但大部分情况下呈棕黄色,密度为 4.42g/cm³。吸湿性小,常温下尚安定,在40到50℃以上时。长期库存易分解。在温度高于100℃易发生自爆。雷汞对冲击、摩擦、火焰及电火花都比较敏感。五分钟发火点为170到180℃,五秒钟发火点为210℃。有水存在时与铝、镁等金属作用激烈,与锌、铅有缓慢的反应,应避免让雷汞接触到铝、锰、锌、铜等金属。
雷汞在1815年首先开始用于火帽,1865年用于雷管。雷汞的出现,使炸药领域得到迅速扩展。雷汞是枪械上第一种拿来做专门引药的物质,在19世纪中使用在雷帽撞击式枪枝上。雷汞安定性能相对较差、有剧毒,含雷汞的击发药易腐蚀炮膛和药筒,现已为叠氮化铅等起爆药所代替。[12]

参考文献
- [1] Stillman, J. M. (2003). Story of Alchemy and Early Chemistry. Kessinger Publishing. pp. 7–9. ISBN 978-0-7661-3230-6.
- [2] “Mercury and the environment — Basic facts”. Environment Canada, Federal Government of Canada. 2004. Archived from the original on 16 September 2011. Retrieved 27 March 2008.
- [3] “Mercury — Element of the ancients”. Center for Environmental Health Sciences, Dartmouth College. Archived from the original on 2 December 2012. Retrieved 9 April 2012.
- [4] “Qin Shihuang”. Ministry of Culture, People’s Republic of China. 2003. Archived from the original on 4 July 2008. Retrieved 27 March 2008.
- [5] Hammond, C. R The Elements Archived 26 June 2008 at the Wayback Machine in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- [6] Surmann, P; Zeyat, H (November 2005). “Voltammetric analysis using a self-renewable non-mercury electrode”. Analytical and Bioanalytical Chemistry. 383 (6): 1009–13. doi:10.1007/s00216-005-0069-7. PMID 16228199.
- [7] Hopkinson, G. R.; Goodman, T. M.; Prince, S. R. (2004). A guide to the use and calibration of detector array equipment. SPIE Press. p. 125. Bibcode:2004gucd.book…..H. ISBN 978-0-8194-5532-1.
- [8] Howatson A H (1965). “Chapter 8”. An Introduction to Gas Discharges. Oxford: Pergamon Press. ISBN 978-0-08-020575-5.
- [9]王锦雷. 日光灯发光原理[J]. 农村电工, 2004(4):46-46.
- [10]崔铮 微纳米加工技术及其应用[M],高等教育出版社
- [11]杨丽.环境污染治理:日本水俣教训及其启示:中国社会管理论坛,2012
- [12] http://baike.asianmetal.cn/metal/hg/application.shtml
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

























No comments yet.