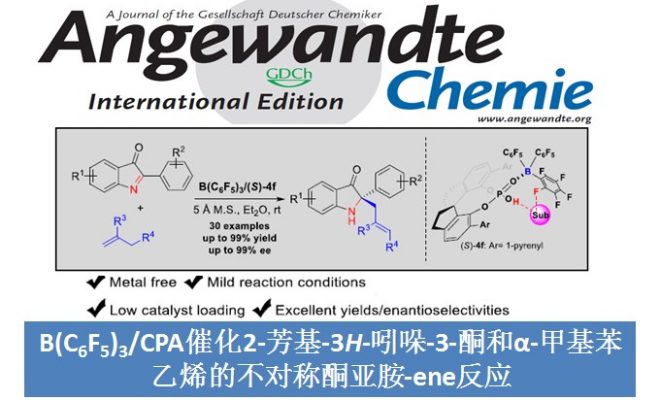
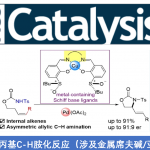
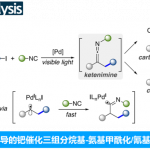
Ene反应是带有烯丙基氢的烯烃和亲烯体之间发生的反应,这是最直接的原子利用率最高的碳-碳键形成方法。Brønsted酸和Lewis酸可以有效地催化区域选择性的亚氨-ene反应,但关于酸催化不对称的亚氨-ene反应的报道还很少。1998年,Lectka团队和Jørgensen团队首次报道了Lewis酸CuClO4-BINAP络合物或CuPF6-BINAP络合物分别催化对甲苯磺酰基取代的α-亚氨酯的对映选择性醛亚胺-ene反应[1]。受到该报道的启发,醛亚胺-ene反应得到了极大的发展,而同样重要的酮亚胺-ene反应因酮亚胺的活性低、空间位阻大等原因一直停滞不前。到目前为止,关于不对称酮亚胺-ene反应的报道只有Jia课题组报道的Ni(ClO4)2和手性膦络合物催化N-磺酰基α-酮亚氨酸酯和α-甲基苯乙烯的不对称酮亚胺-ene反应这一例[2](Scheme 1A)。受到该课题组报道的不对称酮亚胺-ene反应的启发,南开大学李鑫团队报道了第一例B(C6F5)3/手性磷酸催化2-芳基-3H-吲哚-3-酮和α-甲基苯乙烯的对映选择性酮亚胺-ene反应,能以良好的收率和优秀的对映选择性得到一系列重要的四取代手性吲哚-3-酮衍生物(Scheme 1B)。相关研究成果发表于
“B(C6F5)3/Chiral Phosphoric Acid Catalyzed Ketimine-ene Reaction of 2-Aryl-3H-indol-3-ones and α-Methylstyrenes”
Zhang, Q.-X.; Li, Y.; Wang, J.; Yang, C.; Liu, C.-J.; Li, X.;* Cheng, J.-P. Angew. Chem. Int. Ed. 2020, 59, 4550-4556. DOI: 10.1002/anie.201915226
Scheme 1. 不对称酮亚胺-ene反应
论文作者介绍
李鑫教授
研究经历
- 1998-2002 南开大学化学学院本科 导师:程津培 院士
- 2002-2007 南开大学化学学院直攻博 导师:程津培 院士
- 2007-2009 中国科学院化学研究所博士后 合作导师:罗三中 研究员
- 2009-2010 中国科学院化学研究所 副研究员
- 2010-2017 南开大学化学学院 副教授
- 2018-至今 南开大学化学学院 教授
研究领域
物理有机化学在不对称催化反应机理研究中的应用、新型手性质子酸催化剂设计及应用、含有手性季碳中心化合物的不对称合成等。
论文概要
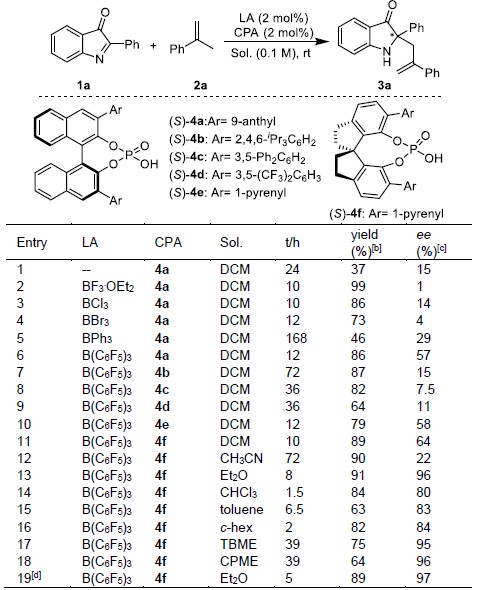
以2-苯基-3H-吲哚-3-酮1a和α-甲基苯乙烯2a 为模板底物,作者对各种反应条件进行反复筛选,确定最佳条件为(Table 1):2 mol%B(C6F5)3和2 mol%(S)–4f为催化剂,5Å分子筛为添加物,乙醚为溶剂,在室温条件下反应5 h,能以89%的收率和97%的对映选择性得到相应产物3a。
Table 1. 条件筛选
在最优反应条件下,作者对2-芳基-3H-吲哚-3-酮的底物范围进行了考察。各种C5位和C2位取代的2-芳基-3H-吲哚-3-酮均能较好的适应反应条件,能以良好至优秀的收率和优秀的对映选择性得到一系列3,3-二取代吲哚酮化合物。随后,作者考察了烯烃的底物范围。各种邻、间、对为取代的α-甲基苯乙烯以及环状烯烃均能与2-苯基-3H-吲哚-3-酮反应,能以优秀的收率和对映选择性得到一系列相应产物。
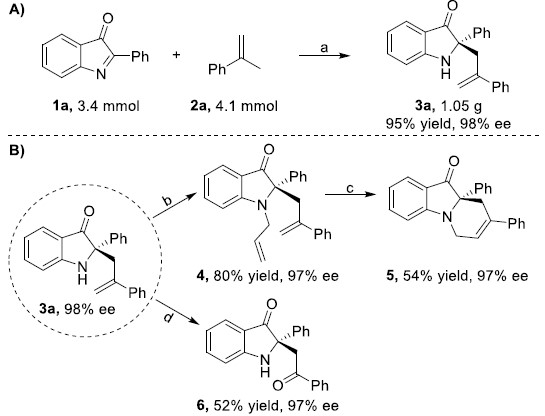
为了证明反应的应用潜力,作者又进行扩大化反应和一系列衍生反应(Scheme 2)。将反应扩大至3.4mmol,反应产物的收率和对映选择性与模板反应保持一致。通过简单的衍生反应,作者可将3a转化为N-烯丙基化产物4。然后,在Grubbs II催化作用下,4又可发生关环反应生成多环亚胺5。同时,在氧化条件下,4可转化为化合物6。
接着,作者通过理论计算阐明了B(C6F5)3在反应中的作用即能增强磷酸的酸度、有助于稳定过渡态以及能通过C–H…F氢键相互作用改变手性控制环境。
Scheme 2. 扩大化反应和衍生反应
论文总结评价
南开大学李鑫团队报道了第一例B(C6F5)3/手性磷酸催化2-芳基-3H-吲哚-3-酮和α-甲基苯乙烯的对映选择性酮亚胺-ene反应,能以良好的收率和优秀的对映选择性得到一系列重要的四取代手性吲哚-3-酮衍生物。同时,作者通过理论计算阐明了B(C6F5)3在反应中发挥着增强磷酸的酸度、稳定过渡态以及通过C–H…F氢键相互作用改变手性控制环境等作用。
参考文献
- [1] (a) Drury, W. J.; Ferraris, D.; Cox, C.; Young, B.; Lectka, T. Am. Chem. Soc. 1998, 120, 11006-11007; DOI: 10.1021/ja982257r (b) Yao, S.; Fang, X.; Jørgensen, K. A. Chem. Commun. 1998, 2547-2548. DOI: 10.1039/A808019D
- [2] Liu, R.-R. Wang, D.-J. Wu, Xiang, L. B.; Zhang, G.-Q.; Gao, J.-R.; Jia, Y.-X. ACS Catal. 2015, 5, 6524-6528. DOI: 1021/acscatal.5b01793
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.