本文作者:杉杉
导读
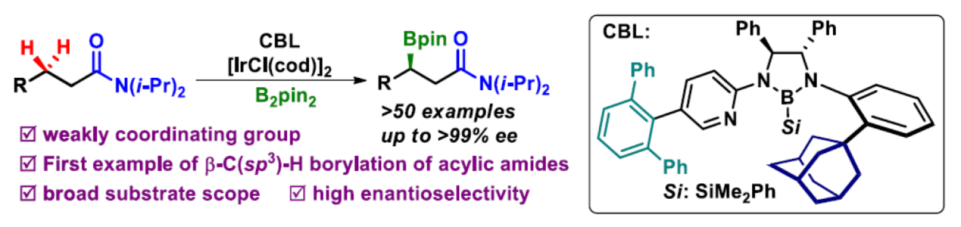
近日,中国科学院兰州化学物理研究所苏州研究院徐森苗课题组在Angew. Chem. Int. Ed.上发表论文,首次报道了使用铱催化,实现无环酰胺中亚甲基C-H键的定向对映选择性β-C(sp3)-H硼化反应,从而获得相应的手性β-官能团化的酰胺衍生物,具有良好的官能团耐受性。同时,反应的关键之处在于铱催化剂和手性双齿硼基配体的结合。此外,通过对产物的后期衍生化,进一步证明了反应的实用性。
Iridium-Catalyzed Enantioselective Unbiased Methylene C(sp3)-H Borylation of Acyclic Amides
Yuhuan Yang, Lili Chen, and Senmiao Xu
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202013568 https://doi.org/10.1002/anie.202013568
正文
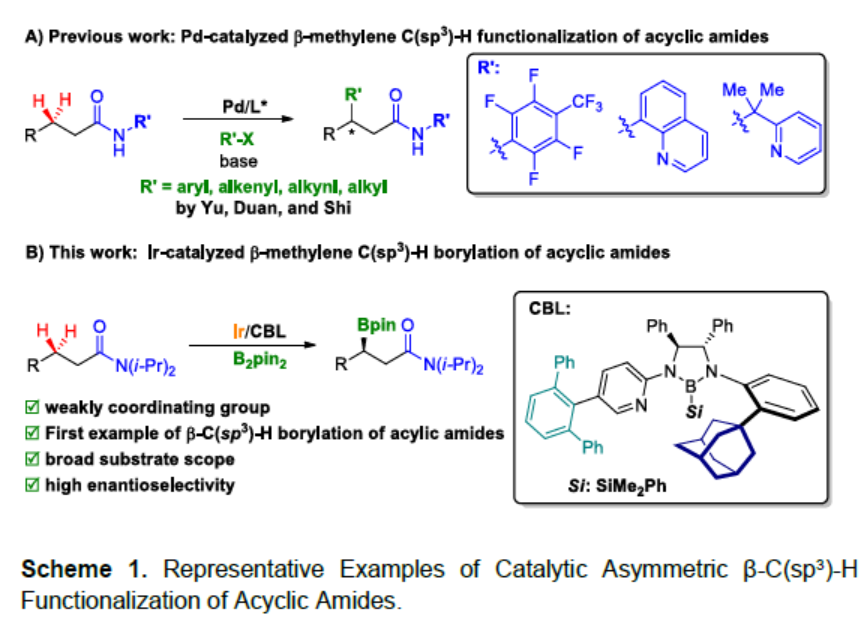
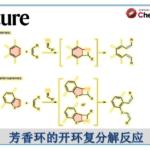
过渡金属催化不对称C-H官能化,作为合成手性化合物的高效方式。其中,涉及区域选择性的控制以及将过渡金属插入前手性C-H键中的对映选择性C-H功能化,已引起众多的关注。尤其是通过两个对映体C-H键的去对称化,已作为合成手性碳中心的有效方法。然而,对于无环分子中存在两个对映体亚甲基C(sp3)-H键的对映选择性反应研究相对较少,仅有少数课题组(Yu[1],Shi[2]和Duan[3])报道了钯催化立体选择性β-官能化的实例,包括无环酰胺的芳基化、烷基化、烯基化和炔基化(Scheme 1A)。该反应除了使用优雅的手性配体之外,钯与单齿或双齿导向基团的N-Pd共价键的形成,以促进一致的金属化-去质子化途径也至关重要。然而,对于C-杂原子键形成却很少,可能是由于缺乏合适的手性配体。
手性硼酸及其衍生物广泛存在于合成化学、材料科学和药物中。而通过催化不对称合成此类骨架,常需对底物预活化,从而增加了额外的试剂和繁琐的步骤。尽管已实现Cu催化α,β-不饱和酰胺的共轭硼酸化,从而合成对映体富集的β-硼化酰胺化合物,但底物范围有限。因此,过渡金属催化(原子经济性)C-H硼化则具有吸引力,而不对称C-H硼化反应作为合成手性有机硼化合物的有效方式,但对于无环分子中未活化亚甲基C(sp3)-H键的区域和立体选择性的硼酸酯化仍具有挑战。Sawamura课题组[4]报道了Ir/手性亚磷酸酯催化,实现亚甲基C-H键对映选择性β-C(sp3)-H硼化反应。但使用简单且易得的羰基化合物作为导向基团,仍未得到开发,由于存在低反应性以及难以控制区域选择性和对映选择性。2020年,Sawamura课题组[5]报道了使用氢键策略,实现酰胺底物的对映选择性γ-C(sp3)-H硼化反应。但是,对于其他位置的反应仍然难以捉摸。在此,中国科学院兰州化学物理研究所苏州研究院徐森苗课题组报道了使用手性双齿硼烷基配体(CBL)与Ir催化体系,成功实现了对酰胺底物的不对称β-C(sp3)-H硼化反应(Scheme 1B)。
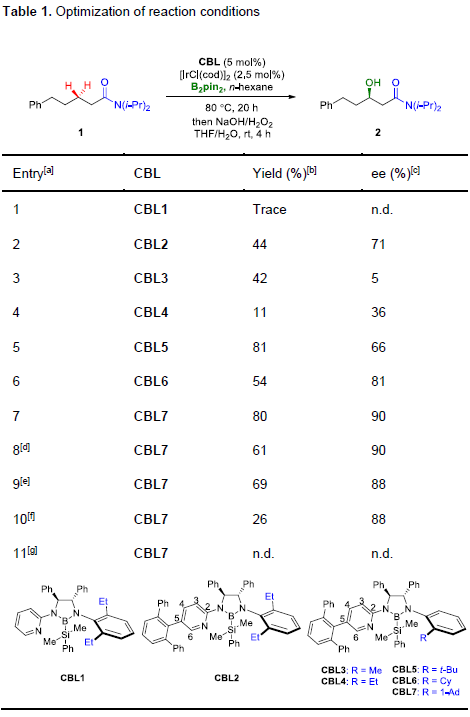
首先,作者以1作为模型底物,对相关配体进行了筛选(Table 1)。当使用带有1-金刚烷基的CBL7时,可获得80%收率和90%ee的目标产物2(entry 7)。
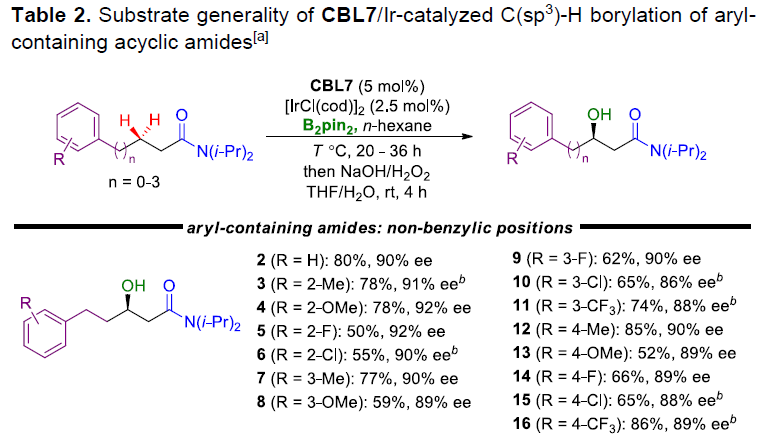
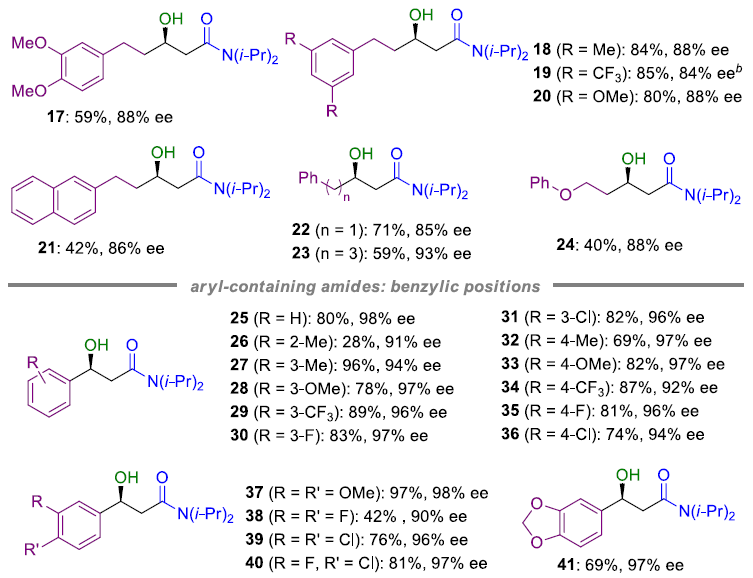
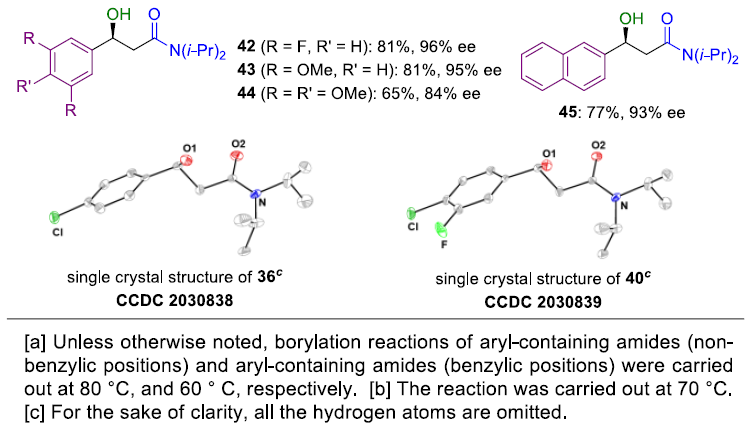
在获得上述最佳反应条件后,作者开始对芳香族底物1进行了扩展(Table 2)。各种具有不同官能团的N,N-二异丙基-5-芳基戊酰胺底物,均可顺利进行C(sp3)-H硼化反应,从而获得相应的β-羟基产物2-21,其ee值为84-92%。具有不同烷基链长度的底物以及含有杂原子的烷基链的底物均可被很好地耐受,获得产物22-24。此外,使用N,N-二异丙基-3-芳基丙酰胺底物时,反应具有更高的活性,从而获得产物25-45。值得注意的是,由于空间位阻的原因,导致邻位取代的苯环底物(26)的收率较低。
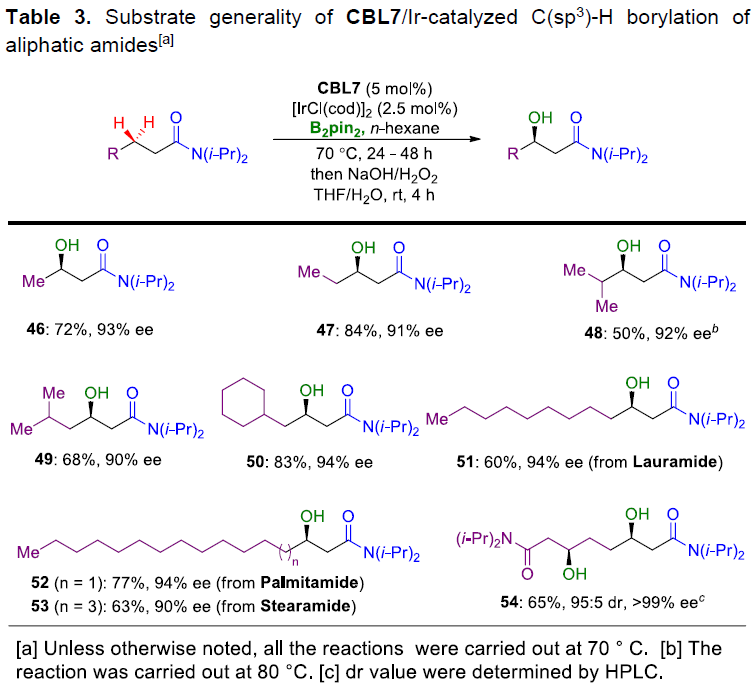
随后,作者对脂肪族酰胺底物进行了相关的扩展(Table 3)。当使用CBL7在70 ℃下进行反应时,即使简单的丁酰胺和戊酰胺也可顺利地进行硼酸酯化和氧化,获得相应的产物46和47。γ-支链酰胺底物由于空间位阻导致反应性较低,需在80 ℃下反应,以50%的收率获得产物48。而δ-支化酰胺底物具有优异的反应性,当在70 ℃下进行反应时,以68%和83%的收率获得产物49和50。此外,在标准条件下,饱和脂肪酸酰胺也能够顺利进行反应,从而获得相应的产物51-53,进一步证明了该方法的实用性。有趣的是,辛二酰胺可以进行二硼化反应,得到3,6-二官能化产物54,收率为65%,dr为95:5,ee值大于99%。
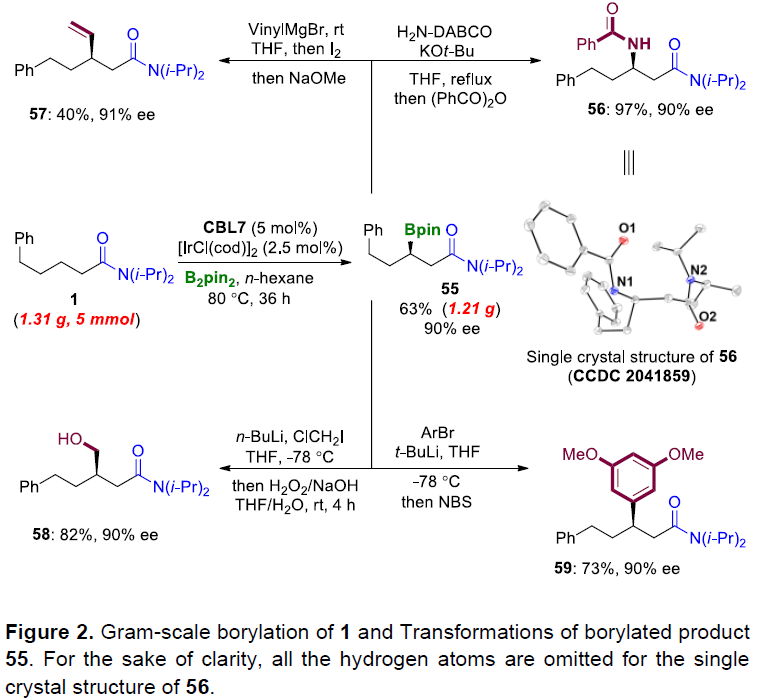
为了进一步证明反应的实用性,作者进行了相关的后期修饰(Figure 2)。首先,N,N-二异丙基-5-苯基戊酰胺的克级反应,以63%的收率和90%ee获得硼化产物55。紧接着,以55为模板底物,进行了相关的衍生化,从而以40-97%的收率的相应化合物56-59。
总结
中国科学院兰州化学物理研究所苏州研究院徐森苗课题组开发了一种CBL/Ir催化体系,可在温和的反应条件下,实现各种无环酰胺底物的不对称β-C(sp3)-H硼化反应,从而获得相应的手性β-官能团化酰胺衍生物。此外,通过对产物的后期衍生化,进一步证明了反应的实用性。
参考文献
[1] G. Chen, W. Gong, Z. Zhuang, M. S. Andrä, Y.-Q.Chen, X. Hong, Y.-F. Yang, T. Liu, K. N. Houk, J.-Q. Yu, Science 2016, 353, 1023-1027.[2] a) Y.-Q. Han, Y. Ding, T. Zhou, S.-Y.Yan, H. Song, B.-F. Shi, J. Am. Chem. Soc. 2019, 141, 4558-4563; b) Y. Ding, Y.-Q.Han, L.-S. Wu, T. Zhou, Q.-J.Yao, Y.-L. Feng, Y. Li, K.-X. Kong, B.-F. Shi, Angew. Chem. Int. Ed. 2020, 59, 14060-14064; c) S.-Y.Yan, Y.-Q.Han, Q.-J. Yao, X.-L. Nie, L. Liu, B.-F. Shi, Angew. Chem. Int. Ed. 2018, 57, 9093-9097.
[3] S.-B. Yan, S. Zhang, W.-L.Duan, Org. Lett. 2015, 17, 2458-2461.
[4] R. L. Reyes, T. Iwai, S. Maeda, M. Sawamura, J. Am. Chem. Soc. 2019, 141, 6817-6821;
[5] R. L. Reyes, M. Sato, T. Iwai, K. Suzuki, S. Maeda, M. Sawamura, Science 2020, 369, 970-974;
















No comments yet.