译自Chem-Station网站日本版 原文链接:激レア!?アジドを含む医薬品 〜世界初の抗HIV薬を中心に〜
翻译:炸鸡
提起叠氮基(-N3),可能大家最先想到的是在2022年诺贝尔化学奖中的点击化学中发挥重要作用的叠氮基,可能还有库尔提斯重排反应(Curtius Rearrangement),合成胺的还原反应,以及氰基反应合成四唑等许多应用场景。尤其在点击化学的代表反应铜催化的叠氮-炔基Husigen环加成反应(CuAAC反应)以及点击化学中的SPAAC反应(Strain-promoted Azide-Akyne Click Cheistry reaction)中,叠氮基都扮演着十分重要的角色。
叠氮基之所以能在点击化学里受到重用,最主要的原因是叠氮基对生物体的适应性很高,叠氮基几乎只与炔烃发生反应,与生物体内其他的分子很难发生反应。因为这一很好的特点,叠氮基近年来在化学生物领域的应用越来越繁盛。除了在化学生物领域,在新药研发领域叠氮基也有着惊喜的表现,叠氮基可以和氰基反应合成四唑,四唑是羧酸的生物电子等排体,因为四唑具有良好的脂溶性,已经是很多药物或候补药物中高频出现的结构了。叠氮基不仅可以作为反应中间体,还可以直接作为药物的部分结构。
世界上首例抗HIV药物
世界上首个成功商品化的治疗或预防HIV的药物是叠氮胸苷(zidovudine, 简称ZDV)(图1), 又名azidothymidine (简称为AZT),高年级的药学专业的学生或药剂师即使没亲眼见过这款药也一定听说过这款药。叠氮胸苷的商品名为齐多夫定,临床上更多是被简称为ZDV或AZT。下文简称为齐多夫定。
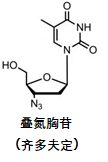
图1 齐多夫定(叠氮胸苷)的结构式
1964年Michigan Cancer Foundation 的J.P. Horwitz 博士等人首次合成出了齐多夫定[1],但最初是作为抗恶性肿瘤的药物被使用的。直到1983年,获得性免疫缺陷综合征(AIDS)的病因才被确定为感染了HIV病毒,当齐多夫定被合成出时,现在的抗病毒药物的“老大”阿昔洛韦(抗疱疹病毒)尚未被合成出来。Horwitz等人当年的做法是把胸苷3位上的羟基进行磺酰基化,然后与叠氮或碘之类的亲核试剂反应合成齐多夫定,这个合成路线在今天看来也是一条很简单的路线(图2)。叠氮在那个年代算是一个相对易得的良好亲核剂,所以在当时频频被用来改变分子结构。Horwitz等人当年用的LiN3,现在我们大多用NaN3,也是颇具年代感了。
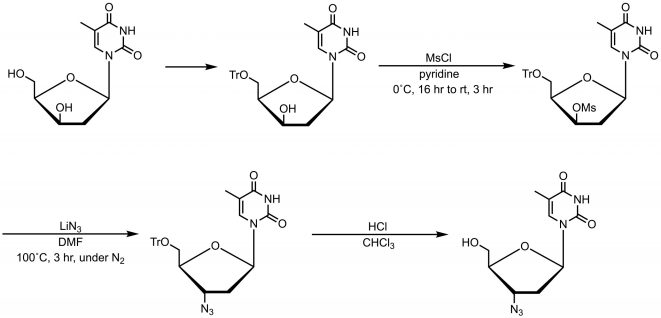 图2 齐多夫定的合成[1]
图2 齐多夫定的合成[1]
1981年,艾滋病开始疯狂肆虐全球。之后仅仅过了4年,当时在美国国立卫生研究所(NIH)工作的满屋裕明博士等人构建的检测体系中,齐多夫定展现出了强大的抗HIV病毒的活性,又过了两年,齐多夫定被葛兰素史克公司制成产品,就这样史上第一个抗HIV药物诞生了。那么,叠氮基团对药物的抗HIV活性有什么样的贡献呢?事实是叠氮基本身和药物的药理活性没有实质性的关系。当年满屋博士提出的假说是“核酸衍生物2,’3’-dideoxynucleosides有抗HIV-1的活性”[2],果真如满屋博士所说的这样,不含叠氮基的核酸衍生药物地达诺新和扎西他滨(图3)也相继被确认具有抗HIV活性(现在临床上已经不再使用这两个药物了)。
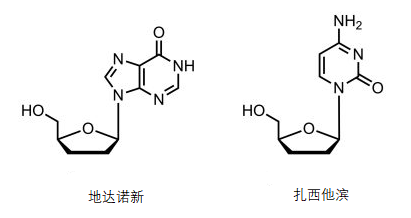 图3 第二个和第三个被发现的抗HIV药物地达诺新和扎西他滨的结构式
图3 第二个和第三个被发现的抗HIV药物地达诺新和扎西他滨的结构式
核酸衍生物具有抗HIV活性的要点是核糖环3位上不能有羟基,因为3位的羟基是逆转录病毒靠逆转录酶增殖的据点。那么为什么齐多夫定会被发现具有抗HIV活性呢,笔者估计大概是某位研究人员偶然把手边的齐多夫定拿去做检测,意外发现它的抗HIV活性非常好,于是齐多夫定就阴差阳错地成了抗HIV药物了。但是齐多夫定有诸多缺点,如药效不强﹑副作用多﹑会使HIV反转录酶产生耐药性,所以需要配合其他药物一起使用,如在主流治疗艾滋病的疗法高效能抗艾滋病毒治疗法(俗称鸡尾酒疗法)中和其他药物一起使用。到了2024年,齐多夫定主要用于防范艾滋病的母婴传染途径。
齐多夫定的安全性·稳定性
现在获得上市批准的药物几乎都没有叠氮基,所以含有叠氮基的齐多夫定的安全性不由得让人担心。齐多夫定有着严重的骨髓抑制副作用,但这个副作用不是齐多夫定特有的,而是核酸逆转录酶抑制剂(NRTI)类药物共通的副作用,所以这一副作用似乎并不是叠氮基团导致的。
药物生产商在制剂化过程中会进行稳定性试验。截取自齐多夫定的说明书中的稳定性试验结果的一部分如下:
对药物在各种条件下进行强制分解,并使用高效液相色谱法(HPLC)进行检查。结果表明,齐多夫定在热条件下是稳定的,在酸和碱条件下相对稳定,但对光照不稳定且会分解。主要的分解产物是胸腺嘧啶。
齐多夫定在强光下不稳定,分解物为核酸盐和四氢呋喃环的开环物,但叠氮基对强光是稳定的。
对于药物来说重要的稳定性项目是代谢稳定性。药物主要在肝脏中受药物代谢酶催化发生反应,这时候就是叠氮基团发生反应的时刻了。像细胞色素P450之类的药物代谢酶主要催化氧化反应(比如把甲基催化为羟甲基),但在有的反应条件下,药物代谢酶会执行还原酶的功能,比如药物代谢酶遇到叠氮基,会把叠氮基还原为氨基。6位羟基与葡糖醛酸结合的齐多夫定的肝脏代谢路径如图4所示。代谢产物里的氨基并不是一个好预兆。
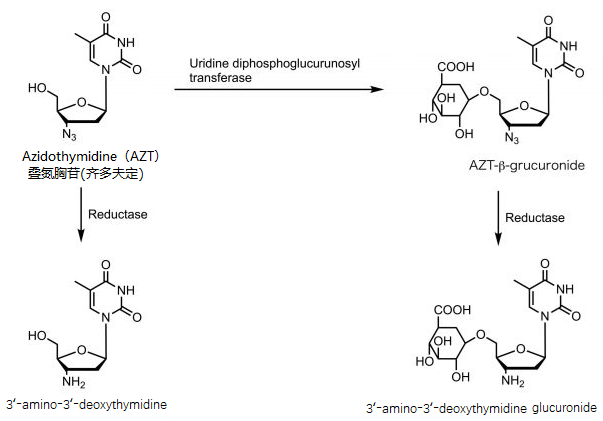 图4 齐多夫定的肝脏代谢路径
图4 齐多夫定的肝脏代谢路径
含有叠氮基团的其他生理活性物质
除了齐多夫定以外,还有多个含叠氮基团的生理活性物质曾被开发或被用于临床。这些分子归纳在图5。
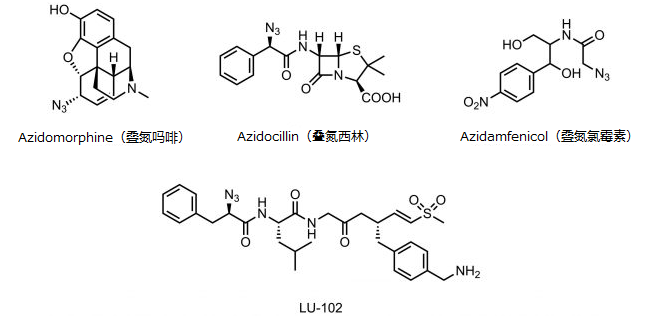 图5 含叠氮基的生理活性化合物
图5 含叠氮基的生理活性化合物
Azidomorphine(叠氮吗啡)是将吗啡的6位羟基替换为叠氮基的吗啡衍生物,在生物体内显示出约为吗啡40倍的药理活性[3]。Azidocillin(叠氮西林)是β-内酰胺酶抑制剂(抗菌药),以Globacillin®为商品名,1970年代左右也有临床应用。另一种抗菌药氯霉素的衍生物有Azidamfenicol(叠氮氯霉素)。1967年在挪威国内,作为与类固醇地塞米松的合剂,以软膏的形式在市场上销售[4]。2015年又开发了名为LU-102的蛋白体抑制剂[5]。
可惜的是近年来药物化学界几乎看不到叠氮基的出现了,所以齐多夫定在药物化学界特别引人注目。另一方面,作为化学探针的叠氮化合物正在陆续被开发中,细胞内和生物体内的使用正在爆炸性地增加。虽然叠氮基作为生物正交化学中的置换基而受到称赞,因为含叠氮基的医药品很少,所以叠氮基的毒性和代谢稳定性等目前不太清楚。如果这些问题能够解决的话,叠氮基可能会被积极用于获取结构活性相关的信息,如:可以测量一下某处残留的叠氮中间体的生理活性。
闲话
利尿药当中有三氯噻嗪和氢氯噻嗪两种医药品,这些是以噻嗪为基本骨架的医药品,与叠氮基完全没有关系。
参考文献
[1] J.P. Horwitz; J. CHUA, M. Noel, “Nucleosides. V. The Monomesylates of 1-(2′-Deoxy-β-D-lyxofuranosyl) thymine”, The Journal of Organic Chemistry, 1964, 29(7), 2076-2078.
[2] 満屋裕明, HIV-1 感染症と AIDS の治療薬の研究開発の経験からみた NIH, https://www.kantei.go.jp/jp/singi/kenkouiryou/tyousakai/dai2/siryou05-1.pdf, 2024年1月7日閲覧.
[3] K. Horváth, M. Wollemann, “Azidomorphine is an agonist of high-affinity opioid receptor binding sites”, Neurochem Res, 1986, 11, 1565-1569. DOI: 10.1007/BF00965775.
[4] Anton C. de Groot, “Monographs in Contact Allergy, Volume 3: Topical Drugs”, CRC PRESS, 2021, pp. 79.
[5] J. Kraus, M. Kraus, N. Liu, L. Besse, J. Bader, P.P. Geurink, G. de Bruin, A.F. Kisselev, H. Overkleeft, C. Driessen “The novel β2-selective proteasome inhibitor LU-102 decreases phosphorylation of I kappa B and induces highly synergistic cytotoxicity in combination with ibrutinib in multiple myeloma cells”, Cancer Chemother. Pharmacol, 2015 76(2), 383-396. DOI: 10.1007/s00280-015-2801-0.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.



















No comments yet.