本文作者:Joy
导读
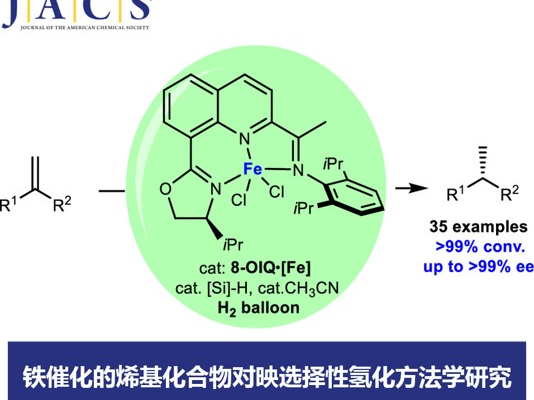
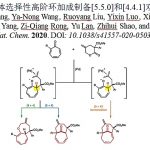
浙江大学的陆展团队首次报道一种采用铁催化剂促进的由1,1-二取代烯基化合物参与的高度对映选择性氢化反应方法学,进而以良好的反应收率与优良的对映选择性,获得一系列手性烷基衍生物。首先,该课题组设计并合成出全新的手性8-噁唑啉亚氨基喹啉配体 (chiral 8-oxazoline iminoquinoline ligand, 8-OIQ)及其相应的铁配合物。之后,在上述手性铁配合物存在的条件下,作者发现,采用1 atm的氢气压力,即可完成相应的不对称氢化过程。这一全新的对映选择性氢化策略具有实验操作简洁以及良好的官能团兼容性等优势。此外,该小组通过氘标记实验,对相关的反应机理进行初步研究。
Iron-Catalyzed Highly Enantioselective Hydrogenation of Alkenes
P. Lu, X. Ren, H. Xu, D. Lu, Y. Sun, Z. Lu, J. Am. Chem. Soc. 2021, 143, 12433. doi: 10.1021/jacs.1c04773.
正文
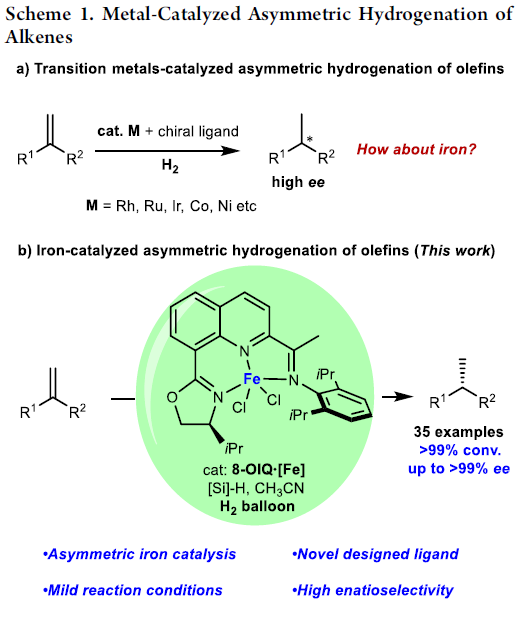
金属催化的烯基化合物对映选择性氢化策略作为制备光学活性化合物的一种有效方法,在学术界与工业界中已经获得广泛的应用[1]。值得注意的是,这一策略中,主要采用具有手性膦配体配位的贵金属催化剂 (Scheme 1a) [2]。然而,由于贵金属在地球中含量的稀缺性,因此,合成化学家更多开始关注地球中含量较为丰富的金属在烯基衍生物催化不对称氢化反应中的应用[3]。铁作为地球中含量最丰富的过渡金属,不仅价格低廉,并且具有良好的生物相容性以及环境友好的优势[4]。然而,由于缺乏适宜的手性配体,因此,在铁催化的烯基衍生物催化不对称氢化反应方法学的研究中,将存在极大的挑战。近期,尽管已经开发出一系列能够应用于烯基化合物催化氢化方法学的膦基或吡啶基铁配合物 (phosphine- or pyridine-based iron complexes)[5],然而,采用铁催化剂参与的烯基衍生物的高度对映选择性氢化反应方法学,一直以来,仍未有相关的研究报道。而寻找或设计有效的手性配体或适宜的催化体系,是解决上述问题的关键。这里,陆展教授课题组成功设计出一种喹啉基N,N,N-三齿手性配体 (quinoline-based N,N,N-tridentate chiral ligand),进而将其成功应用于铁催化的1,1-二取代烯基化合物的高度对映选择性氢化反应策略的研究 (Scheme 1b)。
(图片来源:J. Am. Chem. Soc.)
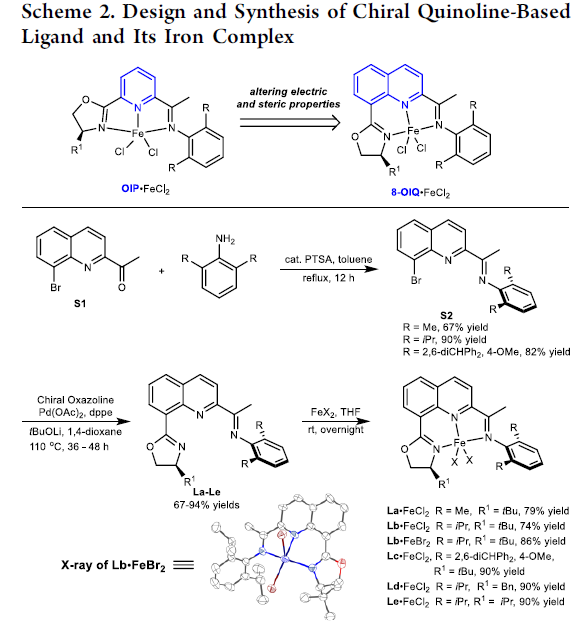
最初,作者已经筛选出能够应用于铁催化烯基化合物不对称氢化过程的噁唑啉亚胺吡啶 (oxazoline minopyridine, OIP)铁配合物[6]。然而,却存在如下缺陷:(1) 反应过程中,能够进行异构化的副反应,形成难以去除的三取代烯基化合物;(2) 仅能够获得中等程度的对映选择性;(3)反应过程的重现性较差。为解决上述问题,作者进一步设计出一种全新的8-噁唑啉亚氨基喹啉 (8-oxazoline iminoquinoline, 8-OIQ)配体,其中选择喹啉骨架代替原配体中相应的吡啶结构单元 (Scheme 2)。
(图片来源:J. Am. Chem. Soc.)
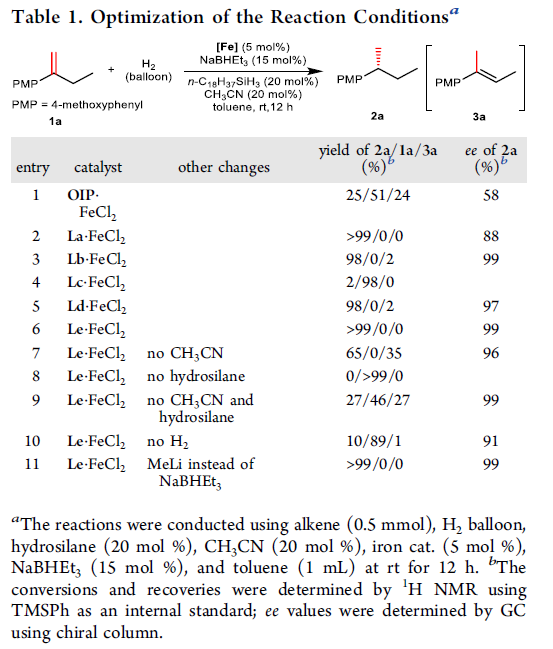
之后,作者采用1,1-二取代烯基化合物1a与氢气之间的反应作为模型反应。进行相关反应条件的优化研究 (entry 1-11)。进而确定最佳的反应条件为:在室温、1atm氢气压力条件下,采用R、R’均为异丙基取代的手性Le·FeCl2配合物作为催化剂,选择CH3CN与n-C18H37SiH3作为添加剂,NaBHEt3作为活化剂,甲苯作为反应溶剂,反应时间为12 h。
(图片来源:J. Am. Chem. Soc.)
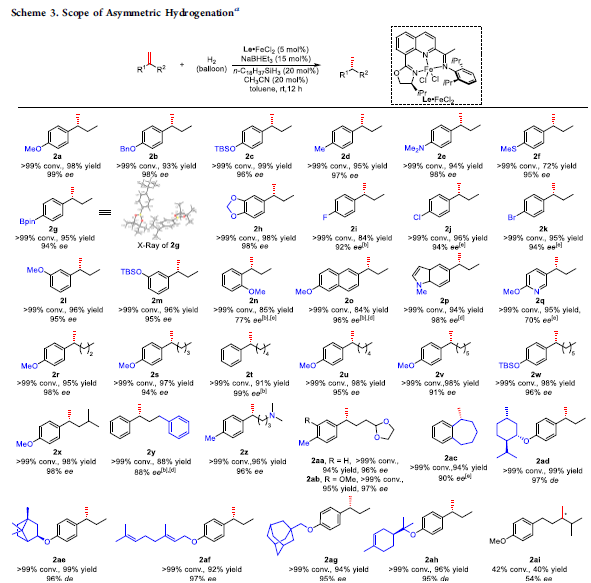
在上述最佳的反应条件下,作者对烯基化合物的底物应用范围进行研究 (Scheme 3)。作者发现,烯基化合物苯环中具有的富电子与缺电子取代基,例如醚键、硅醚、烷基、氨基、Bpin、硫醚以及卤素取代基,均能够与上述的最佳反应条件有效地兼容,并以优良的对映选择性获得相应产物2a–2m (> 92% ee)。并且,由于立体效应的存在,具有邻甲氧基苯基取代的烯基底物在10 mol % 手性催化剂存在下,尽管氢化过程够顺利进行,然而却获得具有较低 ee值的产物2n。同时,具有多环与杂环取代的烯基化合物 (1o–1q),同样能够良好地与上述的标准反应条件兼容。而且,具有脂肪族线性与支链 (1r–1x)以及苯基 (1y)取代的烯基底物,在上述的标准反应条件下,同样能够较为容易地转化为相应的手性产物 (88-98 % ee)。之后作者观察到,烷基链中具有氨基 (1z)与缩醛 (1aa, 1ab) 官能团取代的烯基底物,同样能够获得具有优良对映选择性 (96-97% ee)的手性产物2z-2ab。具有环外烯键的烯基底物1ac,能够获得90% ee的产物 2ac。接下来,作者进一步发现,具有薄荷醇(menthol)、冰片醇 (borneol)、金刚烷 (adamantane)、香叶醇 (geraniol)以及松油醇 (terpineol)结构单元的烯基底物,同样能够较好地参与上述的不对称氢化过程,并获得相应的手性产物2ad–2ah (95-97% ee)。进而表明这一全新的对映选择性氢化方案在具有天然产物以及药物结构单元的烯基底物的后期官能团化过程中具有潜在的应用价值。然而,将上述最佳的反应条件应用于非芳基1,1-二取代烯基底物的不对称氢化反应时,则无法获得优良的反应转化率与对映选择性 (42%转化率,54% ee)。
(图片来源:J. Am. Chem. Soc.)
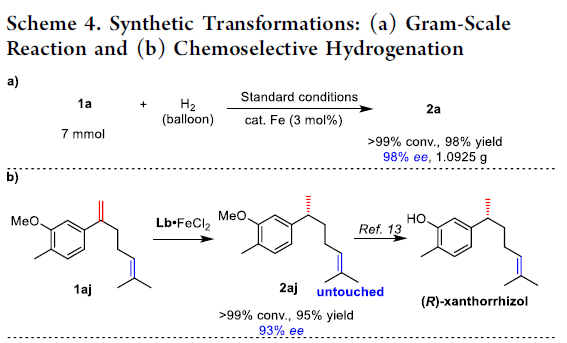
接下来,该小组进一步考察上述不对称氢化策略的合成应用价值。首先,作者发现,在3 mol % 铁配合物存在下进行的克级规模实验中,能够获得98%收率以及98% ee的产物2a (Scheme 4a)。同时,作者观察到,在具有更高立体位阻的Lb·FeCl2催化剂存在的条件下,带有两种不同类型的碳-碳双键的底物1aj,同样能够获得95%反应收率与93% ee的产物2aj。并且,底物中的三取代烯键未参与相应的氢化过程 (Scheme 4b)。这一独特的底物识别性能在序列合成策略的设计中具有潜在的应用价值。
(图片来源:J. Am. Chem. Soc.)
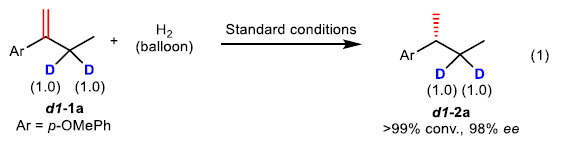
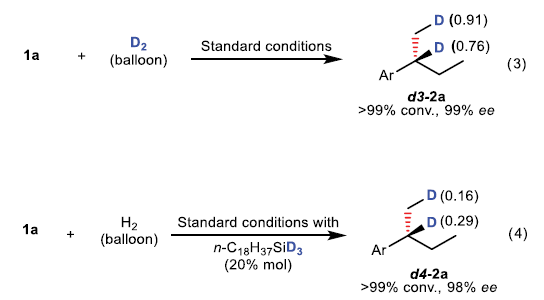
为阐明上述不对称氢化过程的反应机理,作者进行一系列氘标记实验研究 (eq 1-4)。首先,作者发现,采用α-D-烯基化合物 d1–1a在上述标准反应条件下参与的不对称氢化过程,能够获得无氘原子置乱的产物d1–2a (eq 1)。这一事实表明,不对称氢化过程中,未涉及α-亚甲基的参与。而在d2–1a转化为d2–2a产物的过程中,能够观察到在烯键的末端位置,出现氘原子的少量丢失 (eq 2)。
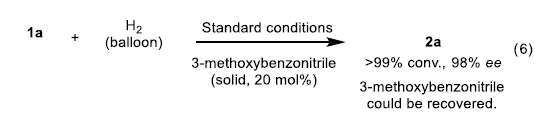
接下来,作者观察到,采用D2参与的不对称转化过程中,产物d3–2a的苄基与甲基位置存在少量的氢原子 (eq 3)。而选择氘代氢硅烷参与相关反应时,产物d4–2a中的苄基与甲基位置能够观察到少量氘原子的存在 (eq 4)。上述结果表明,氢硅烷可能作为一种潜在的氢化物源,参与相应的催化循环过程。之后,该小组在D-氢硅烷与氢气之间的反应中,观察到H-D交换现象。进而表明,在催化过程中,活性铁中间体可能与氢硅烷以及H2之间经历氧化加成或σ-键复分解步骤,转化为另外一种具有催化活性的铁中间体 (eq 5)。
同时,在采用固体腈 (例如3-甲氧基苯腈)作为添加剂代替MeCN时,作者发现,反应同样能够顺利进行,在反应完成之后,能够回收相应的固体腈添加剂 (eq 6)。其它的机理实验,参阅Supporting Information。
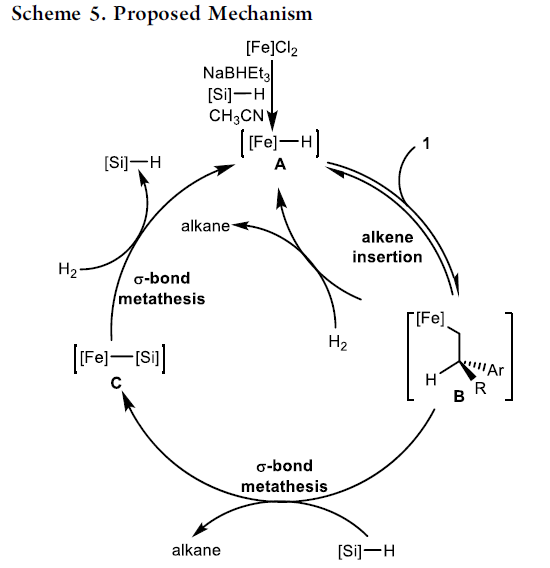
根据氘标记实以及前期的文献研究[7],作者提出一种可能的反应机理(Scheme 5)。首先,在NaBHEt3活化剂存在下,通过手性铁配合物,形成铁氢化物中间体 A。之后,通过烯基化合物的配位与插入过程,形成1,2-插入的铁烷基物种 B。铁烷基物种 B与氢硅烷之间经历σ-键复分解过程,获得手性烷基产物与铁硅基物种 C,C与氢分子之间通过进一步的σ-键复分解过程,形成铁氢化物中间体 A。然而,目前仍无法排除铁烷基物种 B与氢分子之间的σ-键复分解机理路径。其中,乙腈添加剂的作用可能是抑制2, 1-插入过程。并且,乙腈添加剂的存在,同样可能抑制通过2, 1-插入形成的铁中间体通过β-氢消除,产生三取代烷基化合物的反应过程。
(图片来源:J. Am. Chem. Soc.)
总结
综上所述,浙江大学的陆展团队设计出一种全新的手性N,N,N-三齿配体及其铁配合物,进而首次实现铁催化剂促进的一系列烯基化合物的高度对映选择性氢化反应方法学。这一全新的不对称氢化策略中,采用氢硅烷与乙腈作为有效的添加剂能够提高反应活性与不对称氢化过程的选择性。同时,该小组通过氘标记实验,对相关的反应机理进行初步研究。


















No comments yet.