本文作者:杉杉
导读
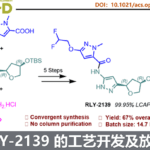
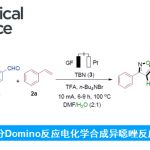
醇的C-O键活化在有机合成中具有重要的作用,由于存在较高的键能从而导致合成上具有一定的难度。近日,南京大学潘毅教授课题组(王毅副教授作为通讯作者)在德国应化杂志(Angewandte Chemie-International Edition)发表论文,提出可将肼基甲酸酯作为一种新型的烷基化试剂,可在温和的电解条件下,实现与杂芳烃的直接官能团化反应。该反应可在碳/铂电极的低氧化电位的无隔膜电池中反应,同时具有出色的底物耐受性,并以良好的收率获得多种伯、仲和叔烷基衍生的的杂环芳烃化合物。此外,该电化学脱氧烷基化反应的机理也被进一步研究。
Alkyl Carbazates for Electrochemical Deoxygenative Functionalization of Heteroarenes
Yongyuan Gao, Zhengguang Wu, Lei Yu, Yi Wang, and Yi Pan
Angew. Chem. Int. Ed. ASAP DOI: 10.1002/anie.202001571
正文
通过自由基构建新的C-C键作为一种高效的合成工具,可快速构建复杂的分子结构,已在生物医学和材料科学中广泛应用。近些年来,多种烷基自由基前体已被报道,如吡啶鎓盐、汉斯酯(Hantzsch)、卤代烷烃、有机硼、硫化物等等。醇类,作为食品和化学工业中最常用的原料之一,如果能够在温和的条件下,实现醇的脱羟基从而获得烷基自由基,则具有重要的意义。然而,由于强的C-O键能(BDE=95 kcal/mol)和未活化的醇的高氧化还原电势,从而导致羟基官能团的自由基裂解需要更加苛刻的条件。在经典的Barton-McCombie反应中,叔醇通过硫羰基部分的活化从而进行自由基脱氧过程,但是,由于高温条件以及使用有毒的锡试剂从而限制了其应用。近十年来,有文献报道将草酸烷基酯作为Barton脱氧的替代方法。此外,Overman和MacMillan报道了光催化共轭烯烃的脱氧烷基化反应。Gong也报道了使用草酸二烷基酯和锌作为还原剂,实现未活化烯烃的烷基化反应。然而,伯醇和仲醇通常不适用于此体系,并且该反应常需使用金属催化剂或化学氧化剂。
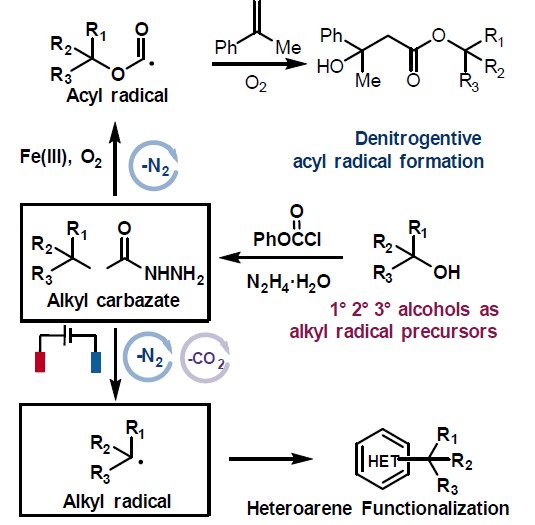
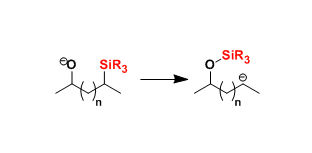
近些年来,电化学作为一种绿色环保的策略而备受关注,同时具有高的氧化还原效率、可扩展性和电解过程的可持续性等特点。此外,通过阳极氧化方法已经实现C-C、C-O、C-N和C-S键的构建,并在动力学控制自由基反应性和相容性方面显示出明显的优势。然而,迄今为止尚未有报道涉及电化学脱氧功能化反应,主要是因为烷基在高电势下容易发生过度氧化形成碳正离子。尽管有文献提出草酸盐在电池条件下不相容,但重要的是,可设计一种醇衍生的自由基前体,该自由基前体可以在较低的氧化电位下引发反应。根据以前的文献报道,作者推测,将肼基引入到醇的羧酸酯上形成肼甲酸酯(carbazates),可改善的溶解度和反应性(Figure 1)。肼甲酸酯已被认为作为一种酰基自由的基前体,在铁催化的氧化条件下,肼甲酸酯会进行脱水酰化并释放出分子氮气。作者设想,如果在合适的电池条件下,可进一步发生阳极氧化脱羧,从而获得烷基自由基。在本文中,作者将肼甲酸酯描述为一种新型的电化学活化的烷基化剂,与杂芳烃进行氧化性脱水/脱羧后直接功能化反应。
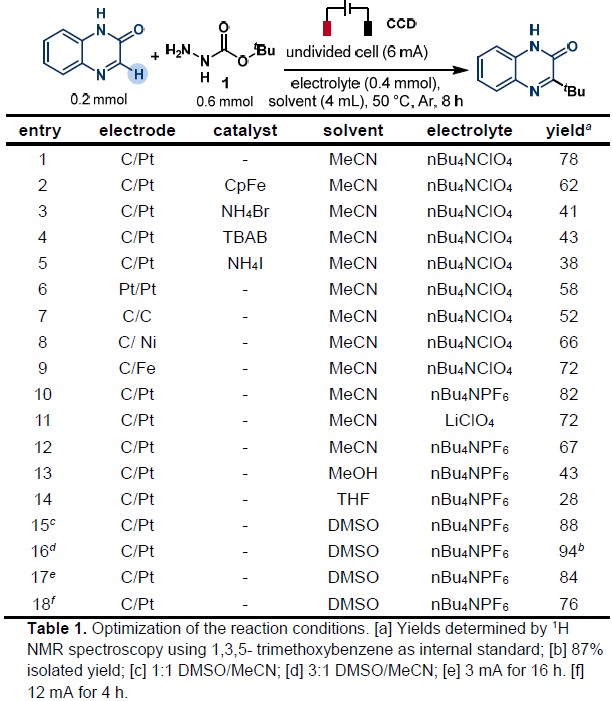
首先,作者以喹喔啉酮和肼甲酸叔丁酯1作为模型底物,进行相关电解条件的筛选(Table 1)。当使用铂/碳电极作为电极,n-BuNClO4作为电解质,在乙腈中以6 mA的恒定电流反应8h,获得78%收率的预期脱氧烷基化产物(entry 1)。紧接着,作者筛选了几种催化剂(CpFe、NH4Br、TBAB和NH4I),但收率都偏低(entries 2-5)。而对电极材料筛选中,作者发现,铂/碳电极收率远高于其他电极(entries 6-9)。对于不同的电解质筛选,n-Bu4NBF4能够以更高的产率获得产物(82%,entry10)。此外,溶剂对于该反应至关重要,当使用DMSO和MeCN的1:1混合液时,收率大幅提高(88%,entry 15),而将DMSO/MeCN的比例更改为3:1,可获得高达94%收率的产物(entry 16)。
获得上述最佳反应条件后,作者固定喹喔啉酮,对肼甲酸叔丁酯1进行了扩展(Scheme 1)。反应结果表明,带有支链(2–6)和环状烃(7–8)的叔烷基化肼基甲酸酯均与反应体系兼容。直链和环状仲醇衍生的肼基甲酸酯也被用于反应(9–13)。此外,四氢呋喃(14)、吡咯烷(15)、茚满(16)和二氟环己烷(17)取代的肼基甲酸酯均可获得相应高收率的烷基化喹喔啉酮产物。同时,对于天然产物冰片也可在氧化自由基偶联条件下与体系相容(18)。而对于伯醇衍生的肼基甲酸酯,如苄醇(19)、硫代苯基甲醇(20)、萘甲醇(21)和2-苯基乙醇(22),可能是由于伯酰基和苄基的相对惰性,仅获得获得中等收率的产物。
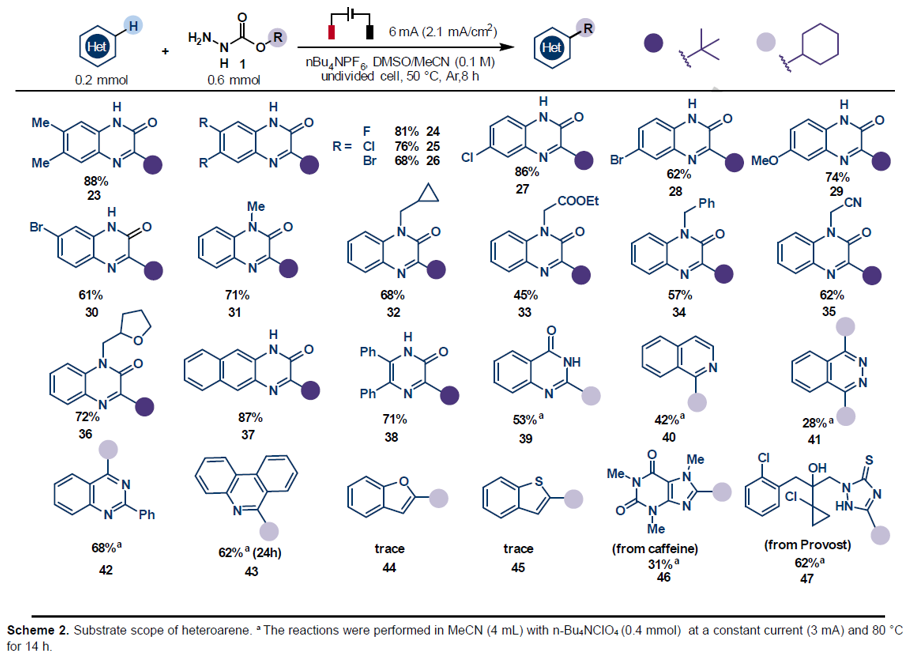
随后,作者对杂芳烃的底物范围进行了扩展(Scheme 2)。当含有给电子(23、29)和吸电子基团(24–28)取代的喹喔啉酮时,均可顺利反应,获得相应的烷基化产物。对于不同取代的N-保护喹喔啉酮(31–36),同样取得较好的结果。此外,各种杂环底物(如并喹喔啉酮(37)、吡嗪酮(38)、喹唑啉酮(39)、异喹啉(40)、酞嗪(41)、喹唑啉(42)和菲啶(43))同样获得预期的目标产物。然而,苯并呋喃(44)和苯并噻吩(45)底物与该反应体系不兼容。值得注意的是,生物活性分子咖啡因(caffeine)(46)和丙硫菌唑(Provost,47)也适用于该反应,进一步证明了该反应的实用性。
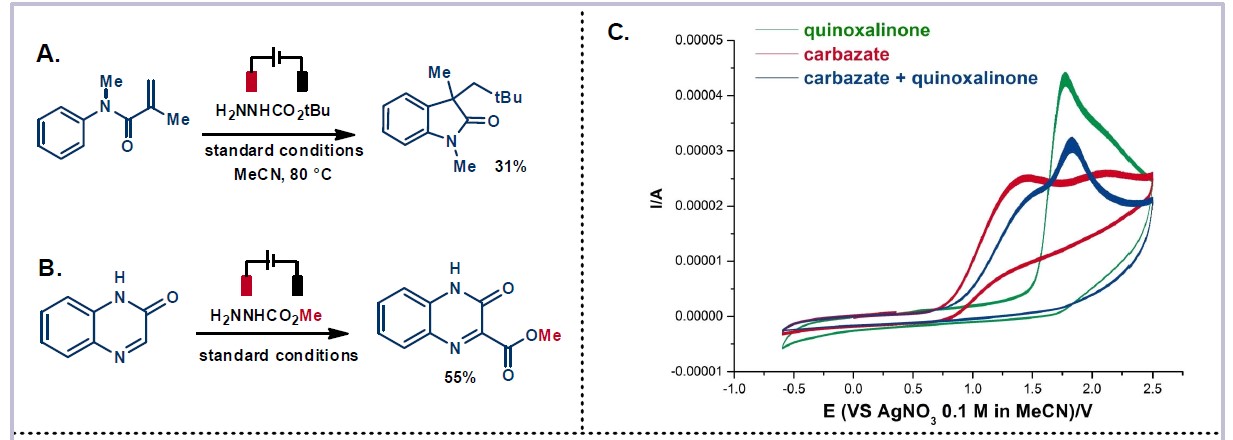
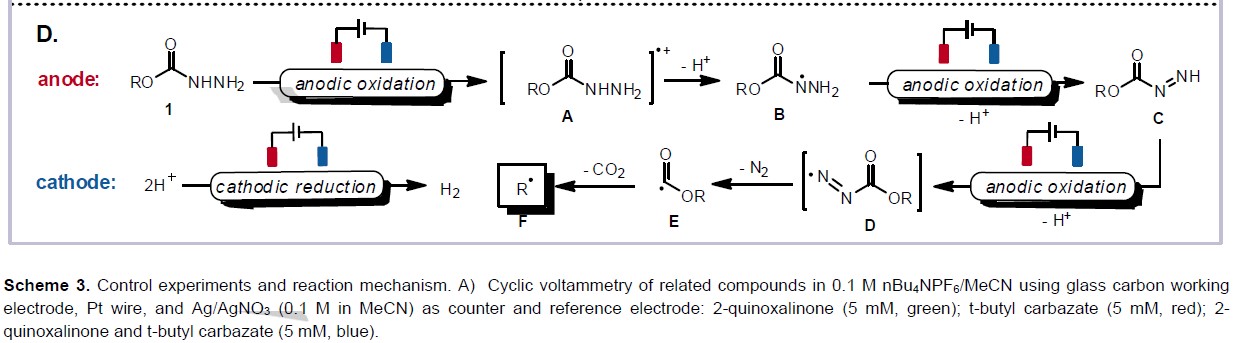
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。当使用N-苯基甲基丙烯酰胺作为底物时,在上述标准条件下进行反应,获得31%收率的烷基化羟吲哚产物(Scheme 3A)。而以肼基甲酸甲酯作为底物时,在标准条件下时,未观察到烷基化产物,仅获得甲酯产物(Scheme 3B)。这表明肼基甲酸乙酯的电化学裂解涉及脱水-脱羧过程。此外,循环伏安法的结果表明,在喹喔啉酮的脱氧烷基化电化学条件下(E1/2ox = 1.44 V vs AgNO3),肼基甲酸根很容易被氧化(Scheme 3C)。
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 6)。首先,肼基甲酸乙酯经阳极氧化和去质子化后生成肼甲酸根自由基B,再继续被阳极氧化后形成重氮羧酸根自由基C。随后,再被进一步的阳极氧化裂解二氮烯,形成酰基自由基E,并释放出分子氮气。最后,酰基自由基E经脱羧从而获得烷基自由基F(Scheme 3D)。
总结
南京大学潘毅教授课题组报道了,在温和的电解条件下,可将肼基甲酸酯作为一种新型的烷基化试剂,能够实现伯、仲和叔烷基经阳极氧化断裂后直接用于N-杂芳烃的官能化反应。此外,该方法避免化学氧化剂的使用,反应过程中仅释放氮气、二氧化碳和氢气,进一步体现了绿色环保的策略。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.