本文作者:Summer
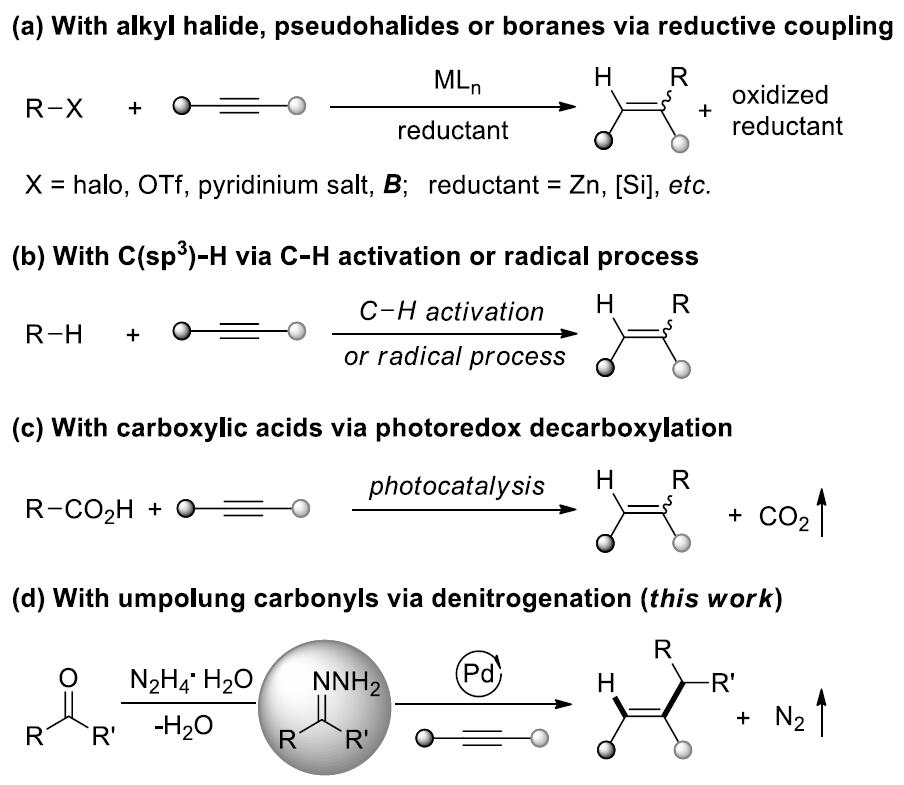
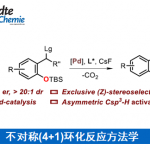
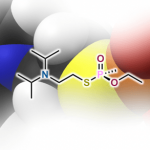
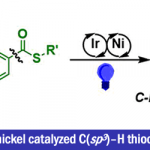
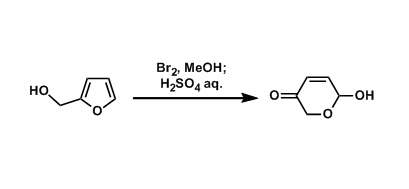
烯烃不仅可以作为化学反应中的中间体而且普遍存在于有机分子中,因此,开发有效的烯烃合成方法一直是化学家们关注的重点。过渡金属催化炔烃的氢烷基化反应是合成烯烃最简单有效的方法。例如,过渡金属可催化炔烃与卤代烷、类卤化物或硼烷发生氢烷基化反应[1](Scheme 1a);通过直接活化C-H键或自由基策略使炔烃发生C(sp3)-H键烯基化反应[2](Scheme 1b);最近,MacMillan和Rueping课题组报道的光催化羧酸与炔烃的脱羧氢烷基化反应[3](Scheme 1c)。这三种策略均可有效的将炔烃转化为烯烃,但这些策略都存在需要等当量的还原剂、有机金属试剂、氧化剂或直接基团以及烷基供体类型比较局限等问题。在上述研究背景的基础上,加拿大麦吉尔大学李朝军课题组 (李朝军教授介绍)报道了氮气条件下,新型Pd催化羰基极性翻转后作为新型烷基碳负离子等价物与炔烃发生顺式-氢烷基化反应,成功的克服了炔烃易聚合且未活化的炔烃难与亲核试剂发生直接加成反应等难题(Scheme 1d)。相关研究成果发表于
“Pd-Catalyzed Formal Hydroalkylation of Aryl-Substituted Alkynes with Hydrazones”
Yu, L.; Lv, L.; Qiu, Z.; Chen, Z.; Tan, Z.; Liang, Y.-F.; Li, C.-J.* Angew. Chem. Int. Ed. 2020, Accepted Article. DOI: 10.1002/anie.202005132
Scheme 1. 研究背景
论文概要
以腙1a和炔烃2a作为模板底物,作者对各种反应条件进行反复筛选,确定最佳条件为(Table 1):2.5 mol%[Pd(allyl)Cl]2和10 mol%PCy3为催化剂,DBU为碱,1,4-dioxane为溶剂,在110 oC条件下反应16 h,能以83%的收率和9:1的E/Z比得到相应产物3a。
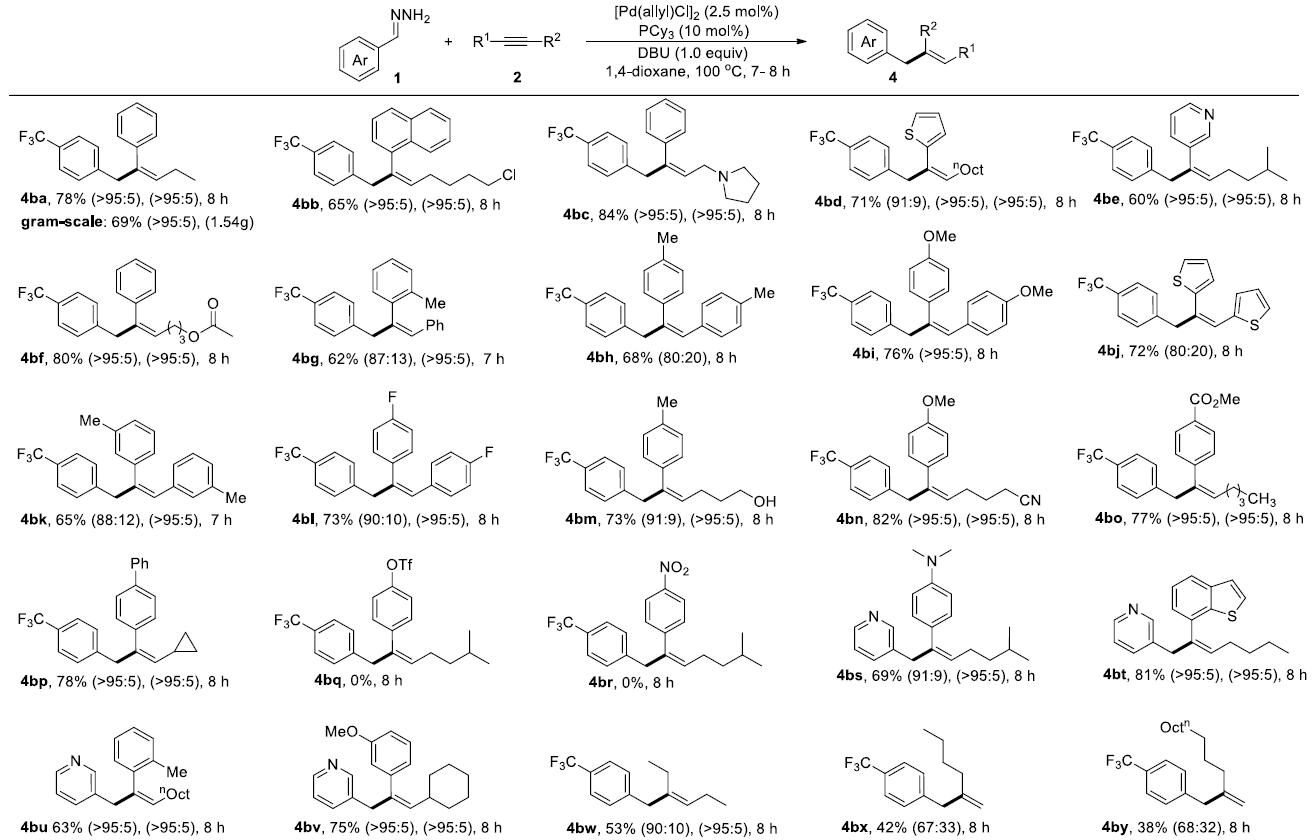
在最优反应条件下,作者对腙的底物范围进行了考察(Table 1)。各种吸电子取代或给电子取代的腙均能较好的适应反应条件,能以中等至良好的收率及E/Z比得到相应产物。其中,苯乙酮衍生的腙只能以50%的收率得到相应产物,但环己酮和丙酮衍生的腙则只能得到极少量的相应产物。
Table 1. 腙的底物扩展
接着,作者对炔的底物范围进行了考察(Table 2)。各种芳基取代、噻吩、吡啶等杂芳基取代的炔均能很好的适应反应条件,能以中等至良好的收率和E/Z比得到相应产物。但苯环对位为三氟甲磺酸酯或硝基取代的炔烃不能得到相应产物。
Table 2. 炔的底物扩展
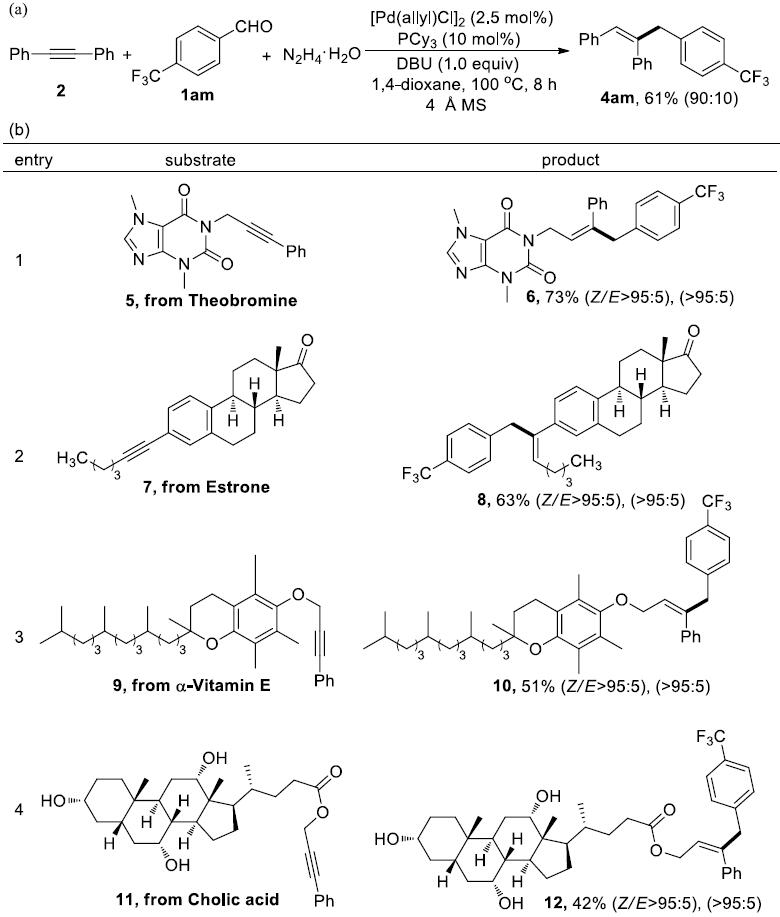
为了进一步证明反应的适用性,作者应用一锅法也可得到目标产物。在最优反应条件,一锅法反应也可很好地进行(Scheme 2a)。同时,作者构建了许多结构复杂的底物,应用该策略可将这些底物转化为具有重要药理活性的化合物(Scheme 2b)。
Scheme 2. 一锅法反应及应用
论文总结评价
加拿大麦吉尔大学李朝军课题组报道了氮气条件下,新型Pd催化羰基极性翻转后作为新型烷基碳负离子等价物与炔烃发生顺式-氢烷基化反应,能以良好的收率和优秀的区域选择性得到(Z)-烯烃产物。该策略成功的克服了炔烃易聚合且未活化的炔烃难与亲核试剂发生直接加成反应等难题,为炔烃的合成提供了一种新的高效方法。
参考文献
- [1] (a) Cheung, C.; Zhurkin, F. E.; Hu, X. J. Am. Chem. Soc. 2015, 137, 4932-4935; DOI: 10.1021/jacs.5b01784 (b) Lee, M. T.; Goodstein, M. B.; Lalic, G. J. Am. Chem. Soc. 2019, 141, 17086-17091. DOI: 10.1021/jacs.9b09336 (c) Lu, X.-Y.; Liu, J.-H.; Lu, X.; Zhang, Z.-Q.; Gong, T.-J.; Xiao, B.; Fu, Y. Chem. Commun. 2016, 52, 5324-5327. DOI: 10.1039/C6CC00176A (d) Zhu, Z.-F.; Tu, J.-L.; Liu, F. Chem. Commun. 2019, 55, 11478-11481. DOI: 10.1039/C9CC05385A
- [2] Deng, H.-P.; Fan, X.-Z.; Chen, Z.-H.; Xu ,Q.-H.; Wu, J. Am. Chem. Soc. 2017, 139, 13579-13584. DOI: 10.1021/jacs.7b08158
- [3] (a) Till, N. A.; Smith, R. T.; MacMillan, D. W. C. J. Am. Chem. Soc. 2018, 140, 5701-5705. DOI: 10.1021/jacs.8b02834 (b) Yue, H.; Zhu, C.; Kancherla, R.; Liu, F.; Rueping, M. Angew. Chem. Int. Ed. 2020, 59, 5738-5746. DOI: 10.1002/anie.201914061
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.