概要
Caglioti反应 (Caglioti reaction)是将醛、酮或与其相对应的对甲苯磺酰腙在氢化物 (如NaBH4, LiAlH4, NaBH3CN, B2H6等)作用下,生成烷烃或烯烃 (对于α, β-不饱和醛及酮)的反应,又称为Caglioti还原 (Caglioti reduction)或Caglioti烯烃合成 (Caglioti alkene synthesis) [1]-[6]。
该反应由意大利通用化学研究所 (Istituto di Chimica Generale)的L. Caglioti在1962年首次报道[1]。该方法中,目标产物烷烃 (可作为Wolff-Kishner还原, Wolff-Kishner还原Huang-Minlon改进法及Clemmensen还原的有效替代方法)或烯烃产物产率良好。然而,反应条件较为苛刻,例如,在采用硼烷/乙酸酐体系时,反应相依十分严格的无水无氧条件,而且,还原剂用量较大,在反应过程中会使部分底物出现较多的副反应[3]。另外,采用氢化铝锂时,反应过程中,化学选择性及官能团兼容性可能较差,底物适用范围较为有限[7]。
为解决这些问题,1975年Kabalka课题组研究发现,采用儿茶酚硼烷 (catecholborane),能够使反应条件更加温和,试剂用量及副反应大为减少。同时,具有更加优良的产率及官能团兼容性[8]-[9]。文献中将这种改进的Caglioti反应称为Kabalka改进法 (Kabalka modification)。
目前,该反应已成为有机合成过程中引入烷烃或烯烃单元的有效方法,在复杂有机分子合成设计及天然产物全合成过程中有潜在的应用价值[10]-[12]。
基本文献
- [1] L. Caglioti, M. Magi, Tetrahedron Lett. 1962, 18, 1261. doi: 10.1016/S0040-4039(00)62045-2..
- [2] L. Caglioti, M. Magi, Tetrahedron 1963, 19, 1127. doi: 10.1016/S0040-4020(01)98571-0.
- [3] R. C. Cambie, P. S. Rutledge, D. W. Scott, P. D. Woodgate, Aust. J. Chem. 1979, 32, 695. doi: 10.1071/CH9790695.
- [4] R. O. Hutchins, C. A. Milewski, B. E. Maryanoff, J. Am. Chem. Soc. 1973, 95, 3662. doi: 10.1021/ja00792a033.
- [5] R. O. Hutchins, B. E. Maryanoff, C. A. Milewski, J. Am. Chem. Soc. 1971, 93, 1793. doi: 10.1021/ja00736a044.
- [6] S. Cacchi, L. Caglioti, G. Paolucci, Bull. Chem. Soc. Jpn.1974, 47, 2323. doi: 10.1246/bcsj.47.2323.
- [7] R. Ballini, M. Petrini, G. Rosini, J. Org. Chem. 1990, 55, 5159. doi: 10.1021/jo00304a032.
- [8] G. W. Kabalka, J. D. Baker Jr, J. Org. Chem. 1975, 40, 1834. doi: 10.1021/jo00900a033.
- [9] G. W. Kabalka, D. T. C. Yang, J. D. Baker, J. Org. Chem. 1976, 41, 574. doi: 10.1021/jo00865a043.
- [10] P. Camps, G. Colet, S. Segura, S. Vázquez, ARKIVOC 2007, (iv) 8. doi: 10.3998/ark.5550190.0008.402.
- [11] F. Y. Edamura, A. Nickon, J. Org. Chem. 1970, 35, 1509. doi: 10.1021/jo00830a055.
- [12] Y. D. Boyko, C. J. Huck, D. Sarlah, J. Am. Chem. Soc. 2019, 141, 14131. doi: 10.1021/jacs.9b08487.
反应机理
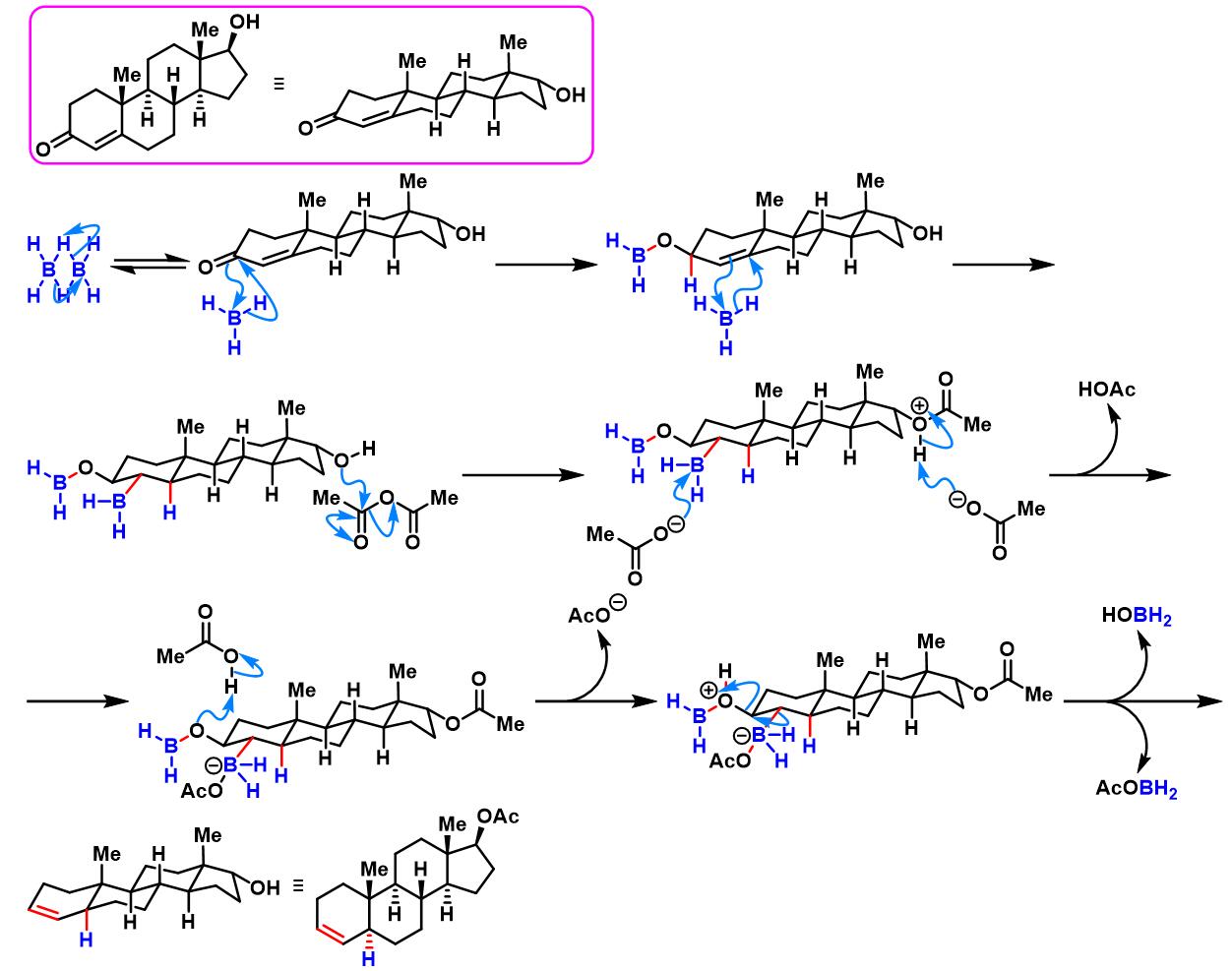
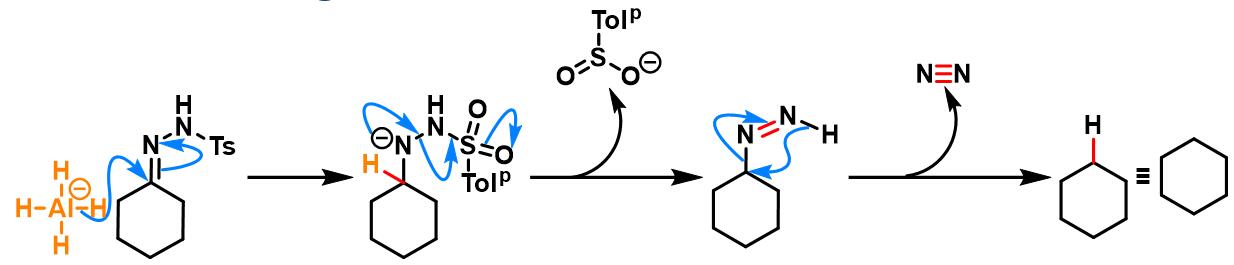
硼烷参与的Caglioti反应
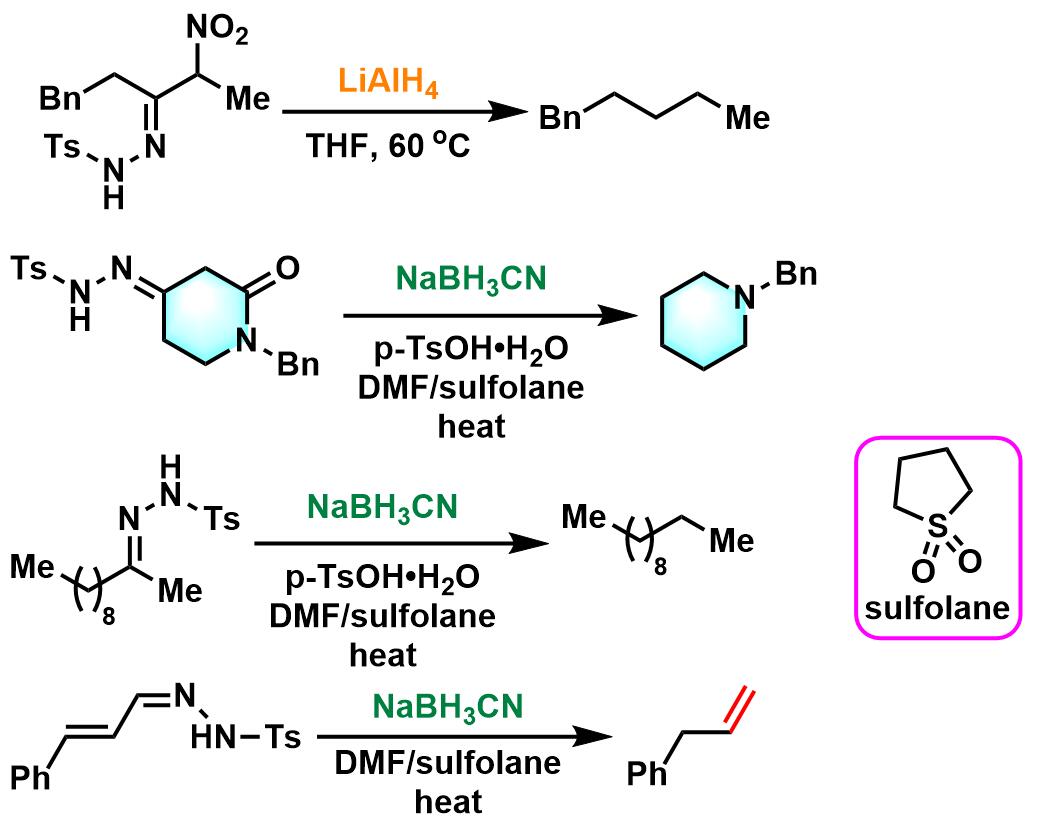
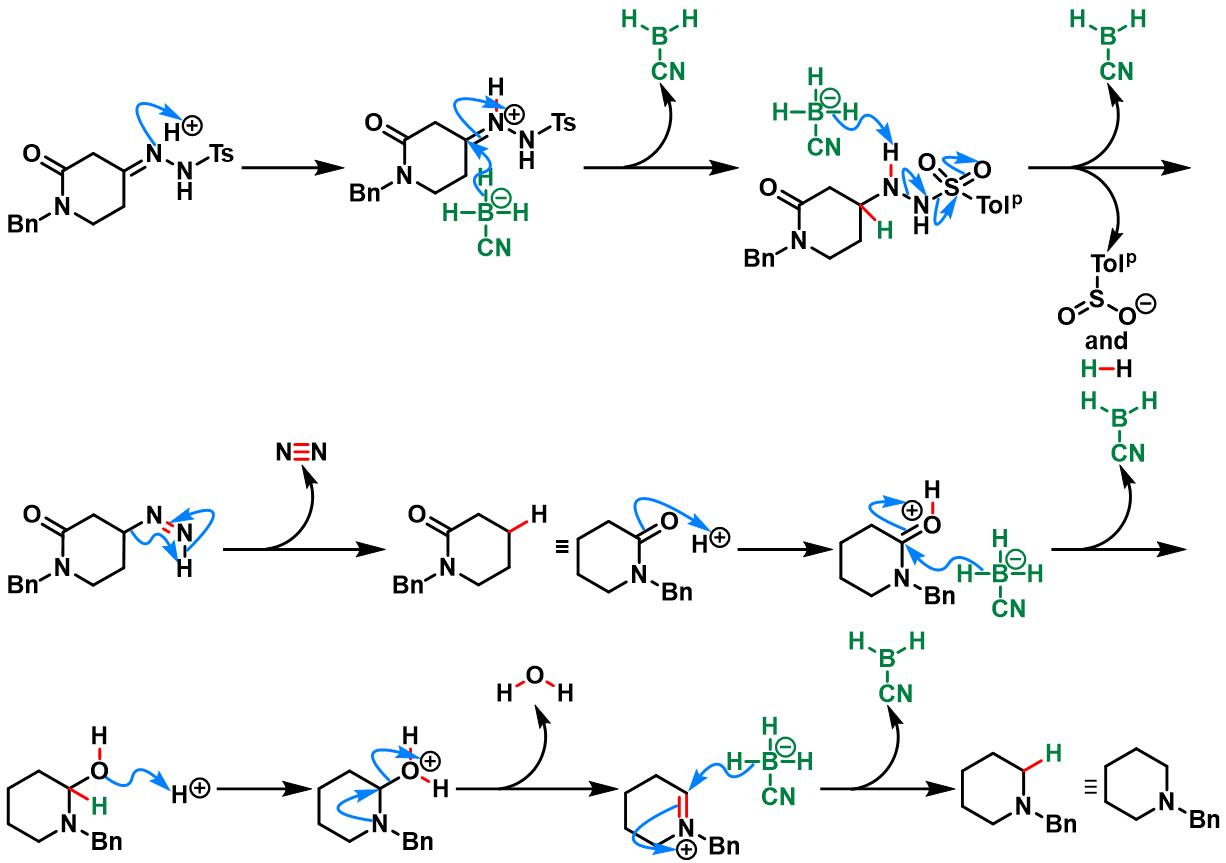
LiAlH4参与的Caglioti反应
NaBH3CN参与的Caglioti反应
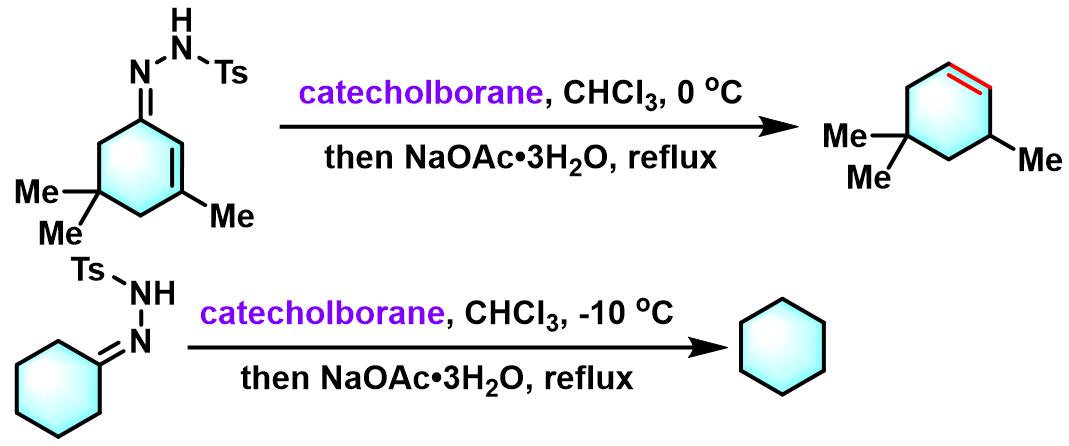
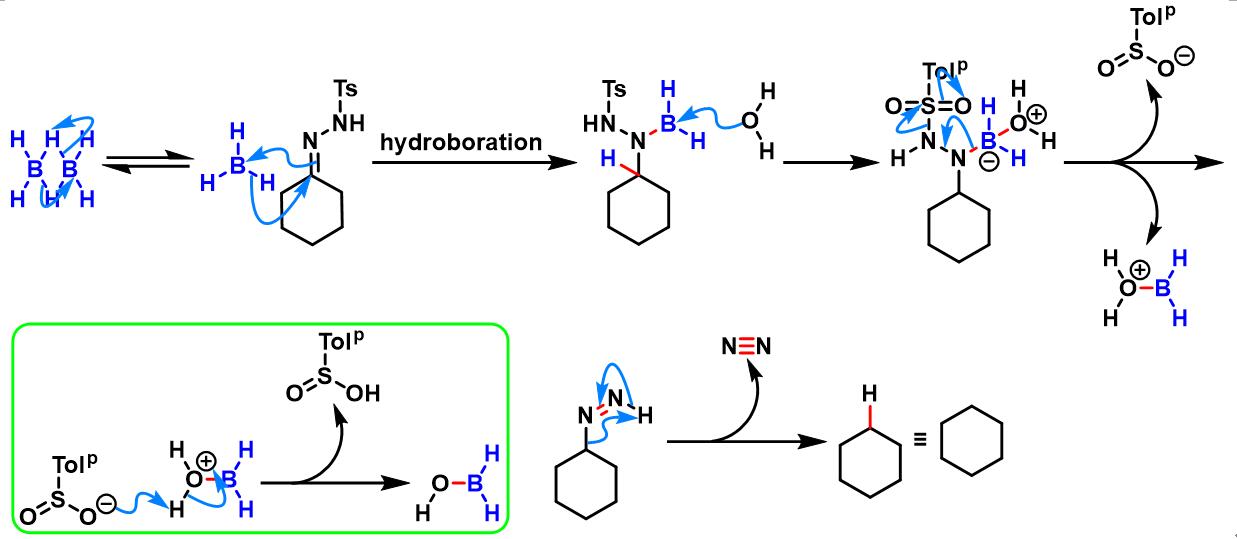
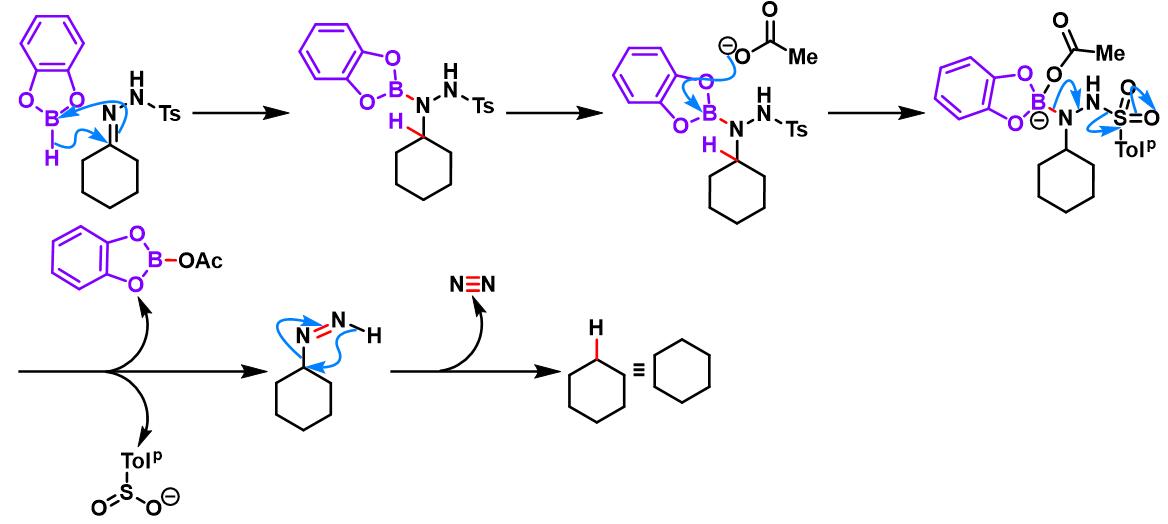
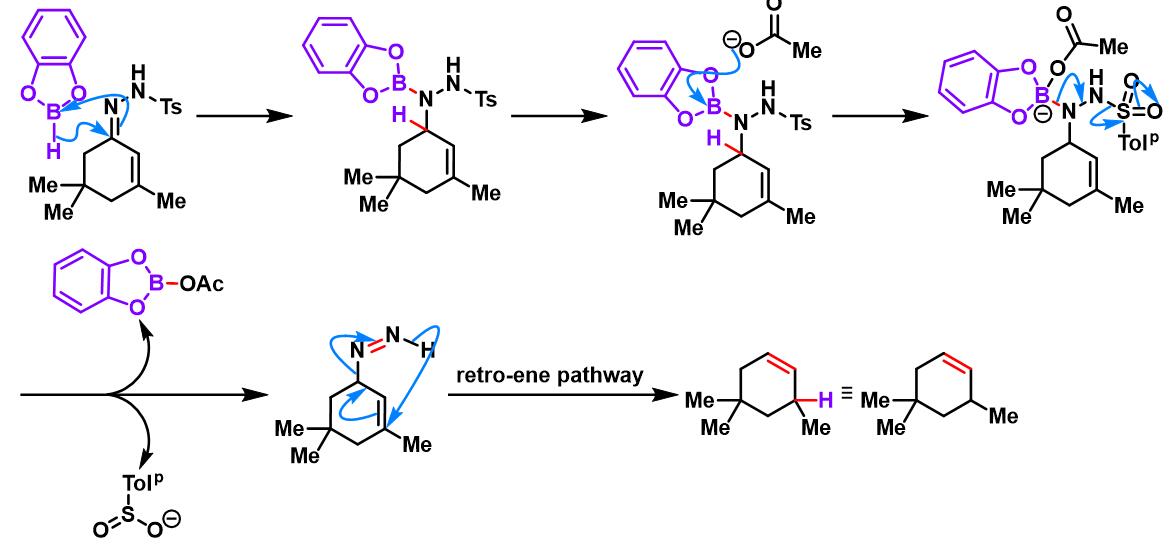
儿茶酚硼烷参与的Caglioti反应
参考文献
- [1] C. F. Lane, Chem. Rev. 1976, 76, 773. doi: 10.1021/cr60304a005.
- [2] L. Caglioti, Tetrahedron 1966, 22, 487. doi: 10.1016/0040-4020(66)80015-7.
- [3] G. W. Kabalka, J. D. Baker Jr, J. Org. Chem. 1975, 40, 1834. doi: 10.1021/jo00900a033.
- [4] E. J. Taylor, C. Djerassi, J. Am. Chem. Soc. 1976, 98, 2275. doi: 10.1021/ja00424a046.
反应实例
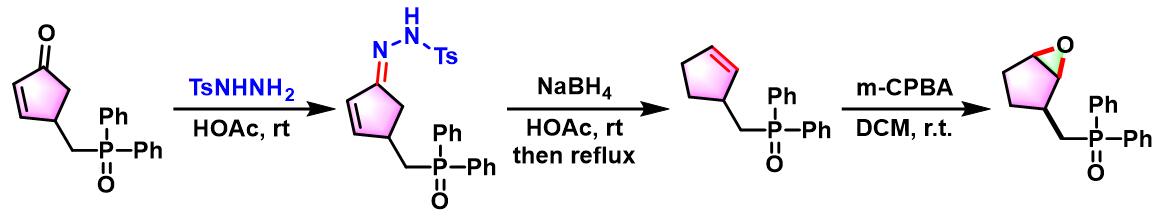
cyclopentane phosphine oxides的合成[1]
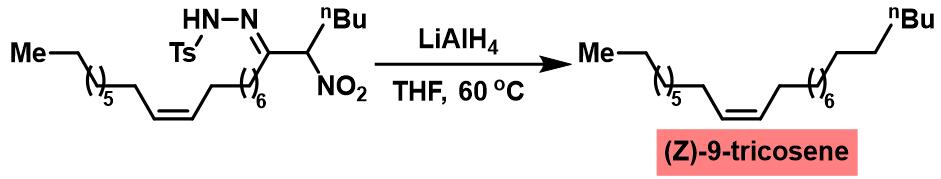
(Z)-9-tricosene的合成[2]
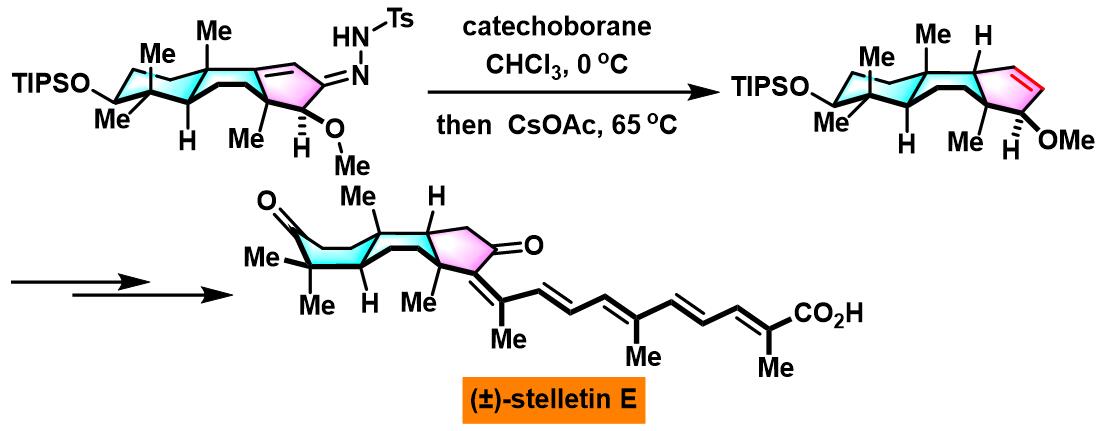
(±)-stelletin E的全合成[3]
实验步骤
硼烷参与的Caglioti反应
将对甲苯磺酰腙底物 (1eq.)与硼氢化钠 (16.7 eq.)放入连接有恒压滴液漏斗及冷凝管的三口烧瓶中,通过双排管抽真空-氮气置换三次。再加入脱气的二乙二醇二甲醚 (底物浓度为0.07 M)溶解。通过cannula向恒压滴液漏斗内加入三氟化硼-乙醚配合物。之后,开启恒压滴液漏斗下端活塞,将三氟化硼-乙醚配合物缓慢滴加至上述混合物中。将上述反应混合物搅拌过夜。再通过恒压滴液漏斗加入乙酸酐 (90.6 eq.),加热回流,直至反应结束。反应结束后,将反应液倒入冰水中,再加入乙醚进行萃取。将合并的有机相依次加入10%氢氧化钠溶液及水进行洗涤,随后,加入无水硫酸钠进行干燥。减压除去溶剂后,将残余固体通过甲醇重结晶进行纯化,获得最终目标产物。
NaBH3CN参与的Caglioti反应
将对甲苯磺酰腙底物 (1eq.)加入含有少量对甲苯磺酸 (0.15eq.)的DMF与环丁砜混合溶剂 (底物浓度为0.2 M)溶解,再加入氰基硼氢化钠 (4 eq.)及适量环己烷。将上述反应混合物在100-105 oC下加热,直至反应结束。反应结束后,将反应液加入适量水进行稀释,再加入环己烷进行萃取。将合并的有机相加入水进行洗涤,随后,加入无水硫酸钠进行干燥。减压除去溶剂后,将残余物在真空条件下进行蒸馏纯化,获得最终目标产物。
LiAlH4参与的Caglioti反应
在0 oC,氮气气氛下,向对甲苯磺酰腙底物 (1eq.) 的无水四氢呋喃溶液 (底物浓度为0.13 M)中缓慢滴加氢化铝锂 (3eq.)的无水四氢呋喃溶液 (氢化铝锂浓度为0.26 M)。滴加完成后,将上述反应混合物在60oC下加热,直至反应结束。反应结束后,将反应液冷却至室温,依次加入适量冷水进行稀释,再加入2 M 盐酸酸化后,加入正戊烷进行萃取。将合并的有机相采用无水硫酸钠进行干燥。减压除去溶剂后,再将残余物通过短硅胶柱纯化 (正戊烷/戊苯作为洗脱剂),获得最终目标产物。
儿茶酚硼烷参与的Caglioti反应
在0 oC,氮气气氛下,用注射器向对甲苯磺酰腙底物 (1eq.) 的三氯甲烷溶液 (底物浓度为0.42 M)中加入儿茶酚硼烷 (1.1 eq.),再加入乙酸钠或乙酸铯 (3eq.)。将上述反应混合物进行加热回流,直至反应结束。反应结束后,将反应液冷却至室温,首先,加入适量冷水进行稀释,再加入三氯甲烷进行萃取。将合并的有机相采用无水硫酸钠干燥。减压除去溶剂后,将残余物通过硅胶柱色谱纯化,获得最终目标产物。
参考文献
- [1] P. Camps, G. Colet, S. Segura, S. Vázquez, ARKIVOC 2007, (iv) 8. doi: 10.3998/ark.5550190.0008.402.
- [2] R. Ballini, M. Petrini, G. Rosini, J. Org. Chem. 1990, 55, 5159. doi: 10.1021/jo00304a032.
- [3] Y. D. Boyko, C. J. Huck, D. Sarlah, J. Am. Chem. Soc. 2019, 141, 14131. doi: 10.1021/jacs.9b08487.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.