投稿作者:LiWen Xia
概要
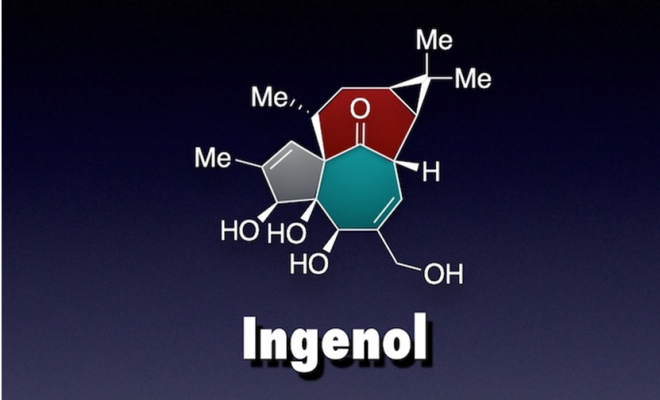
高度氧化的萜类化合物广泛应用于临床治疗当中,包括具有抗癌活性的Taxol,治疗免疫疾病的肾上腺激素和抗疟疾的青蒿素等。具有这些复杂结构的萜类化合物常常是从天然产物或者植物细胞培养中提取分离来供应市场需求。为了证明精简高效的合成方法能够解决这些结构复杂的萜类化合物的合成,Phil S.Baran等人应LEO Pharma的请求[1],14步高效合成ingenol和克级制备具有基本骨架的中间体8。
合成构想
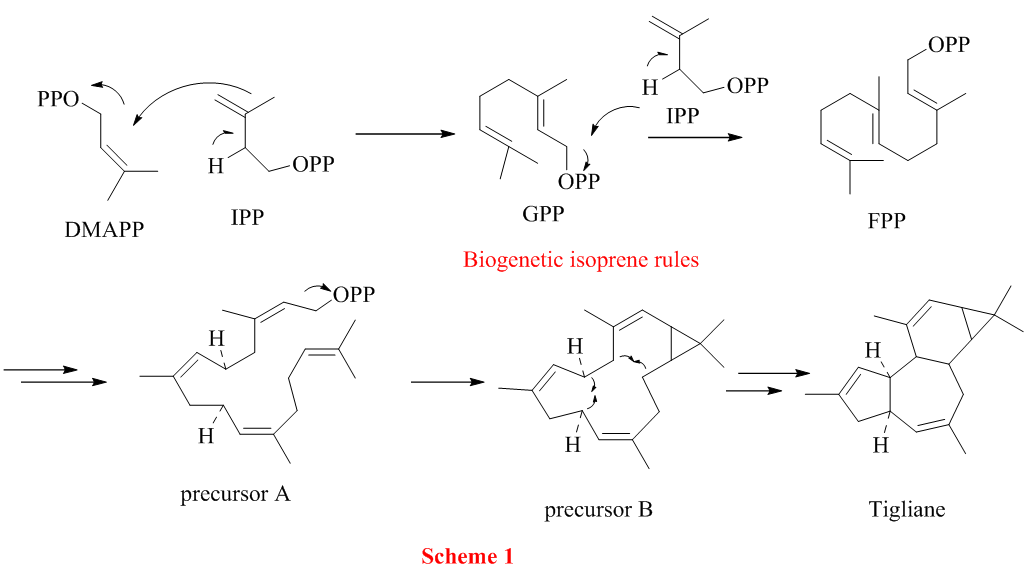
从ingenol结构骨架看出,ingenol是由四分子异戊二烯磷酸酯前体(trateprenyl pyrophosphate precursor)通过植物体内生源的异戊二烯法则(biogenetic isoprene rule)”头-尾”顺序(head-tail cyclization)衍生得到。
两分子的异戊二烯酯结合生成焦磷酸金合欢酯(FPP),再经过数步同样的步骤转化得 precursor A,脱焦磷酸酯OPP生成precursor B。 分子内环化生成巴豆萜烷(Tigliane)。
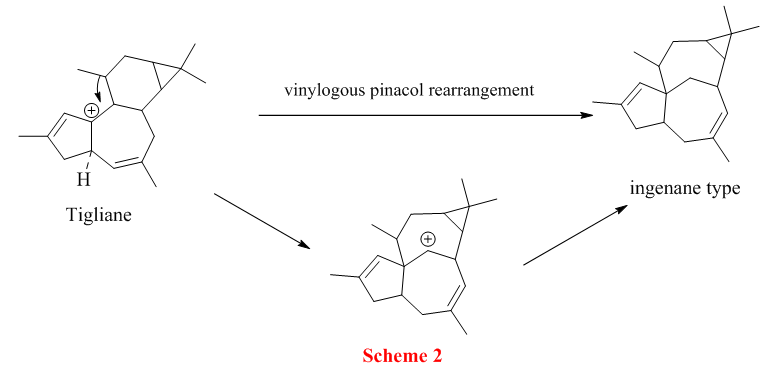
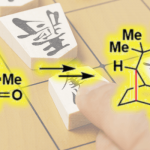
植物体内的巴豆萜烷(tigliane)在酶的作用下通过vinylogous pinacol 重排转化成 ingenane 萜烷(Scheme 1)。
所以从上述的生物体内转化,Phil.S.Baran预测ingenane萜烷的合成可以通过巴豆萜烷转化过来(Scheme 2)。
至此,Phil.S.Baran的构想就很清楚了,其逆合成如下:先完成tigliane萜烷骨架的搭建,巴豆萜类的五元环并七元环可以通过分子内炔键和丙二烯Pauson-Khand环化而成,而此反应早有报道[3]。中间体A就可以从廉价易得的原料carene大量制备。整个路线下路不但简洁,而且能大量制备ingenane这种稀缺的萜烷。
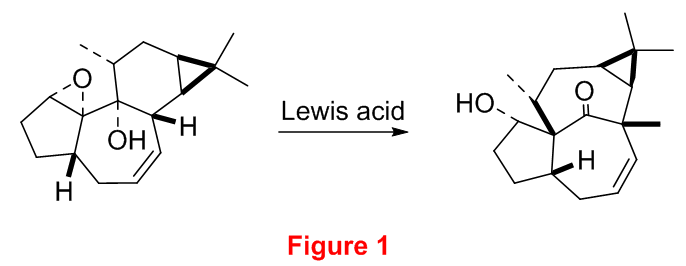
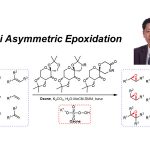
对于分子内的vinylogous pinacol rearrangement的问题,Baran参考Cha jin Kun等人的研究工作预想巴豆萜烷的间烯pinacol重排。 Cha jin Kun[2]利用Lewis acid 对环氧开环使得重排能够顺利发生(Figure 1)。
内容介绍
其合成过程分为两个阶段,即环化阶段和氧化重排阶段(Figure 2 A and B)。
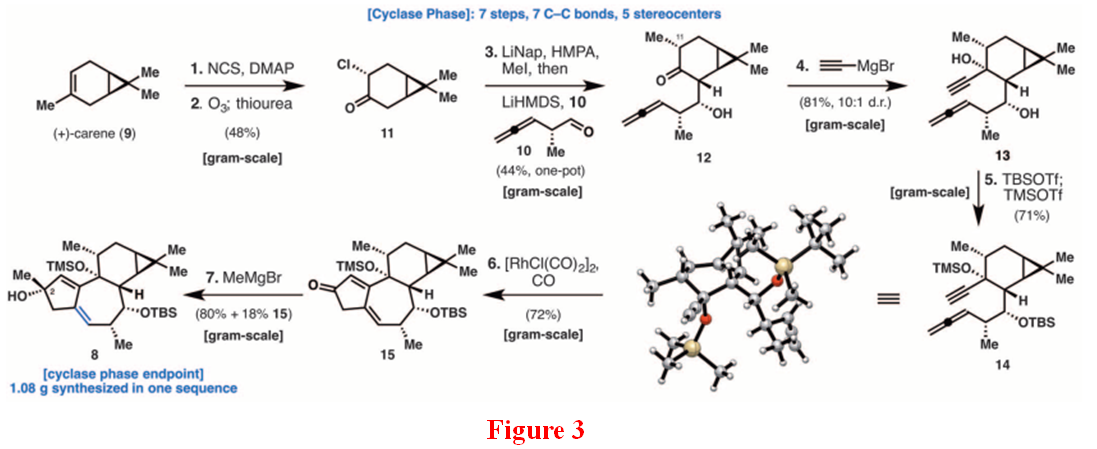
在环化阶段中,环化酶完成基本骨架三并环的合成。在Phil S.Baran路线设计中,以(+)-carene为原料,应用Pauson-Khand 丙二烯环化完成其环系的构建,从而搭建ingenol基本骨架 (Figure 3)。
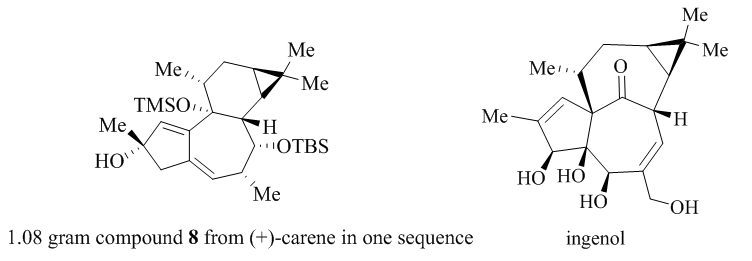
从商业可得原料(+)-carene($10.20/mol)出发,NCS/DMAP氯代,臭氧断裂双键得到α-氯代酮11,LiNap自由基还原断裂C-Cl键形成α位甲基化,得到的产物不稳定,易和一些溶剂形成共沸。所以作者做完甲基化后直接蒸除碘甲烷进行后一步Aldol反应。得到丙二烯化合物12后乙炔格式试剂亲核取代酮,TBS保护醇羟基后得到Pauson-Khand前体。利用Brummond等人[3]改善的Pauson-Khand条件,在10 mol%[RhCl(CO)2]2,CO气氛环境下,高度稀释得到环化产物15。甲基格式试剂加成完成1.08g克级制备化合物8。
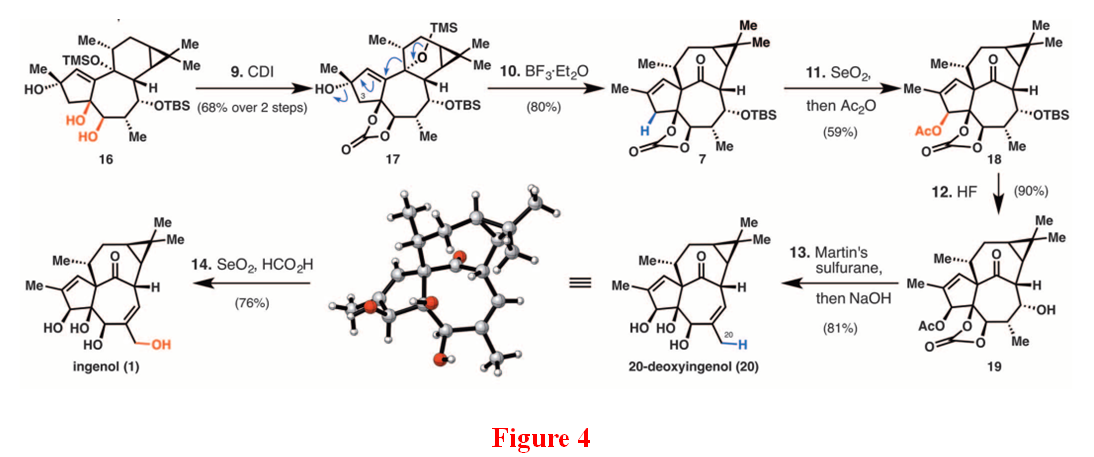
在氧化重排阶段(Figure 4),起初作者双羟化化合物8并没有成功,要么是不反应,要么是氧化过头。后来发现用化学计量的OsO4能实现100mg的底物双羟化。CDI保护双羟基得重排前体。在重排阶段,作者利用1,2-pinacol rearrangement完成环系重排。作者发现此重排反应对于温度有着苛刻的要求:底物溶于二氯甲烷,-78℃下加入BF3·Et2O,降至-40℃加入甲醇和三乙胺猝灭反应制备191mg Ingenane 7。C-3位置用SeO2烯丙位氧化羟基并乙酰基保护,HF脱TBS的82mg醇19。Martin硫试剂脱羟基成烯,Wood条件下[4]烯丙位氧化制备出10mg ingenol。
后记
至此,作者通过14步,总收率1.2%完成ingenol的合成,平均每步收率为73%,可见作者实验功底深厚。对比天然产物分离效果1.1mg/kg[0.0011%w/w],合成的效率275mg/kg[0.028%w/w]远高于此,这也许有时候体现出天然产物分离的不足吧,作者在文章也调侃了一番。作者结合生源假设的设想,高效简洁的构建ingenol骨架,完成这件复杂的艺术品。这些方法也可以为以后化学家在设计复杂的药用分子时提供很好的借鉴。
参考文献
- Lars Jorgensen, Steven J. Mckerrall, Christian A.Kuttruff, Felix Ungeheuer, Jakob Felding, Phil S. Baran. Science, 341, 878. DOI: 10.1126/science.1241606
- Oleg L. Epstein, Jin Kun Cha. Angew. Chem. Int. Ed. 2005, 44, 121-123. DOI: 10.1002/anie.200461807
- Key M.Brummond, Hongfeng Chen, Kimberly D.Fisher, Angela D.Kerekes, Brenden Richards, Peter C.Sill, and Steven J. Geib., Org. Lett., 2002, 4(11), 1931-1934. DOI: 10.1021/ol025955w
- Andrew Nichkel, Toru Maruyama, Haifeng Tang, Prescott D. Murphy, Blake Greene, Naeem Yusuff, and John L. Wood. , JACS, 2004, 126,16300-16301. DOI: 10.1021/ja044123I
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.