背景研究
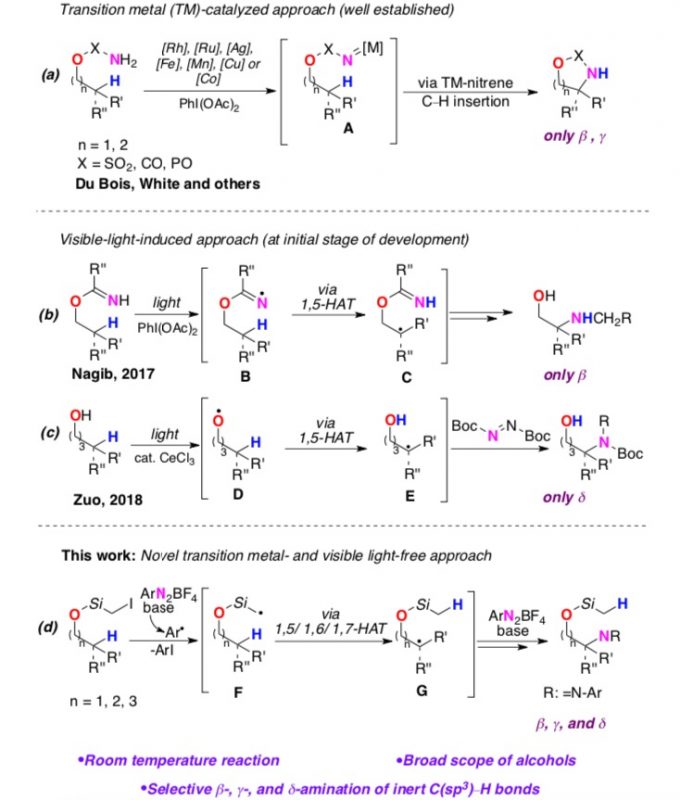
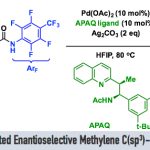
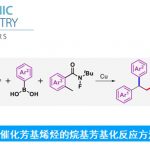
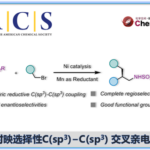
氨基醇骨架广泛存在于各种天然产物、具有药理活性的化合物中。而合成该骨架最有力的策略即脂肪醇发生定向位点选择性C(sp3)-H胺化反应。其中,比较经典的方法即将过渡金属-氮化物中间体A插入到远端未活化的C(sp3)-H键中(Scheme 1,a),但该方法仅局限于γ和β-位官能团化。最近,能在温和条件下产生自由基且具有多样的HAT反应性的自由基反应引起化学团体的广泛关注。迄今为止,基于自由基策略,脂肪醇发生远端位点选择性C(sp3)-H胺化反应的报道只有两例:Nagib课题组[1]报道的无需金属催化的可见光诱导醇的自由基反应,合成β-氨基醇化合物(Scheme 1, b)以及Zuo课题组[2]报道的可见光诱导合成δ-氨基醇化合物的自由基反应(Scheme 1, c)。这两例自由基反应主要局限于1,5-HAT自由基,这极大地限制了自由基反应的范围。在上述背景研究的基础上,美国伊利诺伊大学Vladimir Gevorgyan课题组报道了第一例无需金属催化和光催化,在温和的碱性条件和重氮盐作用下,脂肪醇的β-、γ-和δ-C(sp3)-H胺化反应(Scheme 1, d)。相关研究成果发表于
Transition Metal-and Ligh-free Directed Amination of Remote UnactivatedC(sp3)-H Bonds of Alcohols
Kurandinaà, D.; Yadagirià, D.; Rivasà, M.; Kavun, A.; Chuentragool, P.; Hayama, K.; Gevorgyan, V. * J. Am. Chem. Soc. 2019, Just Accepted Manuscript
DOI: 10.1021/jacs.9b04189
Scheme 1.醇的远程C-H胺化反应
论文作者介绍:
研究者:Vladimir Gevorgyan
研究者经历
- 1978 Kuban State University 毕业
- 1984 Latvian Institute of Organic Synthesis 博士学位
- 1986-1991 Latvian Institute of Organic Synthesis Group leader
- 1992-1994 日本东北大学 博士后研究员
- 1995 CNR, Bologna 客座教授
- 1996 日本东北大学 助理教授
- 1997-1999 日本东北大学 副教授
- 1999-2003 伊利诺伊大学芝加哥分校 副教授
- 2003至今 伊利诺伊大学芝加哥分校 教授
获奖经历
- 2008 UIC Researcher of the Year
- 2012 Honorary Professor of St. Petersburg State University
- 2012 Distinguished Professor of Liberal Arts and Sciences
- 2012 University Scholar (University of Illinois)
- 2014 Visiting Professor, Sorbonne Universities, Paris
- 2015 Lilly Lectureship at Imperial College London
- 2016 Foreign Member of Latvian Academy of Sciences
研究概要
催化合成法的开发,C-H键活化,环化异构化反应,以及在复杂化合物合成方面的应用研究。
Gevorgyan课题组一直在开发基本的催化方法并探索其在广泛合成中的应用,他们侧重点在机理探究来获得控制化学、立体选择过程的灵感。深入理解反应的机理来使他们更好地确定最好方案,并拓展新反应的适用范围。
论文概要:
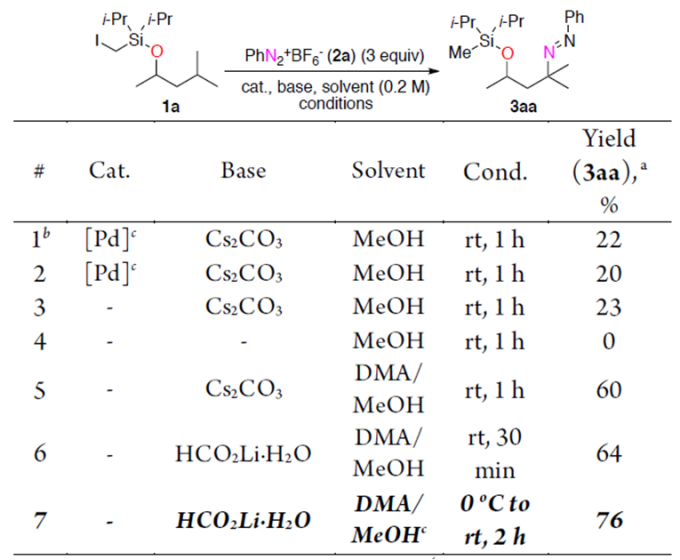
以1a和2a为模板底物,作者对反应条件进行反复筛选,确定最佳条件为(Table 1):5 equiv HCO2Li·H2O为最优碱,DMA/MeOH(1:1)为最优溶剂,在0 ℃到室温条件下反应2 h,能以76%的收率得到目标产物。
Table 1. 条件优化
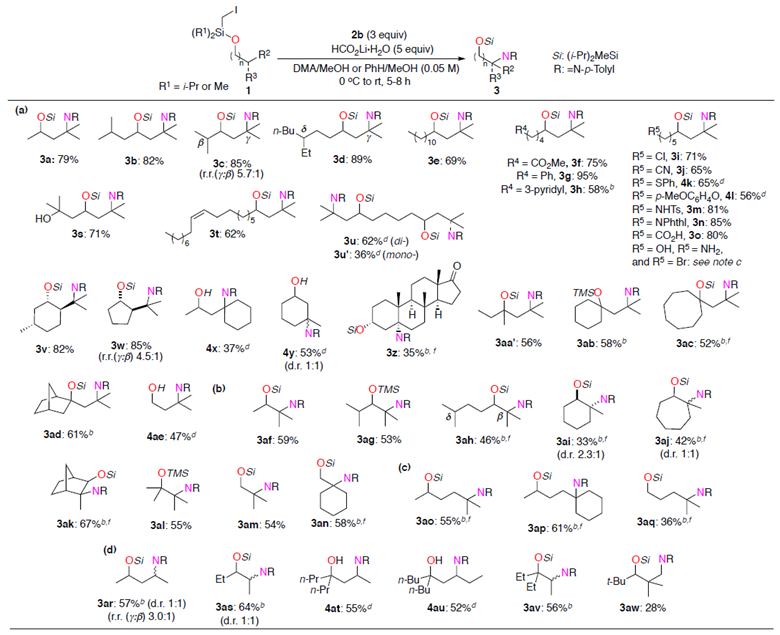
在最优反应条件下,作者考察了重氮盐的底物范围。不论是吸电子取代还是给电子取代的重氮盐都能很好地适应反应条件,可以良好至优秀的收率得到相应产物。其中,1a与2b反应,能以86%的收率得到相应产物。
紧接着,作者考察了1和2b的反应情况。对于大部分γ位为叔碳手性中心的底物都能很好的适应反应条件,能以良好至优秀的收率得到γ-C(sp3)-H胺化产物,但R5位为伯醇、胺或溴化物的底物则不能得到相应产物(Scheme 2, a)。此外,仲醇、环醇、双环醇、叔醇以及伯醇均能以较高的收率得到动力学不太支持的β-C(sp3)-H胺化产物(Scheme 2, b)。仲醇(1ao, 1ap)和伯醇(1aq)能得到 δ和γ-C(sp3)-H胺化产物的混合物。2o C−H和1o C−H也能适应反应条件,能以较高的收率得到β-和γ-C(sp3)-H胺化产物。
Scheme 2.底物扩展
为了证明该反应的潜在价值,作者做了一系列的衍生反应。各种叔环产物和非环状产物都能以较高的收率转化为的1,2-,1,3-和1,4-氨基醇。值得高兴的是,二级重氮化合物容易异构成腙进而被氧化为酮类化合物。酮类化合物可被转化为不易获得的丁间醇醛。
论文总结评价:
美国伊利诺伊大学Vladimir Gevorgyan课题组报道了第一例无需金属催化和光催化,在温和的碱性条件和重氮盐作用下,脂肪醇的β-、γ-和δ-C(sp3)-H胺化反应。该反应底物范围广,能以较高的收率得到各种β-、γ-和δ-C(sp3)-H胺化产物。通过简单的衍生反应,可以高收率得到1,2-,1,3-和1,4-氨基醇和酮类化合物。
参考文献:
- (a) Wappes, E. A.; Nakafuku, K. M.; Nagib, D. A. Am. Chem. Soc.2017,139, 10204.DOI: 10.1021/jacs.7b05214(b) Stateman, L. M.; Wappes, E. A.;Nakafuku, K. M.; Edwards, K. M.; Nagib, D. Chem. Sci. 2019, 10, 2693. DOI:10.1039/c8sc05685d
- Hu, A.; Guo, J.-J.; Pan, H.; Tang, H.; Gao, Z.; Zuo, Z. Am. Chem. Soc. 2018, 140, 1612. DOI:10.1021/jacs.6b06908
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.