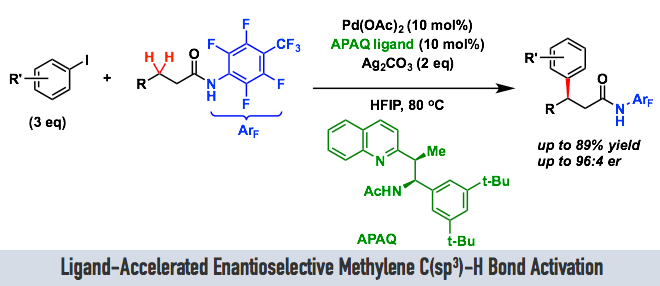
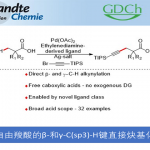
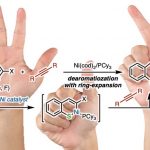
Scripps研究所的余金权教授最近成功开发了一种新型的不对称双齿配体APAQ,通过他擅长的钯催化反应,成功开发出了惰性亚甲基碳的C(sp3)-H键的选择性活性化反应,该反应获得了具有高位置选择与不对称选择与高产率三高的良好结果。而其中至关重要的配体APAQ对反应的加速效果是成功的关键。
“Ligand-Accelerated Enantioselective Methylene C(sp3)-H Bond Activation”
Chen, G.; Gong, W.; Zhuang, Z.; Andrea, M. S.; Chen, Y.-Q.; Hong, X.; Yang, Y.-F.; Liu, T.; Houk, K. N.*; Yu, J.-Q.* Science 2016, 353, 1023. DOI: 10.1126/science.aaf4434
问题设定与解决的point
亚甲基碳上的潜手性惰性C(sp3)-H键的选择性活化一直以来是方法学领域的一个难题。在现有报道的文献中,还局限于卡宾/氮宾对亚甲基的插入反应,非对称化反应,高反应性的环丙烷,环丁烷等特殊底物的亚甲基的活化反应,而通过形成碳-金属键中间体的一般形式的金属催化反应的例子还未有突破。
本论文中报道的方法一次性实现了亚甲基的C-H活化、链状底物的应用、位置选择性(β位)、分子间C-C键形成、不对称选择性这五个难点,可以说是催化不对称合成领域的一个里程碑式的报道。
手法与技巧
本文中最大亮点可以说是独自开发出的不对称配体APAQ。该配体加速了该反应的进行,并且通过弱配位的单齿导向基团(ArF = p-CF3C6F4酰胺)防止催化循环中配体的解离,抑制了消旋体的background反应的进行。
小编个人也是做原创性配体设计的,要开发一种全新的原创性的手性配体的话,由于配体的可能性是无限多的,但是我们不可能用笨办法把所有的可能的配体都一个个合出来,这可能一辈子都做不完。而怎样通过理论与实践的结合来缩小可能性的范围是我们有机化学家的工作,也体现了设计者的思路与水准。而Yu教授是这方面的专家中的专家,我们可以看到,他在2012年利用2-氧代吡啶作为配体进行的亚甲基的C-H活化尝试( M. Wasa et al., J. Am. Chem. Soc. 2012, 134, 18570. DOI: 10.1021/ja309325e)发现该类单齿配体的反应活性还行但是手性诱导还是存在一定的局限。然而经验丰富的他通过Ellmann imine引入了另外一个手性位点,这样就很容易的能够与Pd形成一个6元环鳌合结构。同时,进一步对胺基通过酰基化保护变换成他的成名氨基酸衍生物配体的类似物,最终形成了APAQ这个明星配体。
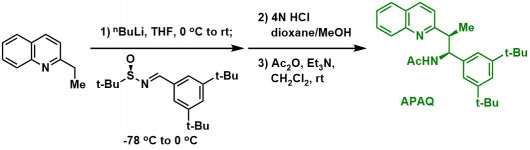
APAQ配体的合成法
配体的有效性验证
底物的拓展与兼容性非常不错,从下图中的产物中我们可以发现,对于含有F/Cl/Br/CF3、邻苯二甲酰亚胺、酮、醚、酯、磷酸酯、Ts酰胺等都适用。对于立体位阻大的底物产率相对较低,而其中甲酰胺对于C-H键的断裂的加速效果在文中也通过过渡态(TS)的计算给出了一定的支撑。
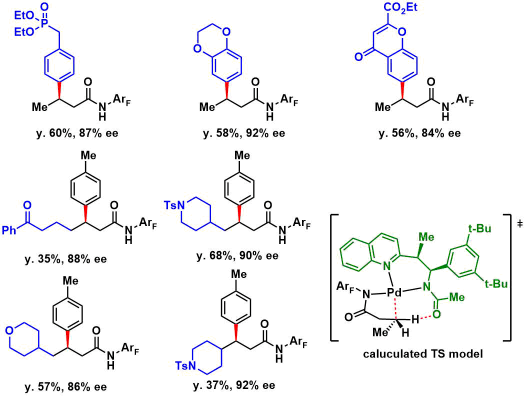
底物拓展的优越性
小编认为还需要进一步突破的几点
- 底物中特殊的酰胺导向基团(ArF)是必不可少的。所以如果能把导向基团拓展成羧酸等比较容易进一步官能团化的基团的话,该反应体系就更具有实用性与广谱性。
- C-H活化的位点局限在β位。一般来说远端位的(γ,δ・・・)选择性活化比较困难。如果通过导向基团或者配体的设计能够实现比β位更远的位置的选择性的话那就更赞了。
- Pd催化芳香基取代的硼酸的不对称共轭加成反应可以得到同样结构的产物,这个估计是做着最不想让人提及的。。。小编猜想。如果该方法能够适用于其他比较新颖的底物的话。。。
- 底物中酰胺的α位上有取代基的底物没有出现。小编猜想是否是由于这类底物通过ArF酰胺的合成法难以合成?。
- 据小道消息,该配体的开发历史可以以下图表述,说实话一般的实验室承担不起啊。。。。[3]。

接下来建议读者必须读的论文?
- 羧酸作为导向基团的亚甲基碳的sp3 C-H活化(非不对称)反应中使用的催化体系。
- J.-Q.Yu研积蓄的Pd催化的C-H活化反应中配体的加速效果与其结构的相关性研究[2]。
- 第一序列过渡金属催化的C(sp3)-H活化反应的催化体系。
- 远端位(比β位更远)的惰性C(sp3)-H键的位置选择性官能团化的催化体系。
参考文献
- (a) M. Wasa et al., J. Am. Chem. Soc. 2012, 134, 18570. DOI: 10.1021/ja309325e (b) J. He et al., Angew. Chem. Int. Ed. 2016, 55, 785. DOI: 10.1002/anie.201509996
- (a) B.-F. Shi, N. Maugel, Y.-H. Zhang, J.-Q. Yu, Angew. Chem. Int. Ed. 2008, 47, 4882. DOI: 10.1002/anie.200801030 (b) K. S. L. Chan et al., Nat. Chem.2014, 6, 146. doi:10.1038/nchem.1836 (c) D. G. Musaev, A. Kaledin, B.-F. Shi, J.-Q. Yu, J. Am. Chem. Soc. 2012, 134, 1690. DOI: 10.1021/ja208661v(d) G.-J. Cheng et al., J. Am. Chem. Soc. 2014, 136, 894. DOI: 10.1021/ja411683n
- Stu Borman, C&EN 2016, 94, 7.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.