作者:杉杉
导读:
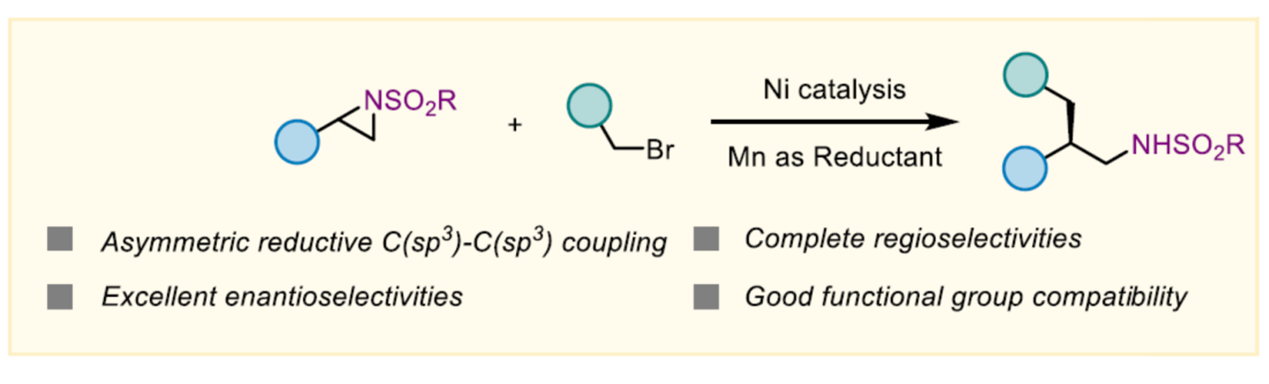
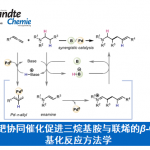
近日,上海原思标物科技有限公司的刘文斌团队在J. Am. Chem. Soc.中发表论文,首次报道一种高度对映选择性烷基化氮杂环丙烷的开环反应。在手性镍/吡啶-咪唑啉配合物的催化下,实现了外消旋N-sulfonyl styrenyl aziridines与一级烷基溴的不对称C(sp3)−C(sp3) 交叉亲电偶联反应,合成了一系列手性苯乙胺衍生物,具有完全的区域控制性与良好的官能团耐受性。初步的机理研究支持了一种反应途径,该途径由原位氮杂环丙烷的区域选择性碘解与随后生成的β-氨基苄基碘与烷基溴的对映汇聚偶联组成。
Nickel-Catalyzed Enantioselective C(sp3)−C(sp3) Cross-Electrophile Coupling of N‑Sulfonyl Styrenyl Aziridines with Alkyl Bromides
Y. Lan, Q. Han, P. Liao, R. Chen, F. Fan, X. Zhao, W. Liu*.
J. Am. Chem. Soc. 2024, ASAP. doi: 10.1021/jacs.4c08435.
正文:
过渡金属催化的对映选择性交叉亲电偶联(XEC)是一种构建手性分子的有趣策略,避免了使用预生成的有机金属与潜在的官能团相容性的问题。尽管在镍催化的不对称C(sp3)−C(sp2) XEC反应中已取得了重大进展[1],但对于不对称C(sp3)−C(sp3) XEC反应仅有两例相关的报道,其由徐涛[2]和舒伟[3]团队开发,依赖于使用硼酸酯或酰胺作为导向基团。近年来,使用氮杂环丙烷的XEC反应经历了激增的发展,Doyle[4]、Nevado[5]与梅天胜[6]在镍催化下,使用化学计量的金属还原剂或电化学方法实现了高度对映选择性的研究(Scheme 1A)。2015年,Doyle课题组报道了一种镍催化的N-对甲苯磺酰基α-甲基苯乙烯基氮杂环丙烷与正丁基溴化锌的对映汇聚性交叉偶联反应,尽管对映体选择性较低(Scheme 1B) [7]。这里,上海原思标物科技有限公司的刘文斌团队首次报道一种镍催化外消旋N-sulfonyl styrenyl aziridines与一级烷基溴的对映汇聚性C(sp3)−C(sp3) 交叉亲电偶联反应,合成了一系列手性的苯乙胺衍生物(Scheme 1C)。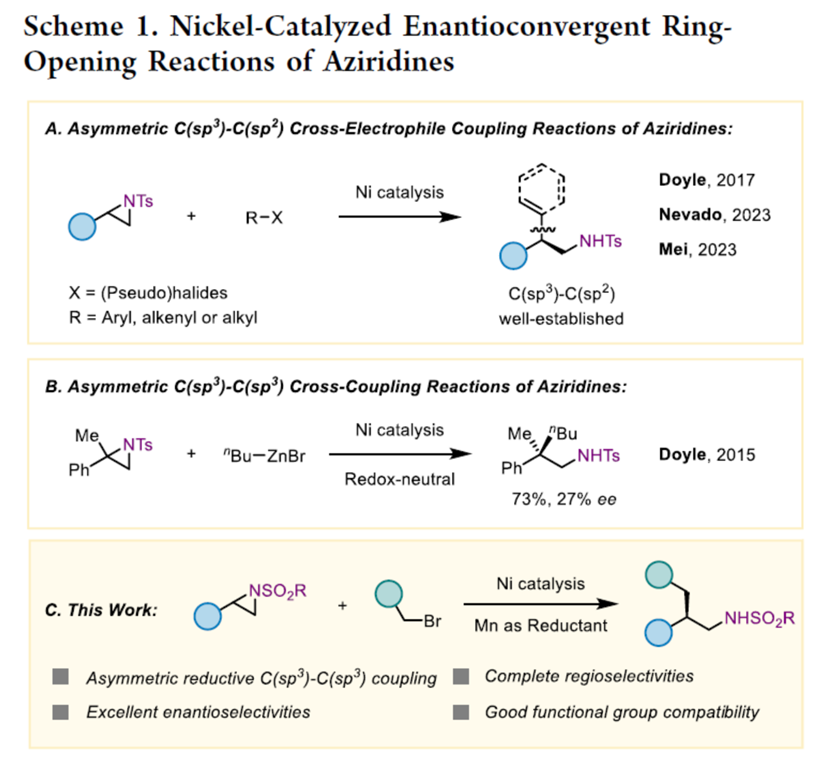
首先,作者采用N-sulfonyl styrenyl aziridine 1a与1-溴戊烷2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。当使用L2–L4配体时,对映选择性较低。BiOX配体L5也促进了这种不对称开环反应,但对映选择性收率均偏低。BOX配体L6的反应生成了外消旋混合物。使用其他镍预催化剂如Ni(cod)2和NiBr2也得到了类似的结果。使用锌代替锰作为还原剂,导致收率与对映选择性均降低。使用MgCl2代替MgI2作为添加剂时,反应几乎停止。在NaI作为添加剂时,收率也显著降低。反应也在DMF中进行,结果稍差,而在THF中没有发生预期的反应。在室温下进行反应,会对不对称诱导产生不利影响。基于上述的讨论,进而确定最佳的反应条件为:采用Ni(dme)Cl2作为催化剂,L1作为手性配体,MgI2作为添加剂,Mn作为还原剂,在DMA反应溶剂中,反应温度为0 oC,最终获得90%收率的产物3aa(92% ee)。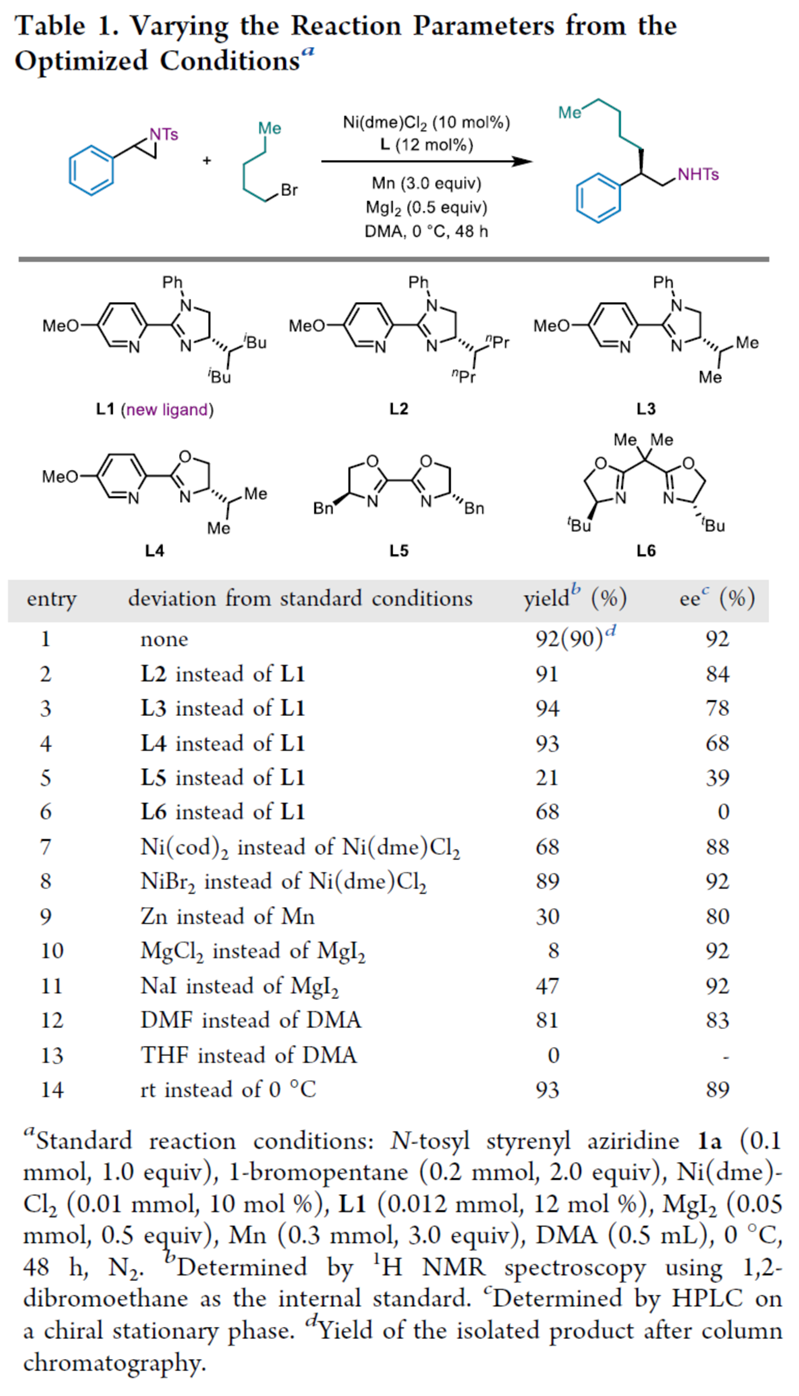
在获得上述的最佳反应条件后,作者对底物的应用范围进行深入研究(Table 2)。首先,一系列一级烷基溴,均可顺利进行反应,获得相应的产物3aa–3as,收率为57-90%,ee为87-95%。值得注意的是,一系列活性的基团,如卤素、烷氧羰基、缩醛、羰基、醛基、硼酸酯等,均与体系兼容。同时,由可可碱与雌酮衍生的烷基溴,也能够顺利进行偶联反应,获得相应的产物3at(收率为88%,ee为94%)与3au(收率为81%,dr > 20:1)。然而,二级烷基溴或三级烷基溴,均未能有效的进行反应。其次,一系列不同取代的N-磺酰基氮杂环丙烷,均与体系兼容,获得相应的产物3ba–3ta与3ui,收率为59-92%,ee为86-95%。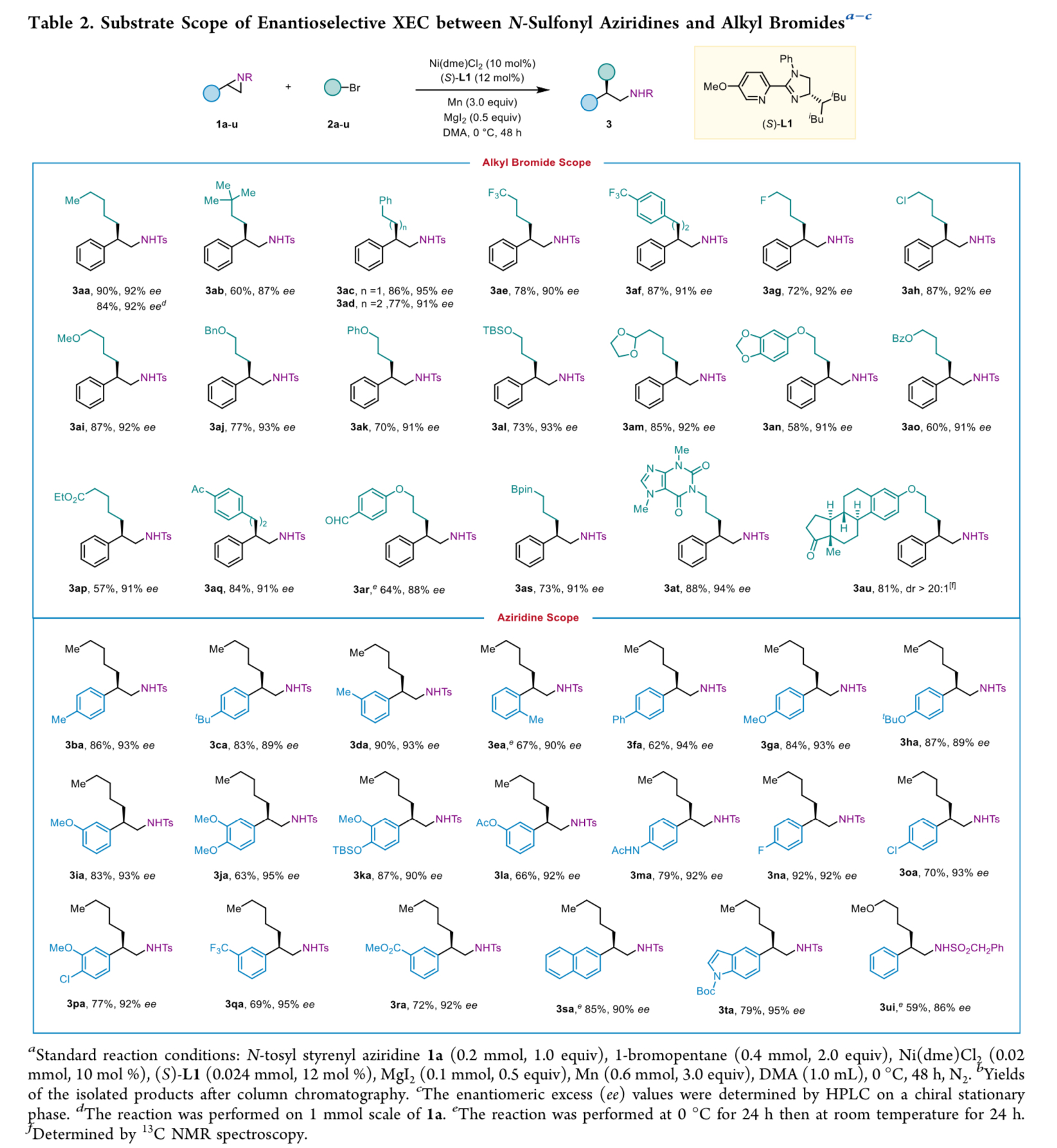
接下来,作者对上述交叉亲电偶联过程的反应机理进行了研究 (Scheme 2)。首先,(R)-1a与(S)-1a分别在标准条件下反应,可获得相似收率与对映选择性的产物3aa(Scheme 2A)。通过对底物1a与产物3aa在反应过程中的对映选择性监控发现,产物3aa的对映选择性在反应过程中保持恒定,而回收的底物1a总是外消旋的,表明了反应涉及对映汇聚性的过程,外消旋氮杂环丙烷前体没有发生动力学拆分(Scheme 2B)。1a与1-碘戊烷(2a’)(Scheme 2C)以及1a与MgI2 (Scheme 2D)的对照实验表明,镍介导的氮杂环丙烷发生了缓慢的碘解,并且没有对映选择性的控制。苄基碘4与1-溴戊烷(2a)的偶联反应,同样可以25%的收率得到产物3aa,表明了反应涉及氮杂环丙烷碘解以及随后的偶联过程(Scheme 2E)。使用Ni(cod)2作为催化剂,1a与2a反应未能生成目标产物3aa,这与氮杂环丙烷直接氧化加成到低价镍的机理相反(Scheme 2F)。自由基钟实验结果表明,反应可能涉及烷基自由基介导烷基溴的氧化加成过程(Scheme 2G)。CV实验表明,Ni(I)配合物可以通过Mn还原由Ni(II)预催化剂原位产生 (Scheme 2H)。非线性效应研究结果表明,带有单一配体的单体镍配合物参与了对映体选择性控制步骤(Scheme 2I)。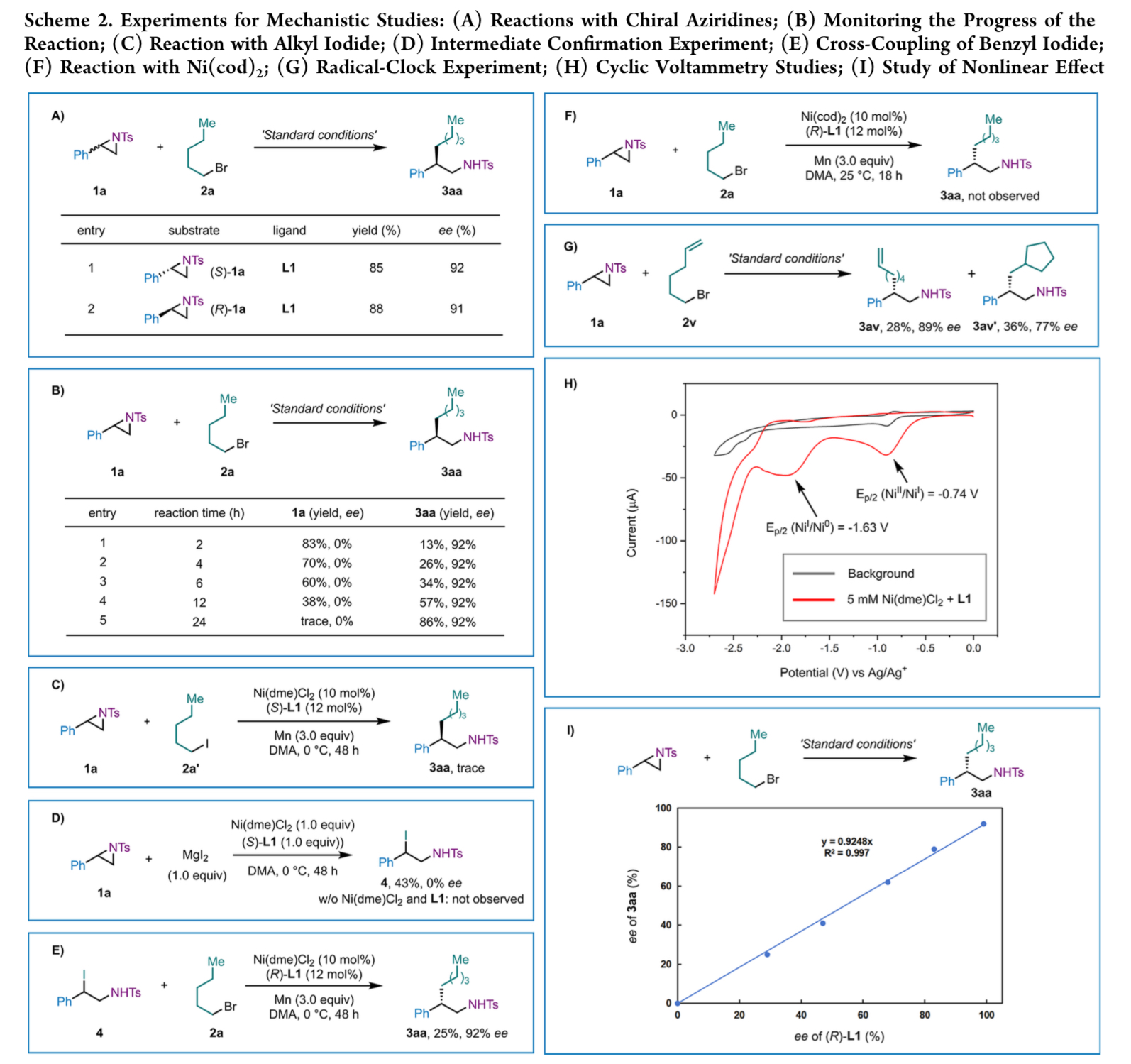
随后,作者对反应的实用性进行了研究(Scheme 3)。首先,3aa通过钌促进苯环的氧化断裂以及酸介导的酯化反应,可以两步49%的收率与92%的ee得到β-氨基酸化合物5。其次,3ad通过脱保护,可以82%的收率得到手性一级胺6。同时,一级胺6可分别进行酰胺化与还原胺化,获得相应的苯甲酰胺化合物7(收率为89%,91% ee)与二级胺8(收率为75%,92% ee)。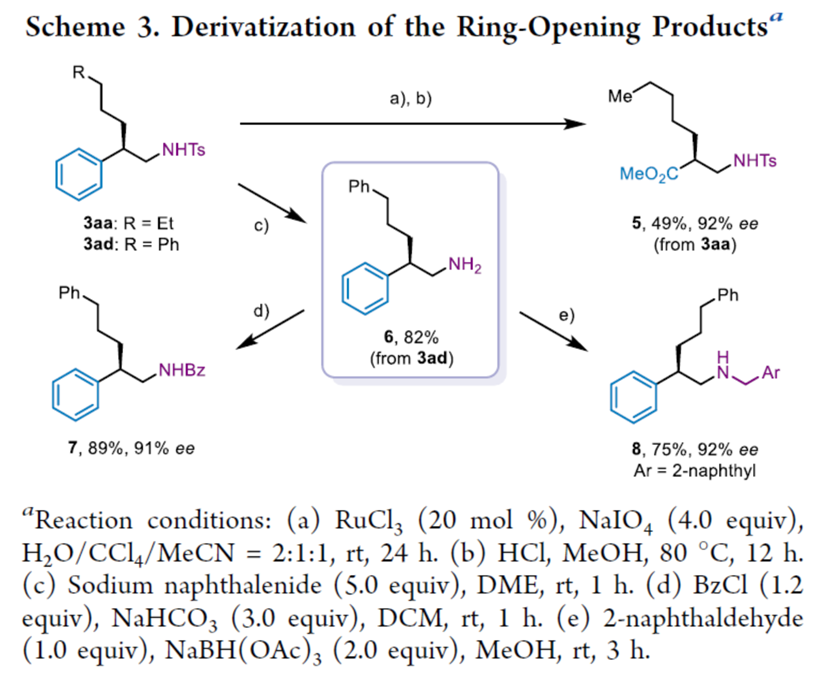
基于上述的实验研究以及前期相关的文献报道[8],作者提出如下合理的反应机理 (Scheme 4)。首先,氮杂环丙烷1在原位进行区域选择性碘解,得到外消旋苄基碘4,在通过卤素原子转移(XAT)与Ni(I)Br的氧化加成反应中,其反应性优于烷基溴2。其次,苄基自由基A与Ni(II)IBr配合物进行重组(作为对映选择性决定步骤),生成手性Ni(III)中间体B。中间体B通过进一步的还原,生成Ni(I)配合物C。配合物C与烷基溴2通过XAT进行氧化加成反应,并经自由基重组,生成Ni(III) 配合物D。配合物D经还原消除,从而获得目标产物3,并再生Ni(I)Br作为下一个催化循环的催化剂。值得注意的是,根据Curtin−Hammett原理,涉及Ni(III)中间体D动态动力学拆分的机理方案也可能存在,其中配合物B的形成不是立体选择性的,但从外消旋Ni(III)中间体D到Ni(I)Br的最终还原消除是立体汇聚性的。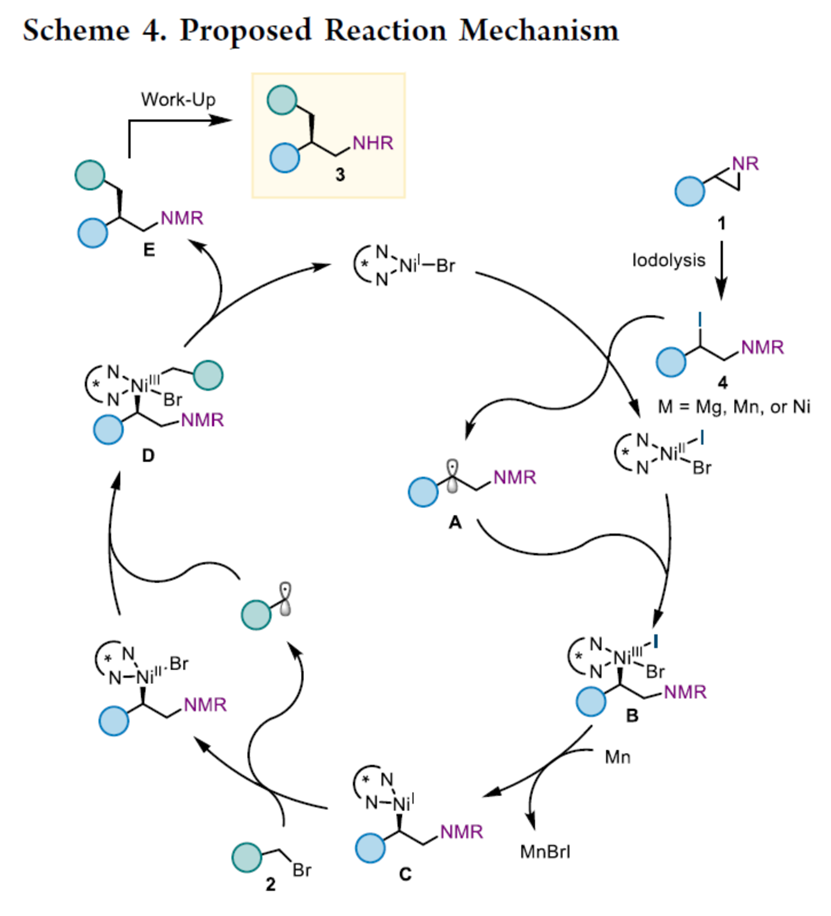
总结:
上海原思标物科技有限公司的刘文斌团队报道一种镍催化外消旋N-sulfonyl styrenyl aziridines与一级烷基溴的不对称C(sp3)−C(sp3) 交叉亲电偶联反应,合成了一系列手性的苯乙胺衍生物。同时,该策略具有底物范围广泛、官能团兼容性出色、区域选择性出色等特点。机理研究表明,反应涉及镍介导的N-磺酰基苯乙烯基氮杂环丙烷的区域选择性碘解,以及随后烷基溴与原位形成的β-氨基苄基碘之间的对映汇聚性C(sp3)−C(sp3)交叉亲电偶联的过程。
参考文献:
- [1] B. P. Woods, M. Orlandi, C. Y. Huang, M. S. Sigman, A. G. Doyle, J. Am. Chem. Soc. 2017, 139, 5688. doi:10.1021/jacs.7b03448.
- [2] J. Zhou, D. Wang, W. Xu, Z. Hu, T. Xu, J. Am. Chem. Soc. 2023, 145, 2081. doi:10.1021/jacs.2c13220.
- [3] W. Zhao, W. Shu, Sci. Adv. 2023, 9, No. eadg9898. doi:10.1126/sciadv.adg9898.
- [4] B. P. Woods, M. Orlandi, C. Y. Huang, M. S. Sigman, A. G. Doyle, J. Am. Chem. Soc. 2017, 139, 5688. doi:10.1021/jacs.7b03448.
- [5] X. Hu, I. Cheng-Sanchez, S. Cuesta-Galisteo, C. Nevado, J. Am. Chem. Soc. 2023, 145, 6270. doi:10.1021/jacs.2c12869.
- [6] Y. Wang, Z. Wang, I. L. Eshel, B. Sun, D. Liu, Y. Gu, A. Milo, T. Mei, Nat. Commun. 2023, 14,2322. doi:10.1038/s41467-023-37965-0.
- [7] C. Y. Huang, A. G. Doyle, J. Am. Chem. Soc. 2015, 137, 5638. doi:10.1021/jacs.5b02503.
- [8] S. Dongbang, A. G. Doyle, J. Am. Chem. Soc. 2022, 144, 20067. doi:10.1021/jacs.2c09294.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
关注Chem-Station抖音号:79473891841



















No comments yet.