本文作者:杉杉
导读
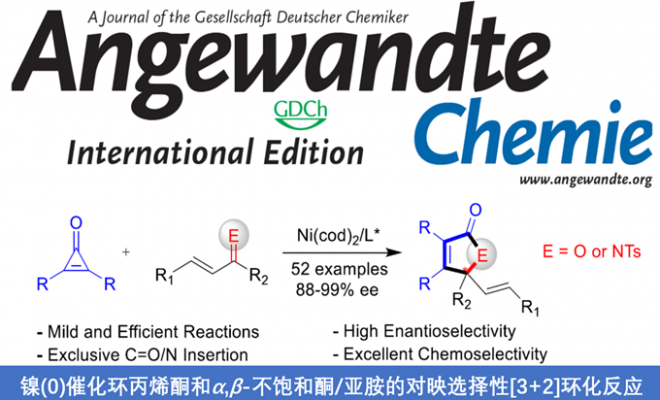
近日,陕西师范大学李兴伟教授课题组在Angew发表论文,报道Ni(0)催化下,实现环丙烯酮与α,β-不饱和酮/亚胺的化学和对映选择性[3+2]环加成反应,该反应涉及环丙烯酮C-C键断裂和羰基/亚胺基的对映选择性官能团化。通过分子间C-C键活化,获得高对映选择性(88-98%的ee)的γ-烯基丁烯酰胺和内酰胺衍生物。
Nickel(0)‐Catalyzed Enantioselective [3+2] Annulation of Cyclopropenones and α,β‐Unsaturated Ketones/Imines
Xingwei Li,* Dachang Bai, Yanjiang Yu, Haiming Guo, Junbiao Chang
正文
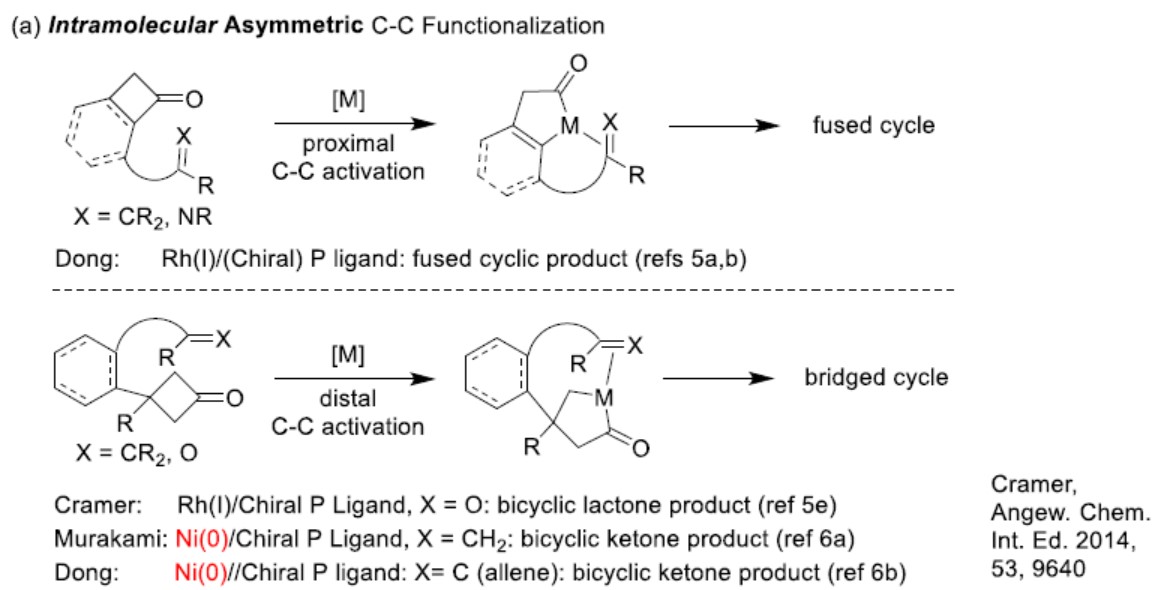
在过去几年中,C-C键的活化(轻松地实现骨架重建)已获得越来越多的关注,通常C-C键活化通过两个基本的非自由基反应来实现,即C-C键的氧化加成和β-碳消除。尽管取得了一定的成果,但大多数文献使用一些贵金属作为催化剂。此外,不对称催化C-C键活化系统的发展也严重滞后(即使对于活化的C-C键)。同时,已报到文献主要是由螯合辅助C-C键的氧化加成引发,然后将C=C,C=O或C=N键进行分子内插入(Scheme 1a)。Murakami和Dong报道了两个典型的例子,即分子内的烯烃或丙二烯不对称地对环丁酮进行插入(Scheme 1a)。但是,镍催化分子间不对称C-C活化却很少被报道。除环丁酮外,环丙烯酮也作为环加成反应中重要试剂。通过有机和金属催化,实现环丙烯C-C单键的活化(不同的π-键可用于偶联)过程已引起了越来越多的关注。
在此,作者报道了环丙烯酮和α,β-不饱和酮/亚胺之间的对映选择性[3+2]环化反应,获得γ-烯基丁烯酰胺或内酰胺衍生物(Scheme 1b)。此外,γ-丁烯内酯作为具有生物活性天然产物的基本骨架,但仅有少量文献报道通过对映选择性途径合成此类产物。
与分子内的偶联不同,当分子间偶联中使用含有π组分的烯酮作为偶联底物时,会出现化学选择性和对映选择性的问题。据文献报道,烯酮C=C键可参与各类偶联反应,尤其在低价金属催化的条件下,其中极性较小的M-C键可降低极性C=O键插入的倾向,但共轭C=C键可促进C=O键的插入。
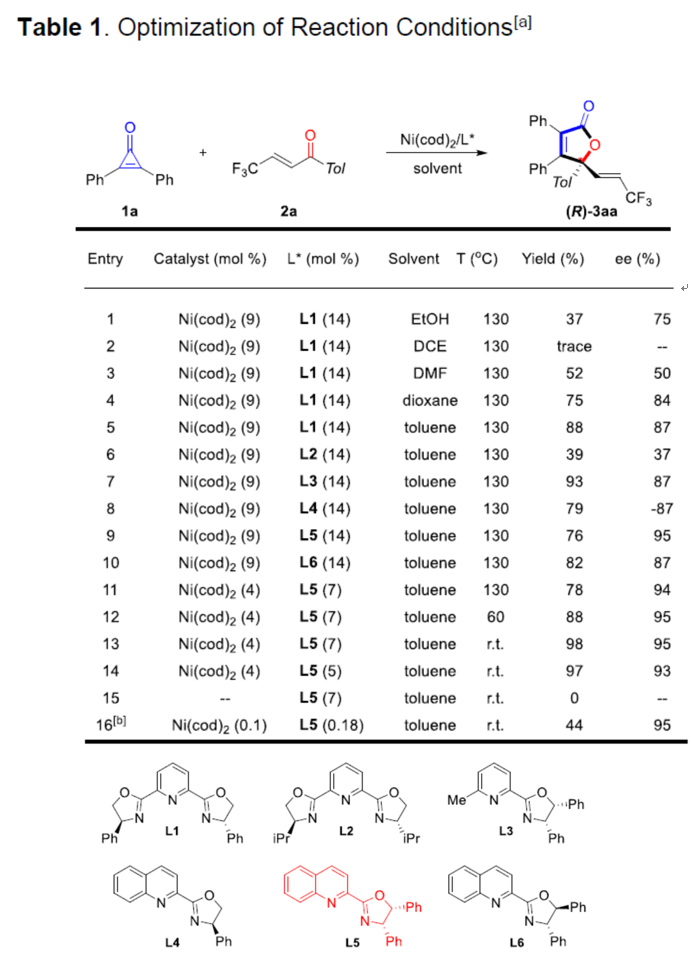
首先,作者以二苯基环丙烯酮(1a)和烯酮2a作为模型底物(Table 1)。作者最初使用Ni(cod)2/L1作为催化剂,以EtOH作为溶剂,获得所需的[3+2]环加成产物(R)-3aa(收率37%,ee-75%)(entry 1),且未检测到C=C插入产物。紧接着,作者对反应的溶剂进行了筛选,甲苯作为最佳溶剂(entries 1-5)。而对配体的筛选结果表明(entries 5-10),具有顺式邻二苯基取代的恶唑啉环配体L5是高效的,获得76%收率和ee-95%的(R)-3aa(entry 9)。同时,作者发现产物3aa的绝对构型由配体中5位决定,使用手性配体L4可获得(S)-3aa(entry 8)。将温度降低至25℃或将催化剂摩尔量降低都会提高反应的收率和对映选择性(entries 11-14)。在无催化剂时,不能进行该反应,说明催化剂的至关重要性(entry 15)。而当催化剂的量降低至0.1mol%反应48小时也可获得相应的产物,但收率有所降低(entry 16)。
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Scheme 2)。反应结果表明,当底物2烯酮含有β-CF3时,苯环对位上不受电子效应影响,均可获得相应的产物(3aa–3ag),而苯环间位和邻位取代也可获得相应的产物(3ah–3am),但含有双取代氯的收率有所降低(3al)。此外,一些(杂)芳基、环己基和叔丁基取代的烯酮也能够顺利反应(3an–3au),而在二恶烷中使用L3作为配体,可将3at与3au的产率进一步提高。如果将底物2烯酮的末端改为-C2F5时,反应结果依旧让人满意(3av–3az)。此外,在环丙烯酮底物1扩展时,作者发现,间位和对位均带有给电子基团和吸电子基团的对称二芳基环丙烯酮均具有出色的对映选择性(3ba–3ha),带有链状脂肪族基团也取得较好的结果(3ja),非对称环丙烯酮作为底物时,尽管区域选择性是中等(3ka/3ka’,3la/3la’和3ma/3ma’),但都具有高对映选择性。
Scheme 2 底物拓展
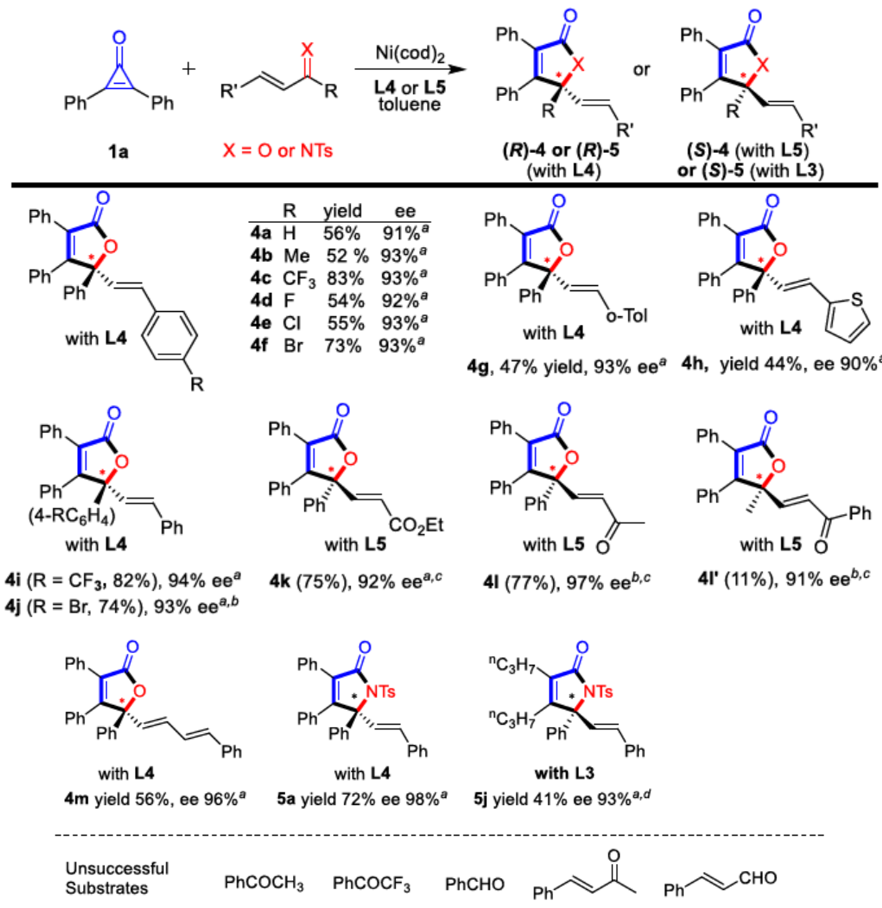
为了更好了解该反应,烯酮2被扩展为查耳酮衍生物(Scheme 3),该反应在上述最佳条件下表现出较差的反应性,但将L5配体改为L4时,获得产物(S)-4a,产率为56%,ee为91%。在查尔酮的β-苯环对位引入Me、卤素和CF3时,可取的较好的结果,同样,缺电子的烯酮具有更高的反应性(4a–4f,产率54-83%)。含有邻位取代的苯基和2-噻吩基(4g,4h)也与体系兼容。末端查耳酮含有酮时,使用L5配体也可进行偶联,获得R型产物(4k,4l和4l’)。此外,使用二烯酮作为底物时,也可获得56%收率和ee-96%的4m。更为关键的是,亚胺也可作为底物,获得具有出色对映选择性的内酰胺(5a和5j)。但是,苯乙酮、PhCOCF3、苯甲醛、亚苄基丙酮和肉桂醛均未能进行任何偶联反应。
Scheme 3 底物拓展
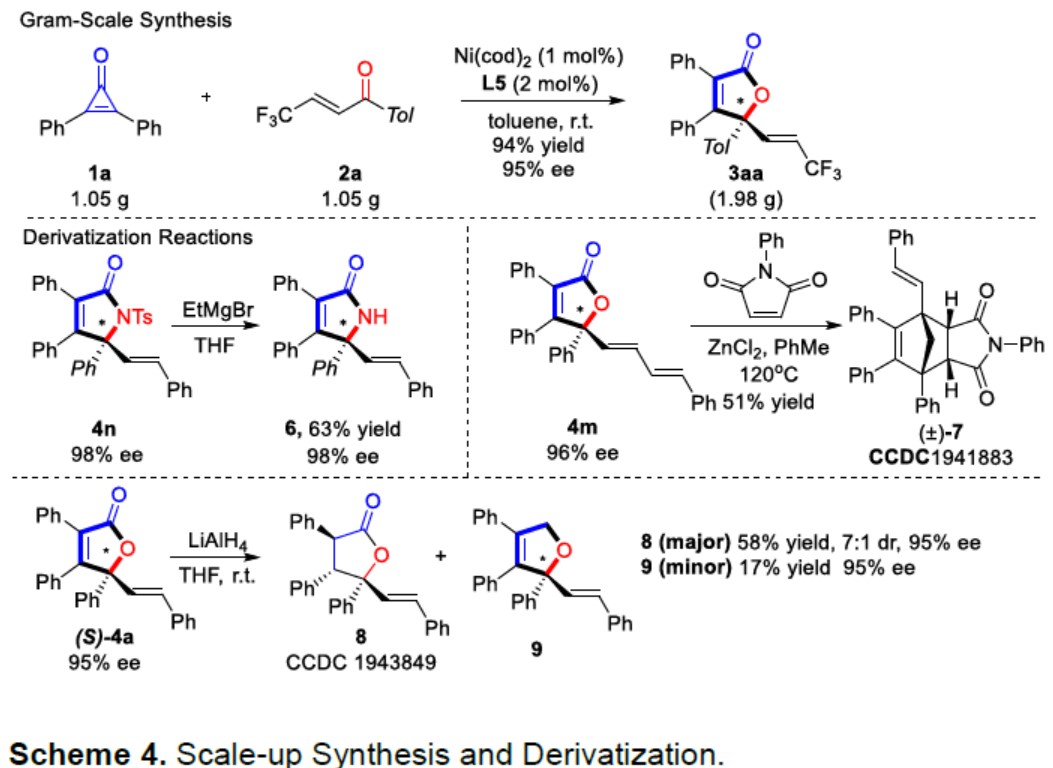
紧接着,作者对该反应的综合实用性进行了研究(Scheme 4)。将底物1a和2a进行克级实验,同样可以实现高收率和高ee的(R)-3aa偶联产物。使用烷基格氏试剂时,可以将4n中Ts基团脱保护,获得产物6。二烯底物4m与马来酰亚胺通过脱羧-Diels-Alder加成反应得到三环产物7。在室温下,LiAlH4可将(S)-4a还原,获得具有连续三个手性中心的内酯,并保留了对映体纯度,并且获得了2,5-二氢呋喃9作为次要产物。
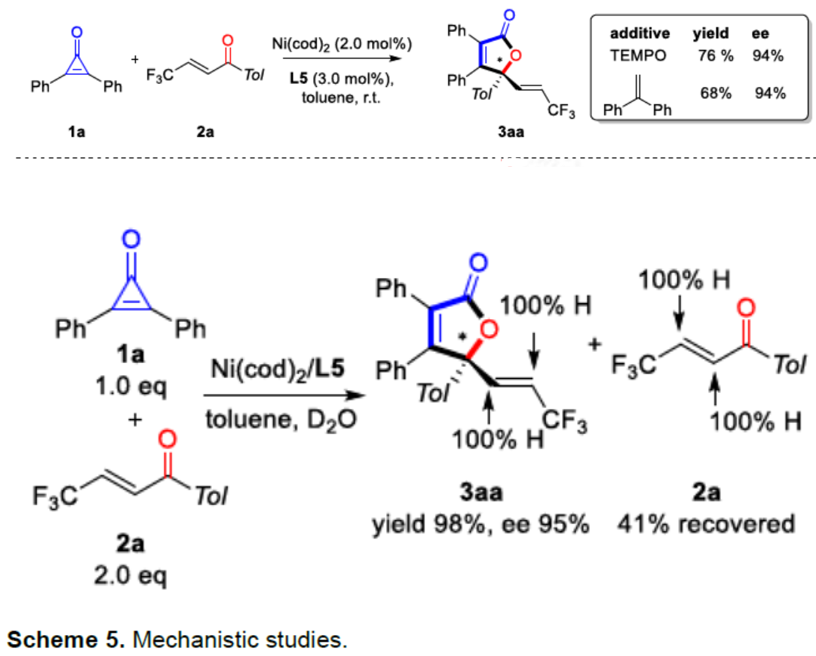
为了深入了解反应机理,作者进行了一些对照实验(Scheme 5)。当使用TEMPO(2,2,6,6-四甲基-1-哌啶基氧基)或1,1-二苯基乙烯时,底物1a和2a可顺利进行偶联反应,说明该反应为离子反应而不是自由基反应。而将D2O引入偶联反应时,在产物和起始原料2a中均未检测到氘,这与氢化镍途径背道而驰。
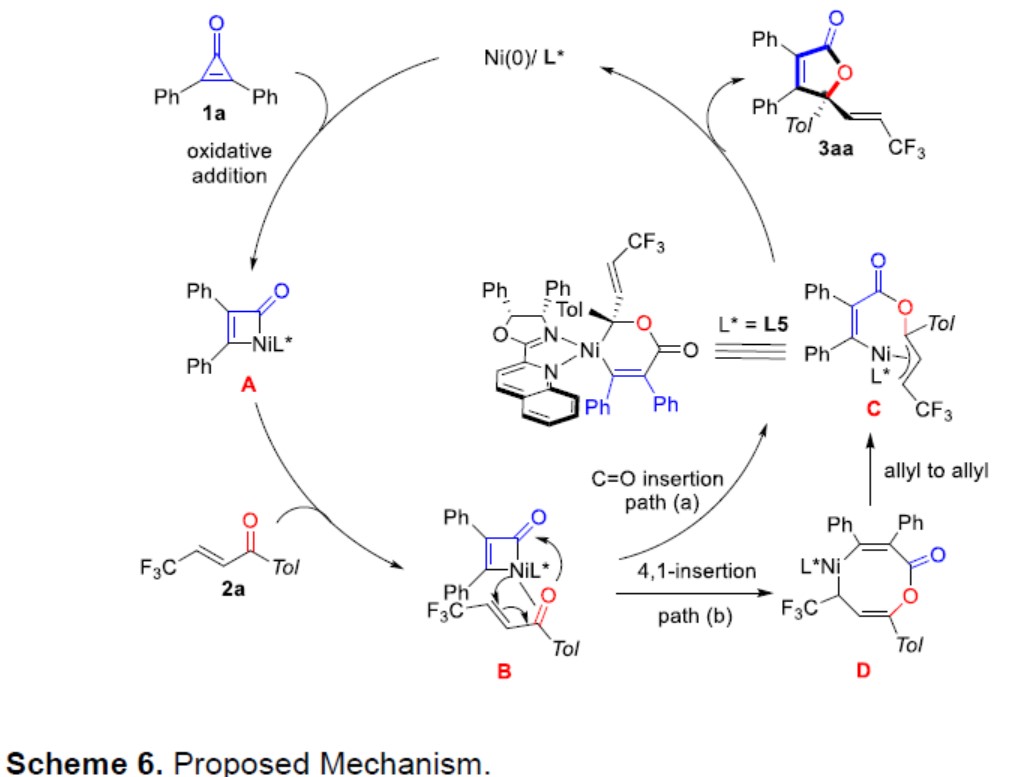
根据文献的查阅和对照实验的结果,作者提出了一种可能的反应机理(Scheme 6)。首先,二苯基环戊酮1a与Ni(0)进行氧化加成获得中间体A,紧接着再与2a反应获得中间体B,在此,作者提出了两种可能的途径:(1)中间体B将Ni-C(酰基)插入C=O键中,获得Ni(II)-烯丙基中间体C,经还原消除得到最终产物3aa,从而使催化剂再生(path-a)。(2)中间体B还可能经历4,1-迁移插入过程,获得8元镍杂环D(path-b)。
总结
陕西师范大学李兴伟教授课题组报道了Ni(0)催化下,实现环丙烯酮与α,β-不饱和酮/亚胺的化学和对映选择性[3+2]环加成反应,该反应涉及环丙烯酮C-C键断裂和羰基/亚胺基的对映选择性官能团化。通过分子间C-C键活化,获得高对映选择性(88-98%的ee)的γ-烯基丁烯酰胺和内酰胺衍生物。同时具有原子经济性、高化学选择性和对映选择性等优点。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.