作者:杉杉
导读:
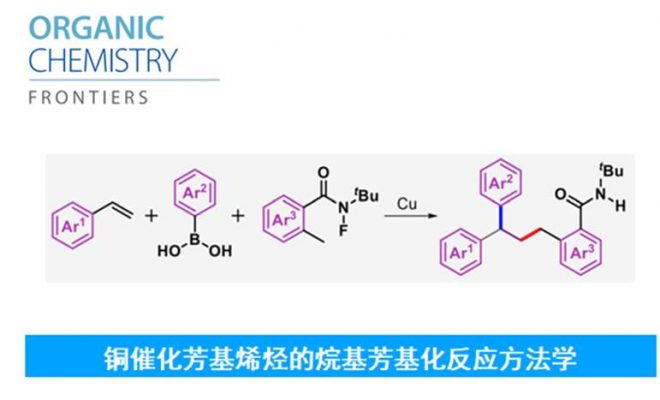
近日,兰州大学的刘雪原课题组在Org. Chem. Front.中发表论文,报道一种全新的铜催化芳基烯烃、芳基硼酸与N-氟酰胺衍生物的烷基芳基化反应方法学,涉及生成氮中心自由基、1,5-氢原子转移与苄基自由基加成的过程,进而成功完成一系列具有1,1-二芳基取代烷烃分子的构建。
Cu-catalyzed alkylarylation of alkenes via Ndirected remote C(sp3)–H functionalization
R. Rui, B. Wang, X. Xu, Z. Zhang, X. Chen, X. Liu, Org. Chem. Front. 2024, ASAP. doi: 10.1039/D3QO01933K.
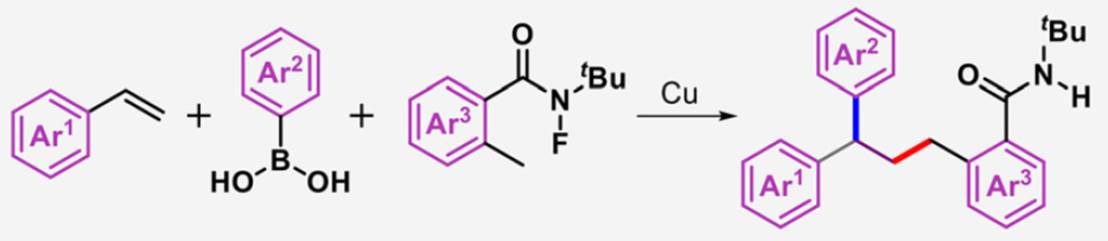
正文:
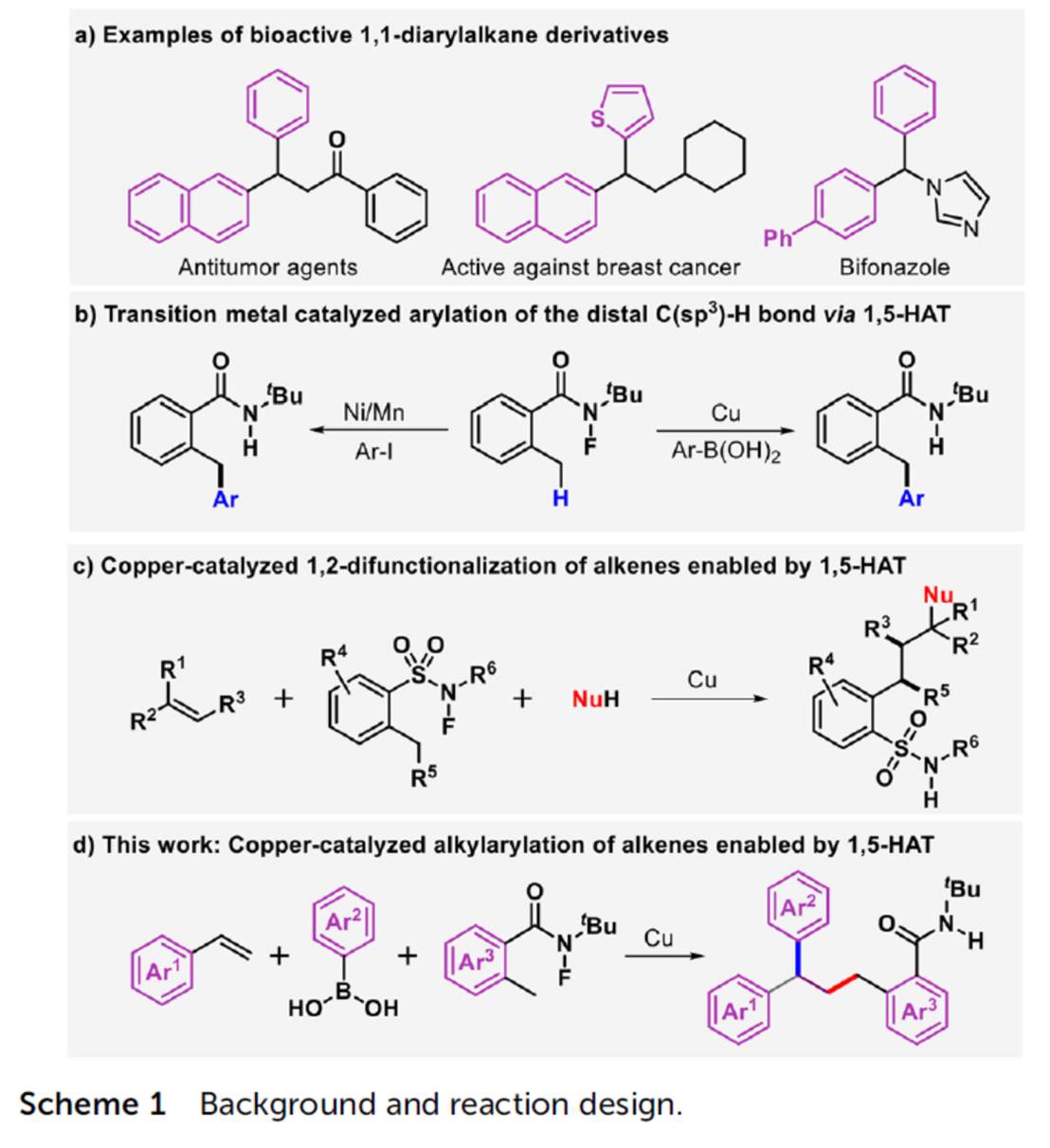
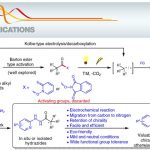
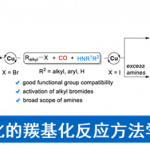
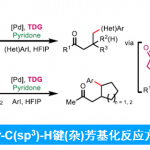
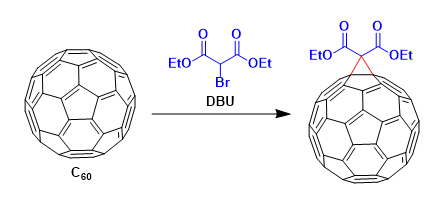
1,1-二芳基骨架广泛存在于各类天然产物、药物以及生物活性分子中 (Scheme 1a)。目前,烯烃的双碳官能团化反应方法学是构建1,1-二芳基骨架的一种极好策略[1]。然而,由于原位生成的C(sp3)–金属中间体对β-H消除的敏感性,导致此类反应具有挑战。受到近年来氮中心自由基 (Nitrogen-centered radicals,NCRs)参与Hofmann–Löffler–Freytag (HLF)[2]与HLF-type[3]反应方法学、过渡金属催化远程C(sp3)–H键芳基化反应方法学[4] (Scheme 1b)以及铜催化烯烃的1,2-双官能团化反应方法学相关研究报道的启发,这里,兰州大学的刘雪原课题组报道一种全新的铜催化芳基烯烃、芳基硼酸与N-氟酰胺衍生物的烷基芳基化反应方法学,进而成功完成一系列具有1,1-二芳基取代烷烃分子的构建 (Scheme 1d)。
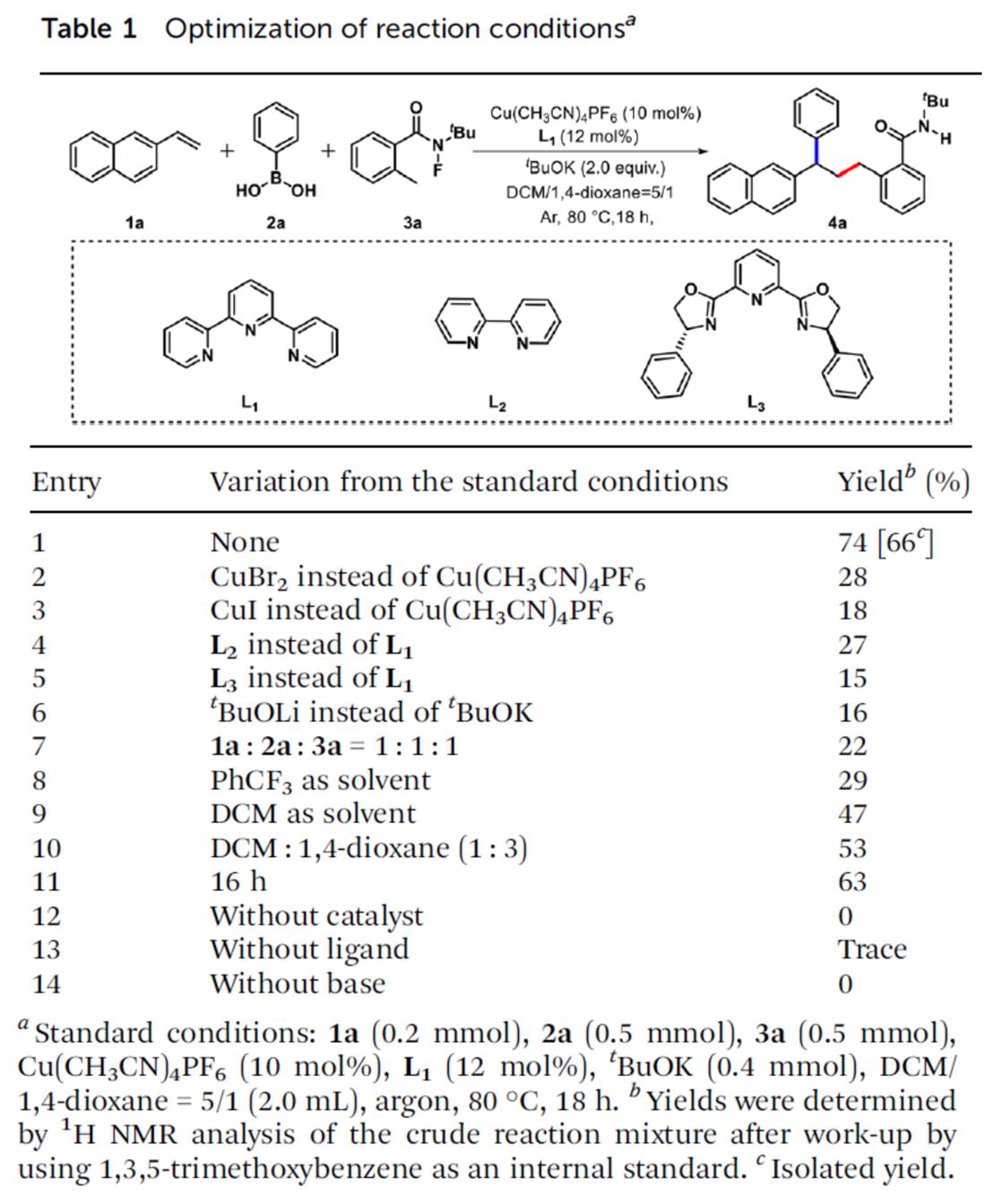
首先,作者采用2-乙烯基萘1a、苯基硼酸2a与N-(叔丁基)-N-氟-2-甲基苯甲酰胺3a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Cu(CH3CN)4PF6作为催化剂,L1作为配体,tBuOK作为碱,在二氯甲烷/1,4-二氧六环 (比例为5/1)的混合反应溶剂中,反应温度为80oC,最终获得74%收率的产物4a。
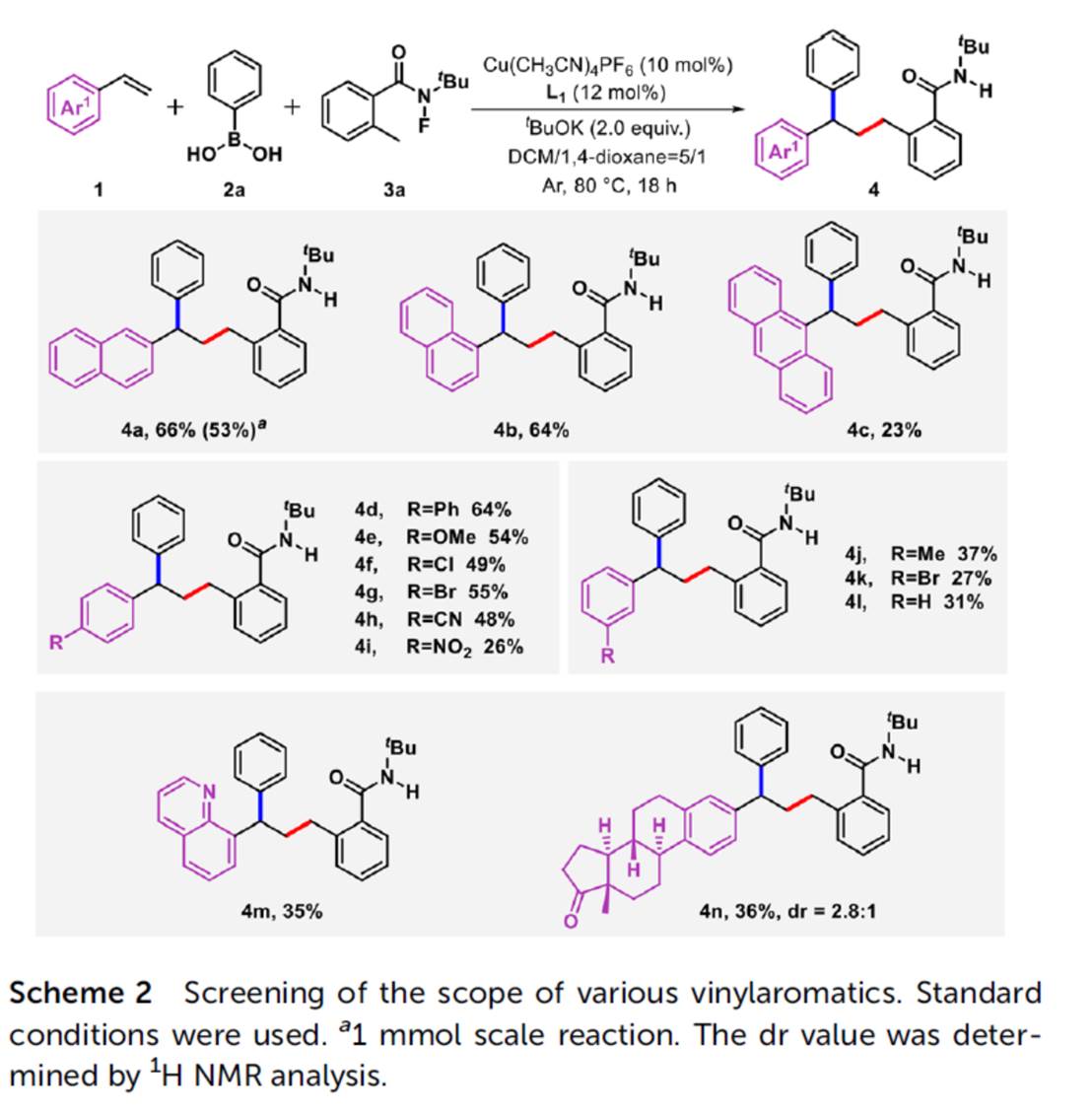
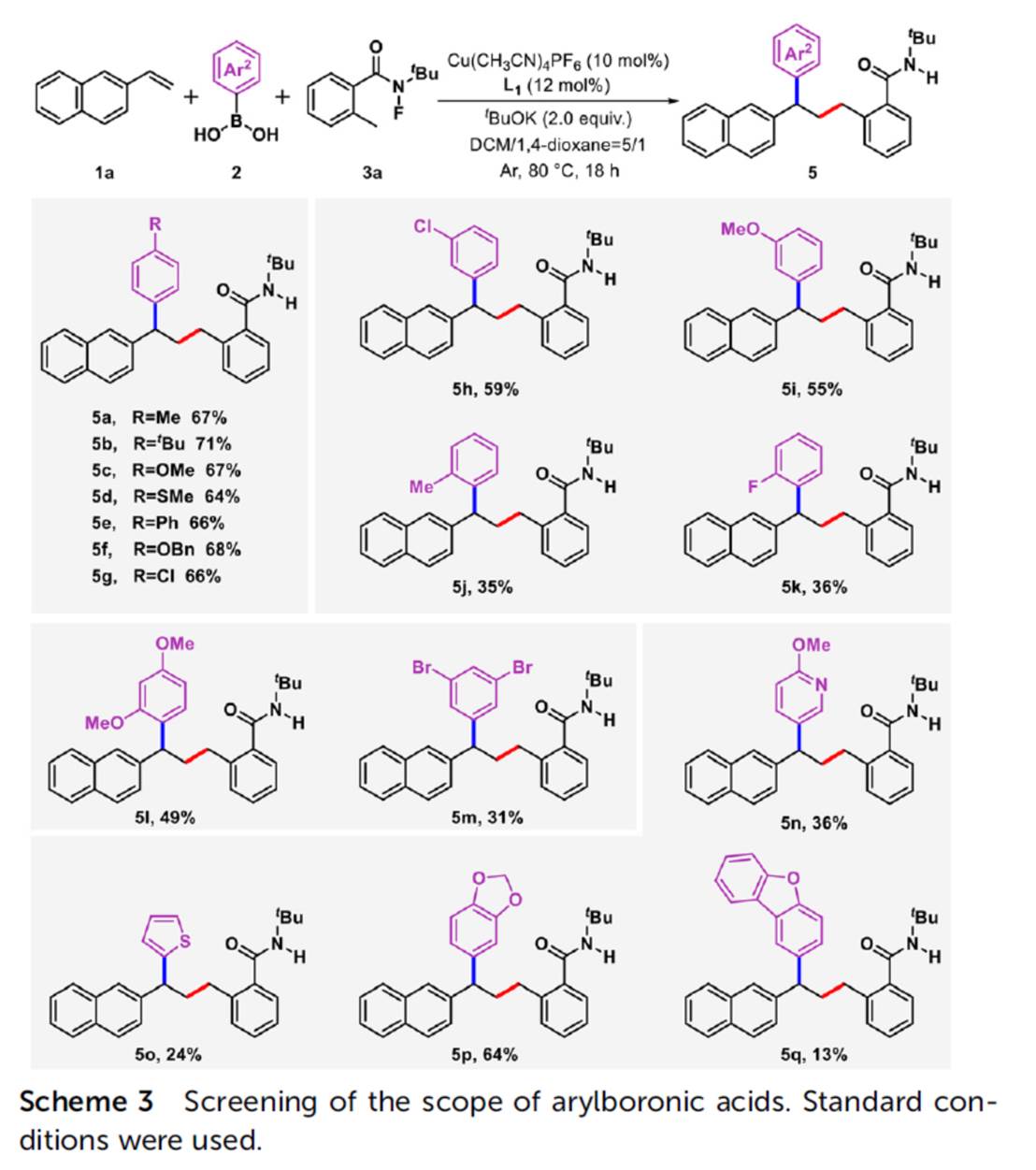
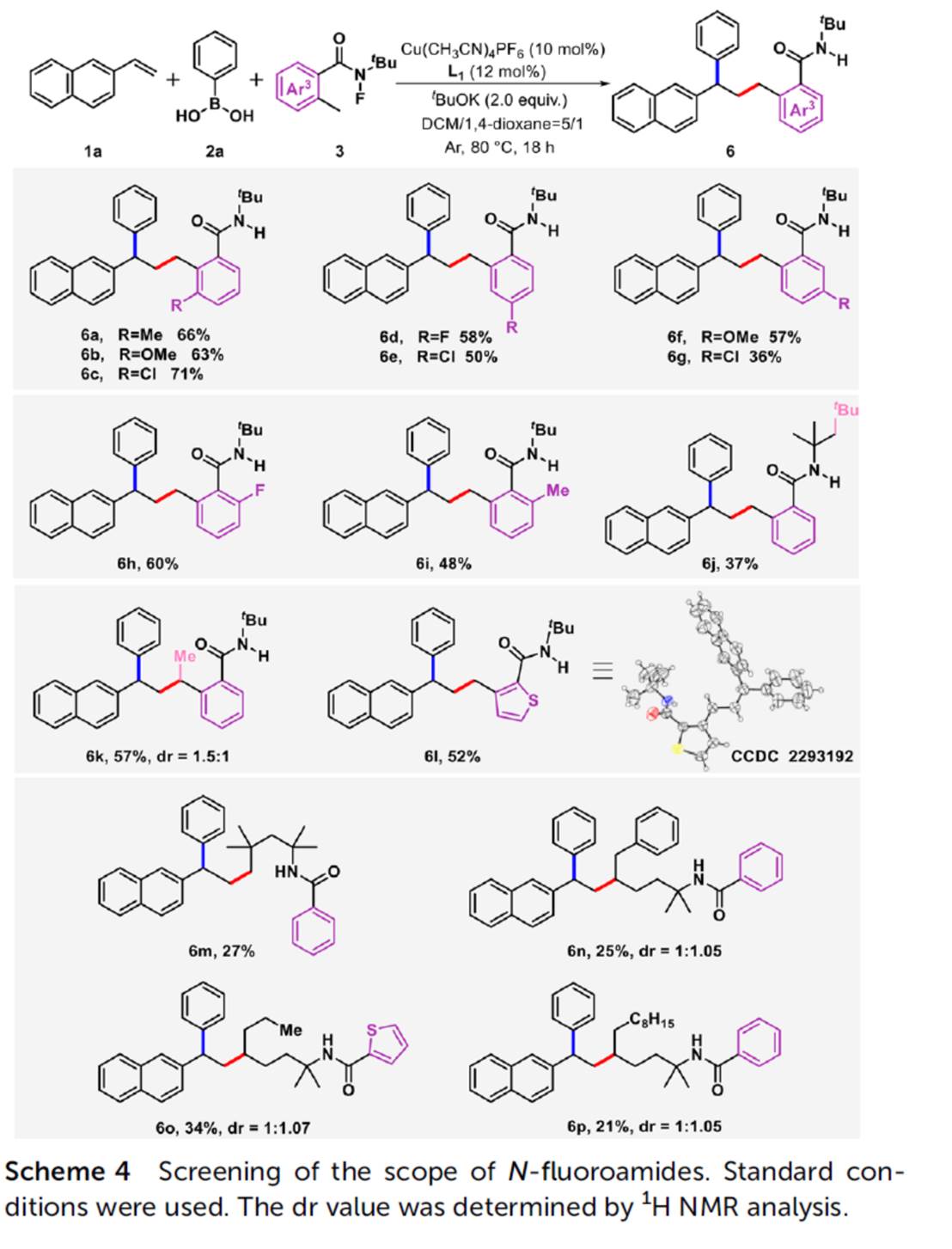
在上述的最佳反应条件下,作者分别对一系列乙烯基芳烃底物 (Scheme 2)、芳基硼酸底物 (Scheme 3)以及N-氟酰胺底物 (Scheme 4)的应用范围进行深入研究。



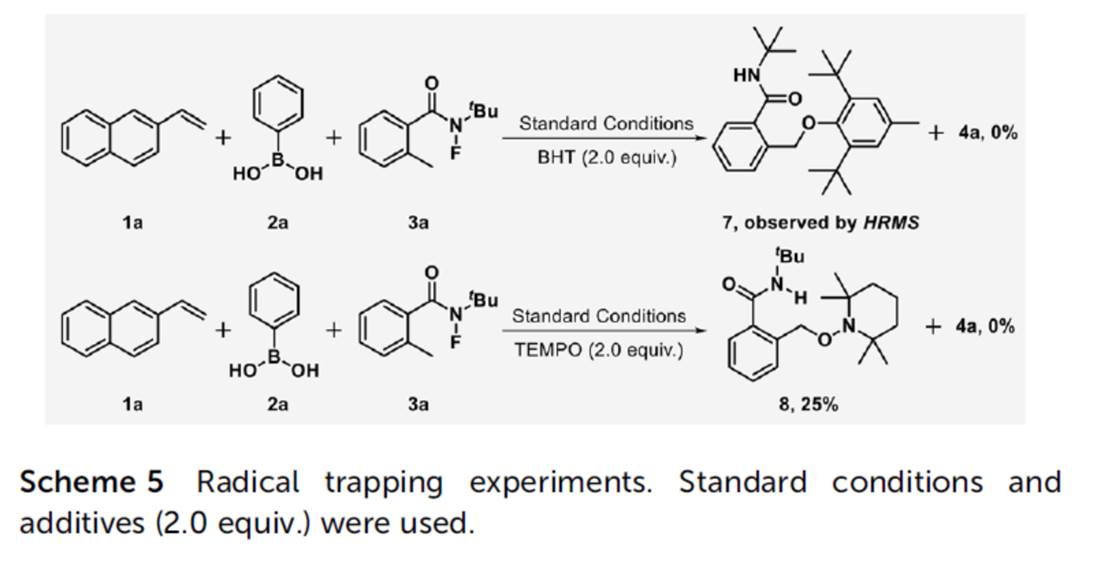
接下来,作者对上述烷基芳基化过程的反应机理进行进一步研究 (Scheme 5)。

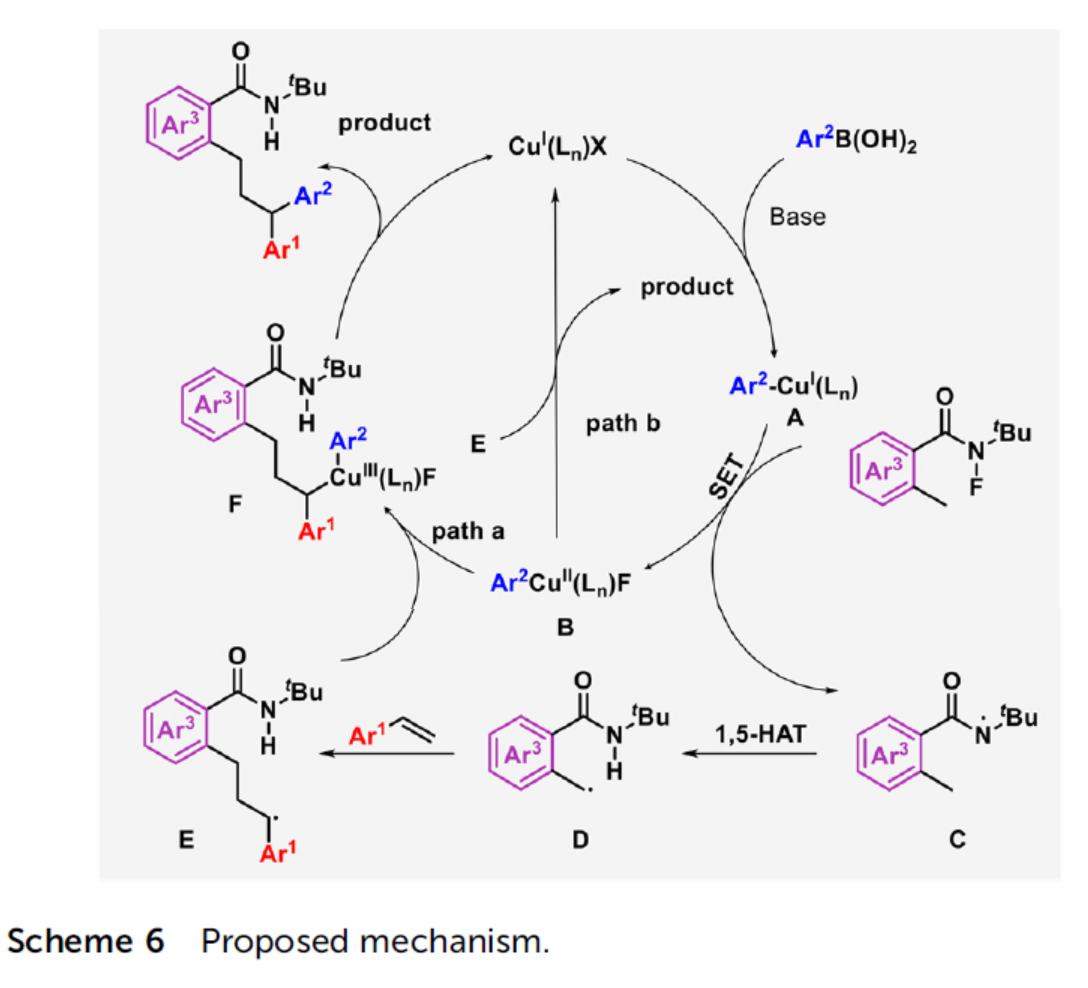
基于上述的实验研究以及前期相关的文献报道[5],作者提出如下合理的反应机理 (Scheme 6)。
总结:兰州大学的刘雪原课题组报道一种全新的铜催化芳基烯烃、芳基硼酸与N-氟酰胺衍生物的烷基芳基化反应方法学,涉及生成氮中心自由基、1,5-氢原子转移与苄基自由基加成的过程,进而成功完成一系列具有1,1-二芳基取代烷烃分子的构建。这一全新的三组分合成转化策略具有操作简单、底物范围广泛以及优良的官能团兼容性等优势。
参考文献:
- [1] C. C. Chintawar, A. K. Yadav, N. T. Patil, Angew. Chem. Int. Ed. 2020, 59, 11808. doi:10.1002/anie.202002141.
- [2] Z. Liu, H. Xiao, B. Zhang, H. Shen, L. Zhu, C. Li, Angew. Chem. Int. Ed. 2019, 58, 2510. doi:10.1002/anie.201813425.
- [3] X. Bao, Q. Wang, J. Zhu, Nat. Commun. 2019, 10, 769. doi:10.1038/s41467-019-08741-w.
- [4] Z. Li, Q. Wang, J. Zhu, Angew. Chem. Int. Ed. 2018, 57, 13288. doi:10.1002/anie.201807623.
- [5] Q. Zhang, T. Wang, X. Zhang, S. Tong, Y. Wu, M. Wang, J. Am. Chem. Soc. 2019, 141, 18341. doi:10.1021/jacs.9b10226.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
















No comments yet.