约翰・霍普金斯大学的Thomas Lectka等人、使用“无处不在”的官能团酮作为导向基团、成功实现了对刚性环状化合物的sp3 C-H区域选择性氟化反应。
“Ketones as directing groups in photocatalytic sp3 C-H fluorination”
Bume, D. D.; Pitts, C. R.; Ghorbani, F.; Harry, S. A.; Capilato, J. N.; Siegler, M. A.; Lectka, T. * Chem. Sci. 2017, 8, 6918-6923. doi:10.1039/C7SC02703F
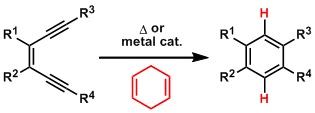
课题设定
位置选择性的sp3 C-H氟化反应的报道实例目前来说并不多。而在已报道的反应条件中,都主要集中在本身反应性高的C-H键或者立体上比较容易与反应活性中间接近的C-H键,以及一些常用的导向基团导向的C-H键的变换。
一般来说,离吸电子基团越远,越是富电子的C-H键更容易发生C-H均裂反应生成活性自由基。然而,在今年早些的一篇JACS中,Thomas Lectka等人使用吸电子基烯酮作为导向基团,已经发现多环萜类化合物的区域选择性光化学C-H氟化反应是可行的[1]。在当时同条件下,单单用酮做导向基团,反应并没有能够选择性进行(只进行了非选择性的氟化)。
而今天介绍的这篇文章就是解决了这一遗留课题。
解决手法
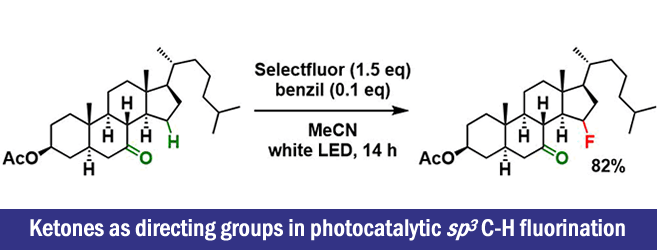
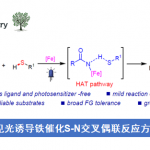
作者认为当在300nm的UV照射条件下激发底物和氟源本身时,是导致发生不希望的非选择性反应的原因,因此他们调整光源,通过加入可以在可见光下激发的光敏剂,期望在更温和的可见光条件下能够实现选择性的C-H氟化反应。这个光敏剂的添加是之前JACS[1]中所没有的。
有效性验证
①关于反应条件
光敏剂的筛选显示,已知为三重态敏化剂的Benzil(二苯基乙二酮)产率最高。关于氟源的筛选发现,Selectfluor最佳,而使用常用的NFSI和N-氟代吡啶鎓盐等氟源,不能得到所需的氟化物。同时随着Selectfluor的添加量增加,选择性降低。
光,光敏剂,氟化剂缺一不可。在空气下反应无法进行。在暗处无光照射的回流加热条件下无法选择性得到目标产物,只有trace量的氟化体生成。
②底物拓展
作者使用标题图中所示的条件进行了底物的一般性讨论。
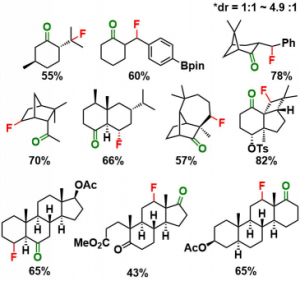
总结来说有以下特征可寻。
- 区域选择性氟化适用于具有多环刚性骨架的底物。
- 反应发生在有酮羰基的5元环・6元环的底物中。但是该条件不适用1级C-H氟化。
- 该条件不适用于乙苯底物。因此酮羰基被认为在本条件中扮演着重要的角色。
- 酮羰基无论在环内还是环外都适用。而酮羰基的朝向不同的时候,如下图所示,会产生区域选择性异构体。
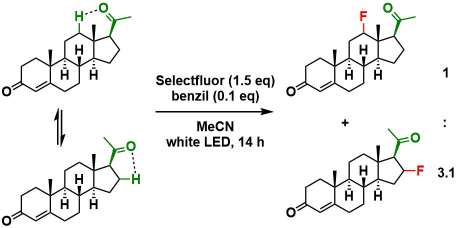
- 刚性构象有利于选择性的产生,相对的线性链状酮导向的底物很难实现选择性。例如,底物是2-庚酮的情况下,会产生β:γ:δ=1 : 2.3 : 1.3的区域选择性氟化异构体。用2-癸酮和2-十二烷酮会形成更复杂的混合物。
③关于反应机理
在以前报道的烯酮作为取向基团的反应条件[1]中,作者认为选择性的产生在分子内氢原子转移(HAT)过程中。但是在这篇文章中,作者发现
- 在对分子内HAT有利的稀释条件下,对直链酮底物的选择性也并没有得到改善
- Benzil三重态能量(53 kcal/mol)不足以引起三重态-三重态能量转移(80 kcal/mol)到脂肪族酮。
通过这两点,作者否定了HAT过程的介导可能。
作者认为:光敏剂Benzil可以促进从底物到Selectflour的能量转移,从而产生氮自由基中间体,作为氧化剂作用,引起电子移动・Proton移动,从而推动反应的进行。而实际上,在无光照下,使用同样可以生成氮自由基中间体的Selectfluor+BEt3条件,也能得到与本反应同样的选择性。(下图所示)
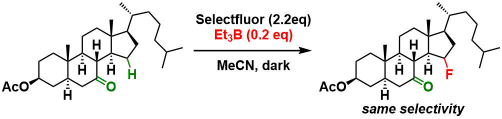
缜密的机理解析还没有完成,作者有可能会在今后的研究中进行进一步解析。
需要讨论的点
- 作为决定位置选择性的因素,底物依赖性(局限性)比较大(构象刚性是必需的等)。如果能够通过反应试剂或者催化剂设计,筛选来控制立体选择性,并且对完全直链的酮底物同样有效的话,那么久非常有趣了。
相关文献推荐
- 这次虽然通过酮羰基与刚性环状结构的结合实现了选择性反应,然而还称不上远端位的区域选择性反应。如果能够通过催化剂的设计,实现酮-催化剂之间,比如氢键相互作用进行导向,实现更远距离的C-H活化的话,那么底物的覆盖面就会变得非常广。而利用非共价键结合相互作用进行区域选择性的C-H官能团化可以参考文献[2]。
参考文献
- Pitts, C. R.; Bume, D. D.; Harry, S. A.; Siegler, M. A.; Lectka. T. J. Am. Chem. Soc.2017, 139, 2208. DOI: 10.1021/jacs.7b00335
- Davis, H. J.; Phipps, R. J. Chem. Sci. 2017, 8, 864. doi:10.1039/C6SC04157D
关联书籍
C-H Bond Activation in Organic Synthesis
- 参考価格¥ 7,966
価格¥ 7,363(2017/12/23 21:52時点) - 出版日2017/11/22
- ペーパーバック328ページ
- ISBN-101138894117
- ISBN-139781138894112
- 出版社CRC Press
New Fluorinated Carbons: Fundamentals and Applications: Progress in Fluorine Science Series
- 参考価格¥ 21,021
価格¥ 20,413(2017/12/23 21:52時点) - 出版日2016/09/27
- 商品ランキング339,313位
- ペーパーバック442ページ
- ISBN-100128034793
- ISBN-139780128034798
- 出版社Elsevier



















No comments yet.