作者:石油醚
导读:
近日,日,美国Emory University的代明骥教授在J. Am. Chem. Soc上,以 “Catalysis-Enabled 13-Step Total Synthesis of (−)-Peyssonnoside A” 为题,报道了通过13步完成了二萜糖苷(−)-Peyssonnoside A的简洁全合成路线设计。其中关键步骤涉及经钯催化的去芳构化环化反应(palladium-catalyzed dearomative cyclization); 氢原子转移(HAT)介导的自由基环化构筑五取代环丙烷(hydrogen atom transfer (HAT)-initiated reductive olefin cross-coupling)。
“Catalysis-Enabled 13-Step Total Synthesis of (−)-Peyssonnoside A
Bo Xu, Chang Liu, and Mingji Dai* J. Am. Chem. Soc., 2022,144,19700-19703.doi: 10.1021/jacs.2c09919”
正文:
天然产物Peyssonnosides A是由美国科学家Kubanek及其同事于2019从红藻Peyssonnelia sp.中分离出来的一类海洋硫酸酯化二萜糖苷 (Figure 1A)[1],并对甲氧西林金黄色葡萄球菌(MRSA)与肝期柏氏疟原虫表现出中等活性,是一种潜在的抗菌药物先导化合物。Peyssonnosides A和B的生物合成途径从Geranylgeranyl diphosphate为起始(图1B)[2],通过一系列阳离子环化、烷基转移和氢转移(3→4→5→6→7)生成C11处有碳正离子中间体(7),而后(7)被烯丙基捕获形成多取代环丙烷(Figure 1B)。直到2021年,Gademann及其同事以(9)为原料[3],通过Simmon-Smith环丙烷化、烯烃关环复分解(RCM)、Robinson annulation、Corey–House cross-coupling以及Schmidt glycosidation等反应,以15步的总步骤完成了Peyssonnoside A的首次全合成(Figure 1C)。
近日,美国Emory University的代明骥教授报道了通过13步完成了二萜糖苷(−)-Peyssonnoside A的简洁全合成路线设计(Figure 1D)。其中关键步骤涉及经钯催化的去芳构化环化 (palladium-catalyzed dearomative cyclization); 氢原子转移(HAT)介导的自由基环化构筑五取代环丙烷 (hydrogen atom transfer (HAT)-initiated reductive olefin cross-coupling)。并发表于J. Am. Chem. Soc上。
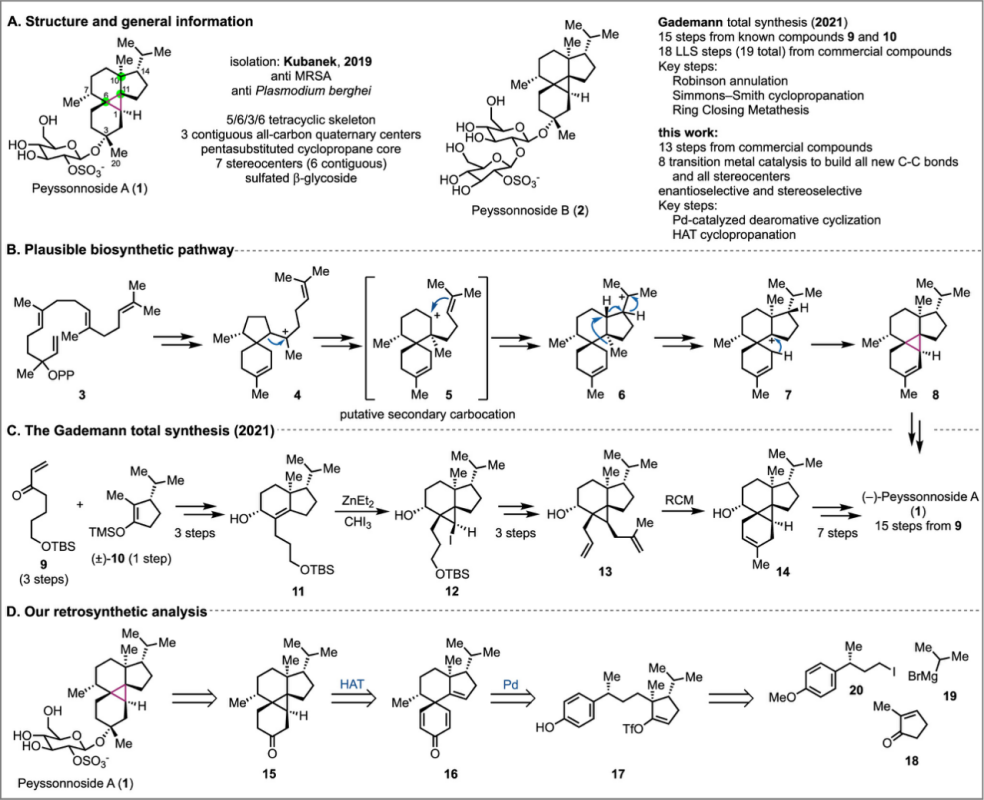
Figure 1. Peyssonnosides, plausible biosynthesis, previous synthesis, and retrosynthetic analysis.
(图片来源于J. Am. Chem. Soc)
Peyssonnosides A和B中均具有独特的5/6/3/6四环骨架,并且两个全碳的五取代环丙烷的骨架尤其为重要。基于上述 (1)的骨架结构,作者对Peyssonnosides A进行了相关的逆合成分析,进而推测出全合成路线设计中的可获得砌块分别为2-甲基环戊烯酮(18)、异丙基格式试剂(19)、烷基碘代物(20)。其具体的逆合成路线是,砌块(18-20)可有构建中间体(17),(17)通过Pd催化的去芳构化获得(16)[6],(16)通过HAT介导的自由基环化即可获得关键的中间体(15)[4-5],(15)发生糖苷化反应即可获得Peyssonnosides A (1)。
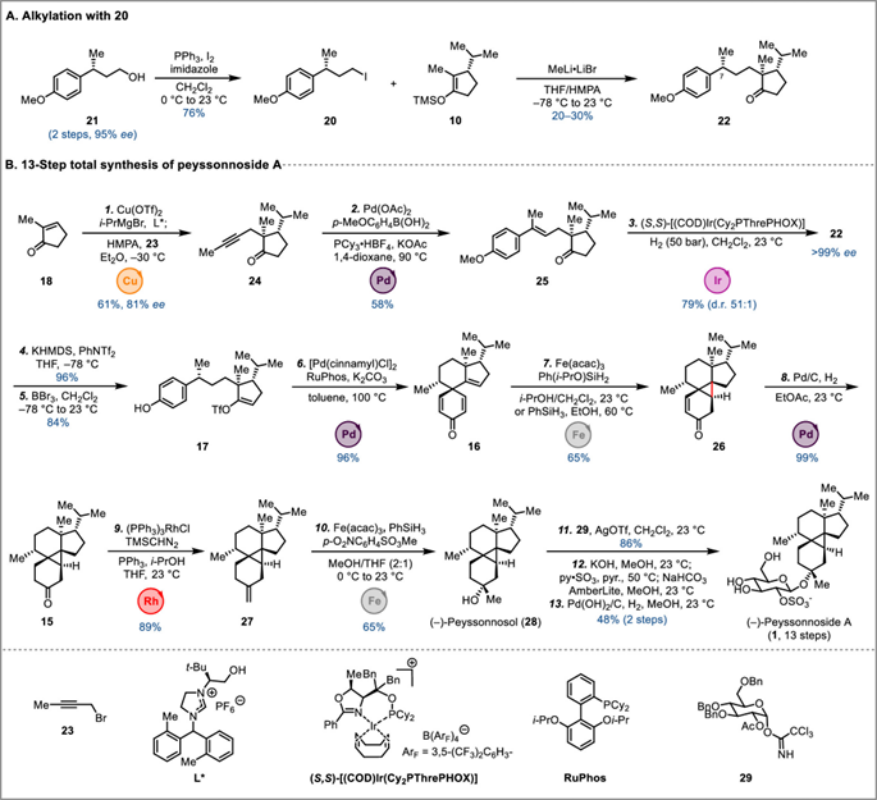
Figure 2. Total synthesis of (−)-peyssonnoside A.
(图片来源于J. Am. Chem. Soc)
该小组完成了(-)- Peyssonnosides A (1) 的对映选择性全合成路线设计,如Figure 2B。

总结,代明骥教授报道了通过13步完成了二萜糖苷(−)-Peyssonnoside A的简洁全合成路线设计(Figure 1D)。其中关键步骤涉及经钯催化的去芳构化环化(palladium-catalyzed dearomative cyclization); 氢原子转移(HAT)介导的自由基环化构筑五取代环丙烷(hydrogen atom transfer (HAT)-initiated reductive olefin cross-coupling)。
参考文献:
- [1] (a) Khatri Chhetri, B.; Lavoie, S.; Sweeney-Jones, A. M.; Mojib, N.; Raghavan, V.; Gagaring, K.; Dale, B.; McNamara, C. W.; Soapi, K.; Quave, C. L.; Polavarapu, P. L.; Kubanek, J. J. Org. Chem. 2019, 84, 8531– 8541, DOI: 10.1021/acs.joc.9b00884. (b) KhatriChhetri, B.; Tedbury, P. R.; Sweeney-Jones, A. M.; Mani, L.; Soapi, K.; Manfredi, C.; Sorscher, E.; Sarafianos, S. G.; Kubanek, J. J. Nat. Prod. 2022, 85, 657– 665, DOI: 10.1021/acs.jnatprod.2c00015
- [2] (a) Tantillo, D. J. Chem. Soc. Rev. 2010, 39, 2847– 2854, DOI: 10.1039/b917107j .; (b) Tantillo, D. J. Nat. Prod. Rep. 2011, 28, 1035– 1053, DOI: 10.1039/c1np00006c.
- [3] Chesnokov, G. A.; Gademann, K. J. Am. Chem. Soc. 2021, 143, 14083– 14088, DOI: 10.1021/jacs.1c07135.
- [4] Lo, J. C.; Yabe, Y.; Baran, P. S. J. Am. Chem. Soc. 2014, 136, 1304– 1307, DOI: 10.1021/ja4117632
- [5]Hioe, J.; Zipse, H. Org. Biomol. Chem. 2010, 8, 3609– 3617, DOI: 10.1039/c004166a
- [6] (a) Du, K.; Guo, P.; Chen, Y.; Cao, Z.; Wang, Z.; Tang, W. Angew. Chem., Int. Ed. 2015, 54, 3033– 3037, DOI: 10.1002/anie.201411817; (b) Mu, X.; Yu, H.; Peng, H.; Xiong, W.; Wu, T.; Tang, W. Angew. Chem., Int. Ed. 2020, 59, 8143– 8147, DOI: 10.1002/anie.202000953 .
- [7] Bernasconi, M.; Ramella, V.; Tosatti, P.; Pfaltz, A. Chem. – Eur. J. 2014, 20, 2440– 2444, DOI: 10.1002/chem.201303915.
- [8] Germain, N.; Guénée, L.; Mauduit, M.; Alexakis, A. Org. Lett. 2014, 16, 118– 121. DOI: 10.1021/ol403104s.
- [9] Liu, Z.; Derosa, J.; Engle, K. M. . J. Am. Chem. Soc. 2016, 138, 13076– 13081, DOI: 10.1021/jacs.6b08818.
- [10] Blankenstein, J.; Pfaltz, A. Angew. Chem., Int. Ed. 2001, 40, 4445– 4447, DOI: 10.1002/1521-3773(20011203)40:23<4445::AID-ANIE4445>3.0.CO;2-V.
- [11] Obradors, C.; Martinez, R. M.; Shenvi, R. A. J. Am. Chem. Soc. 2016, 138, 4962– 4971, DOI: 10.1021/jacs.6b02032.
- [12] Bhunia, A.; Bergander, K.; Daniliuc, C. G.; Studer, Angew. Chem., Int. Ed. 2021, 60, 8313– 8320, DOI: 10.1002/anie.202015740
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.