本文作者 漂泊
顾臻教授是一名智能生物医用材料研发领域的杰出青年研究者。他的主要研究方向有:药物控释,智能生物医用材料及器件,生物芯片技术,新型微纳加工技术及基于交叉学科的高效教学方法探究等。他的团队紧扣药物传递及组织工程的研究前沿,致力于癌症、糖尿病及心脑血管疾病治疗及诊断的新方法、新材料和新器件的研究及其成果转化。顾臻博士不仅仅是一位优秀的青年科学家,他也是一位杰出的创业者。
经历
- 2003年毕业于南京大学化学化工学院化学系;
- 2010年在加州大学洛杉矶分校(UCLA) 获得工学博士学位;
- 2010年获聘于麻省理工学院化工系/Koch癌症复合研究中心、哈佛大学医学院,担任博士后研究员。
- 2012年获聘于北卡大学,建立“生物大分子诊疗工程实验室”,现为美国北卡大学教堂山分校 (UNC-CH) 医学院、药学院,北卡州立大学 (NCSU) 工学院联合生物医学工程系助理教授。
所获荣誉
- 2014年 Top 10 World Changing Ideas for His Work on Batteries to Capture Low-Grade Waste Heat, Scientific American
- 2014年 Ranked No. 1 Worldwide “Hottest Researchers of Today” in Materials Science (Thomas Reuters)
- 2015年 MRS Fred Kavli Distinguished Lectureship in Nanoscience
- 2015年 Fellow of Royal Society of Chemistry
- 2015年 Small Young Innovator Awards
- 2015年 Resonate Award for Sustainability
- 2015年 Inorganic Chemistry Frontiers Award for Young Scientist
- 2015年 剑桥大学首届斯伦贝谢化学专场讲座(Inaugural Schlumberger Chemistry Lectureship, University of Cambridge)
- 2015年被《麻省理工科技评论》(MIT Technology Review) 杂志评为“2015年TR35全球杰出青年创新人物”。
- 2016年 Blavatnik National Award Finalist
- 2016年 Top 10 World Changing Ideas for His Work on Cooling Textile, Scientific American
- 2016年 MRS Fellow
- 2017年 Blavatnik National Laureate in Physical Sciences and Engineering
主要研究工作及学术成就
智能胰岛素贴片
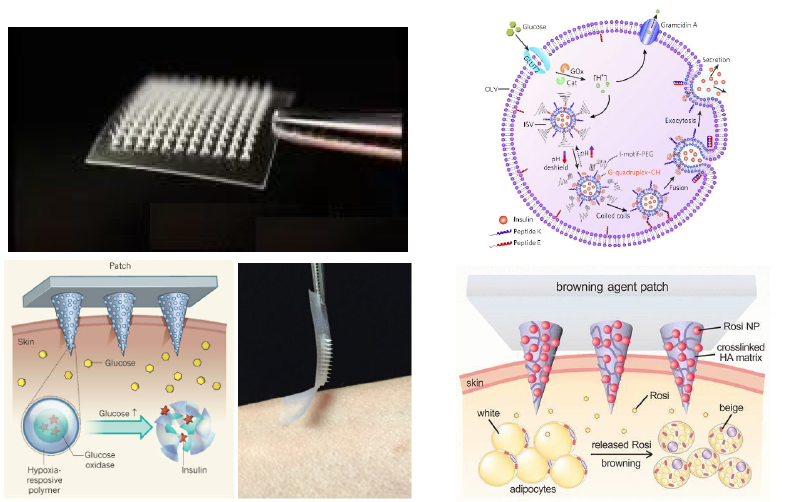
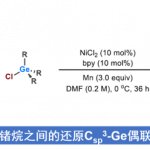
顾臻课题组设计了一种用于治疗糖尿病和肥胖症的智能胰岛素贴片,旨在模拟正常胰岛细胞内储藏胰岛素的囊泡随血糖变化做出快速响应的功能,并能有效防止低血糖的发生。该贴片的的原理是这样的:药物被预先装进直径约为250纳米的纳米颗粒中,然后,这些纳米颗粒被装进包含大量微针(microscopic needles)的一平方厘米大小的贴片上。当被贴到皮肤上时,这些微针会无痛地刺入皮肤中,逐步从纳米颗粒中释放药物到下面的组织中,药物会刺激机体对体内的血糖浓度进行调节。这些纳米颗粒能够有效的保存药物,然而逐渐“瓦解”,以一种持续的方式将药物释放到附近组织中,而不是将药物快速输送至全身。整个“贴片”还可以根据患者的体重和胰岛素敏感性进行个性化定制。
研究人员已经将这种贴片在肥胖的小鼠身上进行了测试。装在纳米颗粒中的化合物是rosiglitazone(Avandia)或β-肾上腺素受体激动剂(CL 316243)中的一种。这两个化合物的作用都是促进褐变(褐变是指白色脂肪组织转化为褐色脂肪组织,褐色脂肪组织更容易被利用、被消耗)。科学家在每只接受治疗的小鼠下腹的两侧贴了两种贴片:一种贴片的纳米颗粒中含有药物,另一种贴片的纳米颗粒中不含药物(简称“空贴片”)。每3天更换一次新贴片,共持续4周。结果发现,不管纳米颗粒中包含哪种药物,与贴“空贴片”的一侧相比,贴“有药贴片”的一侧脂肪都减少了20%。此外,经药物治疗的小鼠的空腹血糖水平也明显低于未治疗的小鼠。这说明该贴片可以增加机体总的新陈代谢,促进脂肪的消耗,可以用于减肥。
智能胰岛素贴片原理及结构示意图
代表性论文
- [1]Zhang Y, Wang J, Yu J, et al. Bioresponsive Microneedles with a Sheath Structure for H2O2 and pH Cascade‐Triggered Insulin Delivery[J]. Small, 2018, 14(14): 1704181.
- [2]Liu M, Shen S, Wen D, et al. Hierarchical Nanoassemblies-Assisted Combinational Delivery of Cytotoxic Protein and Antibiotic for Cancer Treatment[J]. Nano letters, 2018, 18(4): 2294-2303.
- [3] Chen Z, Wang J, Sun W, et al. Synthetic beta cells for fusion-mediated dynamic insulin secretion[J]. Nature chemical biology, 2018, 14(1): 86.
- [4] Gu C, Nguyen H N, Ganini D, et al. KO of 5-InsP7 kinase activity transforms the HCT116 colon cancer cell line into a hypermetabolic, growth-inhibited phenotype[J]. Proceedings of the National Academy of Sciences, 2017: 201702370.
- [5] Bakh N A, Cortinas A B, Weiss M A, et al. Glucose-responsive insulin by molecular and physical design[J]. Nature chemistry, 2017, 9(10): 937.
参考文献
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

































No comments yet.