(本文投稿作者 桃花妖)
在2016年7月,山东大学的李福川教授在Chemical Science上发表了关于细胞表面糖蛋白成像的研究成果,研究很有新意,也颇有发展前景,下面就对这项工作进行介绍。
糖蛋白的标记
蛋白质糖基化是一种重要的翻译后修饰过程,对糖蛋白进行标记,有助于理解众多的生理过程和病理过程。特别是在细胞表面的糖蛋白,更是参与细胞通讯,肿瘤发生等过程。由于多糖本身不含可视化基团,利用荧光基团对进行多糖的标记成为一个重要的研究方法。
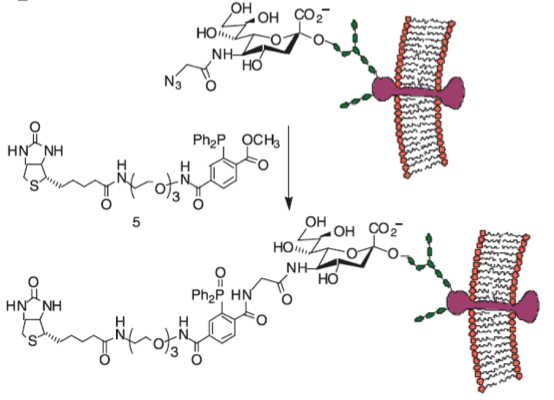
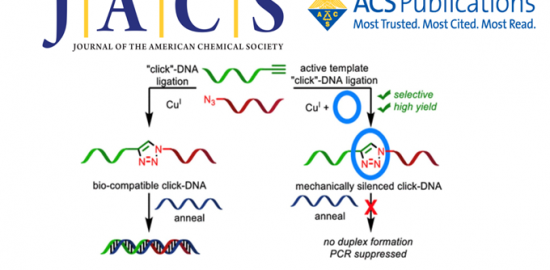
在一系列对糖进行标记的方法中,利用叠氮糖进行标记是一类被广泛研究的策略。该方法先合成含有叠氮基团的糖类(唾液酸)衍生物,之后使其转运到膜蛋白上,通过偶联荧光基团或其他可探测基团使这一复合物可以检测到。
叠氮糖的毒性
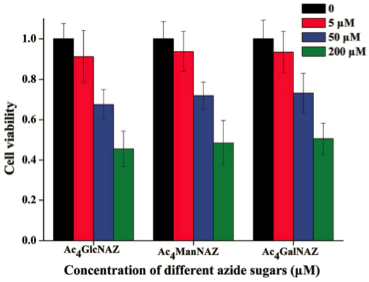
叠氮糖作为重要的化合物在蛋白质标记和细胞成像中已经广泛应用,但是叠氮糖是具有细胞毒性的。使用三种不同的叠氮糖(Ac4GlcNAz, Ac4ManNAz, Ac4GalNAz)对B16细胞进行培养,在不同浓度下均影响到了细胞的生长。因此,在进行细胞成像的使用时,需要控制叠氮糖的浓度。
对于一些表达水平比较低的蛋白,需要叠氮糖的量就会更高,这不利于细胞的生长,因此需要一种更好的策略,在保证荧光强度的同时降低叠氮糖的用量。
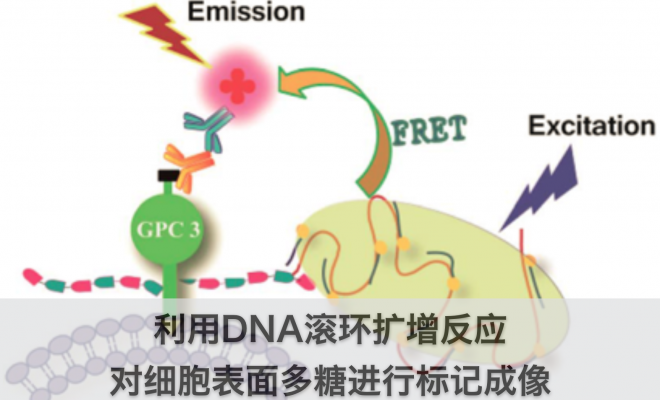
基于DNA扩增的新策略
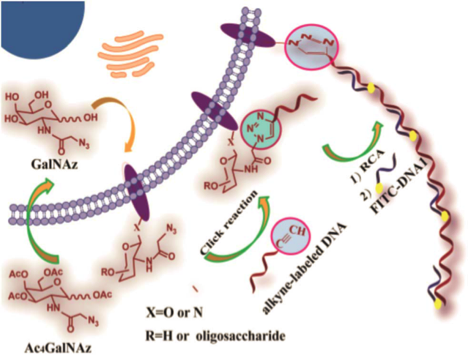
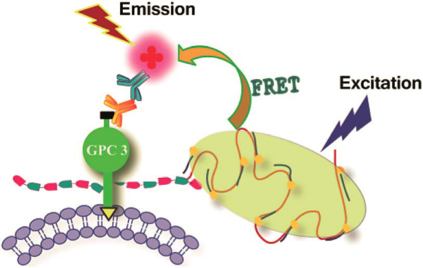
在这项工作中,一个新的策略被设计出来。叠氮基团整合进入多糖,与炔官能化的DNA进行Click反应。偶联后的DNA复合物可以启动在聚合酶存在下的RCA(滚环扩增)反应,产生长串联重复序列。产物与大量荧光杂交检测探针结合可以产生高强度的荧光。由于这个过程是一个级联放大的过程,因此需要的叠氮糖的量大大减少。
与FRET(荧光能量共振转移)共同应用
FRET是一种重要的技术,当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10nm范围以内时,就会发生一种非放射性的能量转移,即FRET现象,使得供体的荧光强度比它单独存在时要低的多,而受体发射的荧光却大大增强。该方法能够帮助确定靶蛋白,也可以用来寻找蛋白质相互作用的关系。
当供体荧光比较弱的时候,是很难激发出受体的荧光的,在这种情况下,此项工作提出的策略就有很大的优势了。提高了荧光强度之后,可以在原来不能产生FRET的情况下产生FRET。在此项工作中,已经证明了利用这种策略和FRET来确认蛋白的可能性。
该方法的优势
在此,我们可以总结一下这个方法的优势。概括起来,就是利用更少的叠氮糖用量来达到更高的荧光强度,以此来完成更精确的监测。特别是由于细胞膜表面糖蛋白往往含量比较低,利用这种策略和抗体的联用,能够通过FRET现象确认膜蛋白的种类和分布。当然,由于引入了DNA和聚合酶参与这个过程,使得操作步骤变得复杂,不过在糖蛋白丰度比较低时,还是很值得应用此方法来提高荧光强度。总之,这种方法特别适合低丰度的糖蛋白检测,甚至使单分子糖蛋白检测有可能实现。
参考文献
- Fuchuan Liet al, Chem. Sci., 2016, 7, 6182
- E.Saxon and C. R. Bertozzi, Science, 2000, 287, 2007–2010.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.