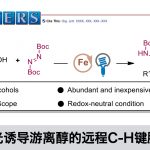
烯丙基位置的新的C-H偶联的新报道。通过使用Cp*Rh(Ⅲ)络合物的脱氢交叉偶联,可以将芳香杂环引入烯丙基位。
烯丙基位的C-H官能化
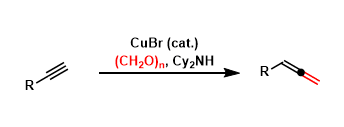
由于未活化的C(sp3)-H键在有机化合物中普遍存在,因此这些键的直接官能化可以进一步缩短步骤数,并且具有原子效率高的优势[1]。其中,对烯丙基位置C(sp3)-H的活化反应进行了深入研究,并开发了如烯丙基位的胺化[2],氧化[3]和烷基化[4]反应。另一方面,烯丙基位C(sp3)-H键的芳基化却很少报道,其应用范围也很窄。以前仅可使用已经官能化的底物(芳基格氏反应物/氰基芳族化合物)或仅使用多氟化芳族化合物(5)(图1A)。
这一次,明斯特大学的Glorius教授成功地利用铑催化剂开发了烯丙基位置的直接杂芳基化反应(图1B)。它能够实现烯烃和杂芳基(呋喃,噻吩,吡咯和苯并噻吩)的脱氢交叉偶联,而无需对两种底物进行预功能化。
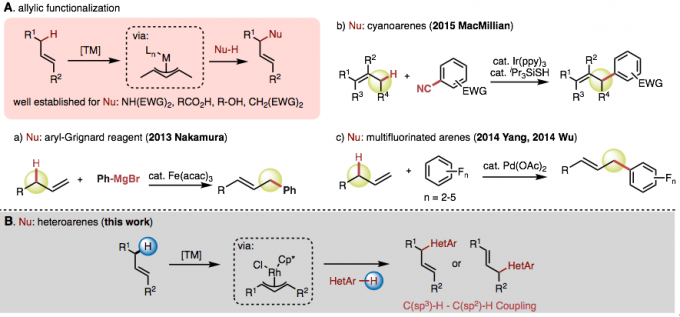
图1. 常规的烯丙基C-H活化反应和这次要介绍的反应
“Non-Directed Cross-Dehydrogenative (Hetero)arylation of Allylic C(sp3)–H bonds enabled by C–H activation”
Lerchen, A.; Knecht, T.; Koy, M.; Ernstz, B. J.; Bergander, K.; Daniluc, G, C.; Glorius, F. Angew. Chem., Int. Ed. 2018, early view
论文作者介绍

研究者:Frank Glorius
研究者的经历:
1997-2000 Ph.D., University of Basel and Max-Planck-Institute (Prof. D. A. Pfaltz)
2000-2001 Posdoc., Harvard University (Prof. D. A. Evans)
2001-2004 Independent research., the Max-Planck-Institute (Prof. A. Fürstner)
2004-2007 C3-Professor for Organic Chemistry., University of Marburg
2007- Full Professor for Organic Chemistry., Westfälische Wilhelms-Universität Münster
研究内容:C–H活性化反応、光レドックス触媒、Mechanism-Based Screening、NHC触媒を用いた不斉合成
论文概要
在该反应中,烯丙基化合物和杂芳族化合物的脱氢交叉偶联在[Cp*RhCl2]2,添加剂AgBF4和2当量的氧化剂AgOAc存在下进行,得到产物。各种杂芳族化合物和烯丙基化合物如噻吩,呋喃和吡咯可以应用于该反应(图2A),其对诸如烷基,卤素,给电子基团,吸电子基团等官能团兼容性也很好。另外该反应还可以应用于最终合成阶段的功能化(参见论文)。
作者进行了以下实验以阐明该反应的反应机理(图2B)。 首先,通过烯丙基化合物1a和1b以及杂芳烃2a来进行该反应。结果,仅形成3a作为偶联体,并且没有产生结构异构体3b。另外,从1a预先制备铑-烯丙基配合物4,并与烯丙基化合物2b反应,由此制备偶合体3c。从这一事实可以看出,该反应不是通过像Shigaraki-Heck反应那样涉及β-氢消除的反应机理而是通过铑-π-烯丙基络合物的机理进行的。
由此,烯丙基C(sp3)-H键和杂芳烃C(sp2)-H键的脱氢交叉偶联反应被开发。由于该反应不需要基质的初步官能化,因此可以预期其可用于药物等后期的官能化。
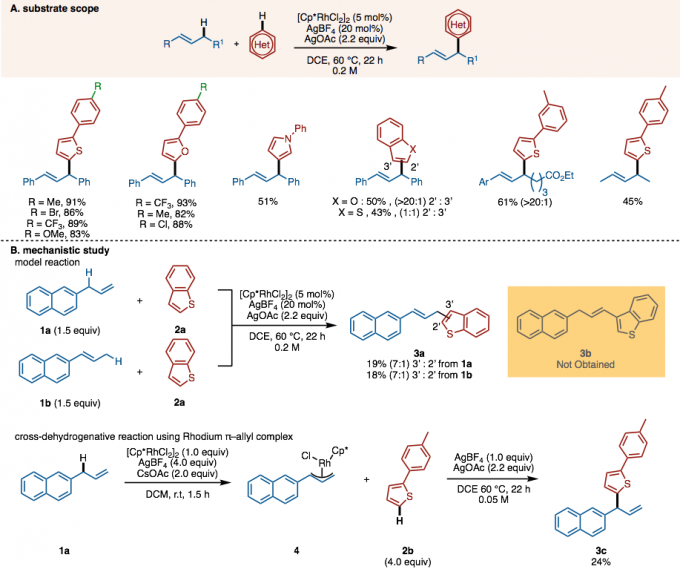
图2. (A)底物适用范围 (B)反应机理解析
参考文献
- Jazzar, R.; Hitce, J.; Renaudat, A.; Sofack-Kreutzer, J.; Baudoin, O. Chem, Eur. J. 2010, 16, 2654. DOI: 10.1002/chem.200902374
- For recent example: Ma, R.; White, M. C. Am. Chem. Soc. 2018, 140, 3202. DOI: 10.1021/jacs.7b13492
- For recent example: Li, C.; Li, M.; Li, J.; Liao, J.; Wu, W.; Jiang, H. J. Org. Chem.2017, 82, 10912. DOI: 10.1021/acs.joc.7b01729
- For recent example: Hu, R.-B.; Wang, C.-H.; Ren, W.; Liu, Z.; Yang, S.-D. ACS Catal. 2017, 7, 7400. DOI: 1021/acscatal.7b02965
(a) Sekine, M.; Ilies, L.; Nakamura, E. Org. Lett.,2013, 15, 714. DOI: 10.1021/ol400056z(b) Cuthbertson, J. D.; MacMillan, D. W. C. Nature 2015, 519, 74. DOI: 10.1038/nature14255. (c) Wang, G. -W.; Zhou, A.-X.; Li, S.-X.; Yang, S.-D. Org. Lett. 2014, 16, 3118. DOI: 10.1021/ol501247b.(d)Jiang,H.; Yang, W.; Chen, H.; Li, J.; Wu, W. Chem. Commun., 2014, 50, 7202. DOI: 10.1039/c4cc02023e
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.