作者:杉杉
导读:
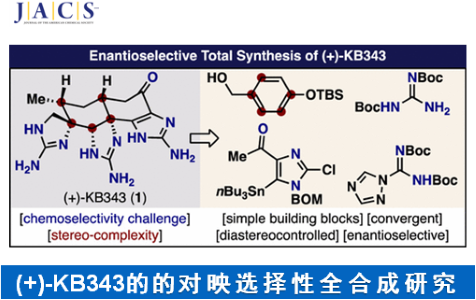
近日,美国Scripps 研究所的P. S. Baran小组成功完成天然产物KB343的一种全新的对映选择性全合成路线设计。其中,关键步骤主要涉及N-协助的二烯酮合成与去对称化 (N-assisted dienone synthesis and desymmetrization)、Nb-催化的SN1取代、大位阻胺参与的差向异构化 (hindered amine epimerization)、离子液体促进的SNAr反应 (ionic-liquid-enabled SNAr)以及反荷离子协助的非对映选择性后期氢化 (counterion-assisted diastereoselective late-stage hydrogenation)。
Enantioselective Total Synthesis of (+)-KB343
C.Bi, Y.Wang, C. He, P. Baran, J. Am. Chem. Soc. 2023, ASAP. doi: 10.1021/jacs.3c01991.
正文:
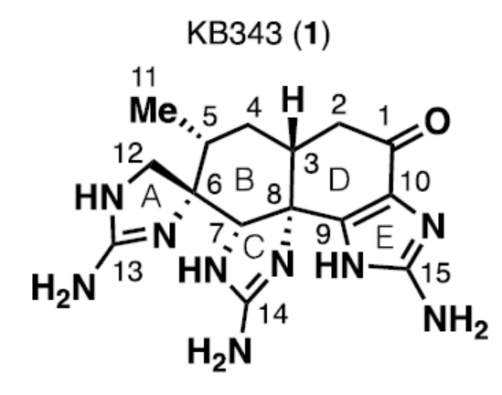
KB343 (1, Figure 1)是由海洋动物Epizoanthus illoricatus中分离出的一种生理活性天然产物。目前,KB343的全合成路线设计已经逐渐受到诸多研究团队的广泛关注[1]–[3]。这里,美国Scripps 研究所的P. S. Baran小组成功设计出天然产物KB343的一种全新的对映选择性全合成路线。
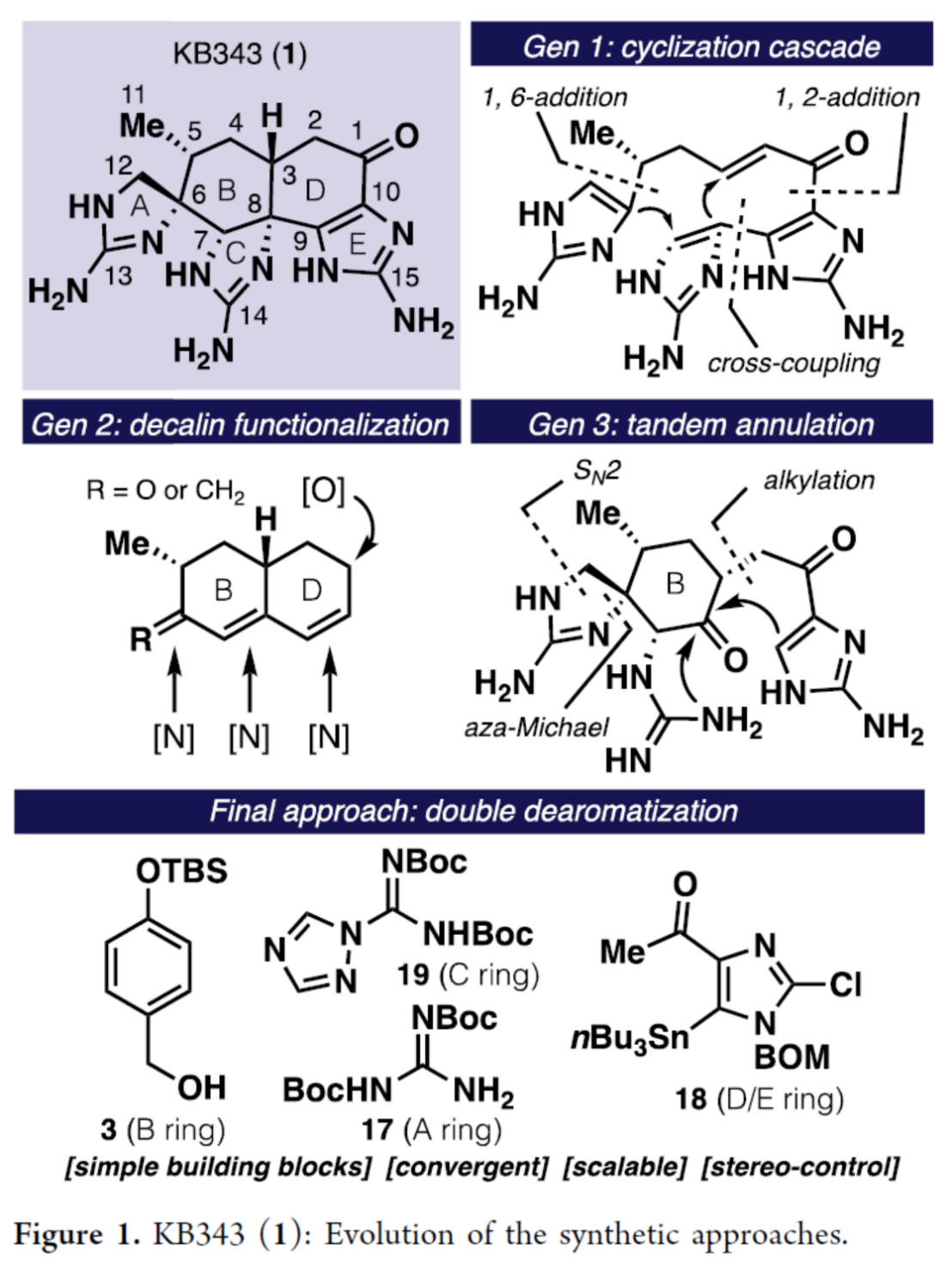
该小组首先进行KB343 (1)外消旋体的全合成路线设计 (Scheme 1)。
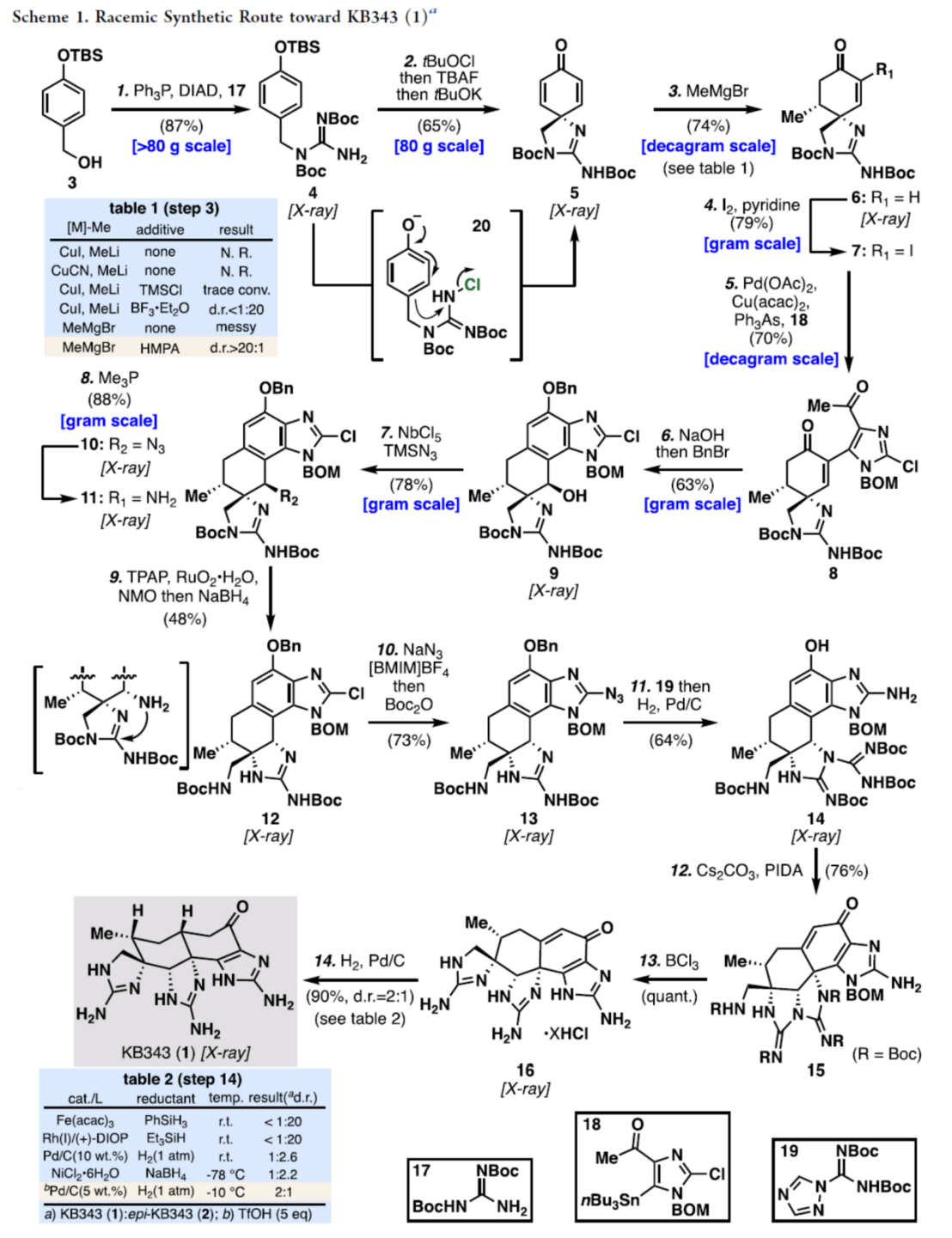

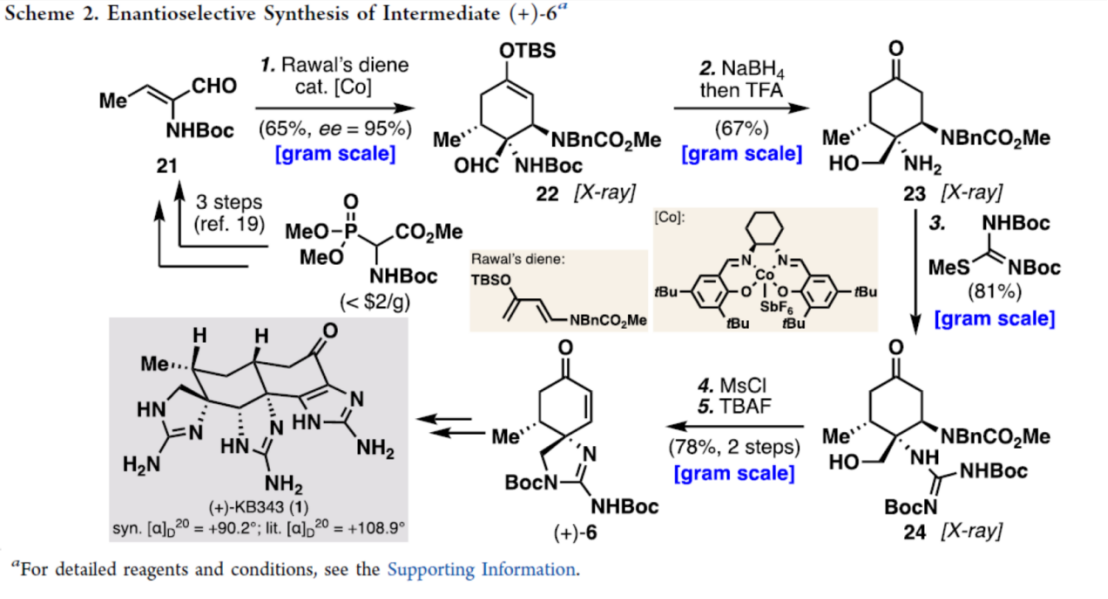
之后,该小组进一步完成 (+)-KB343 (1)的对映选择性全合成路线设计 (Scheme 2)。

总结:
美国Scripps 研究所的P. S. Baran小组成功实现天然产物KB343的一种全新的对映选择性全合成路线设计。这一全合成路线设计中的关键步骤主要涉及:N-协助的二烯酮合成与去对称化、Nb-催化的SN1取代、大位阻胺参与的差向异构化、离子液体促进的SNAr反应以及反荷离子协助的非对映选择性后期氢化。
参考文献:
- [1] Y. Kanda, Y. Ishihara, N. C. Wilde, P. S. Baran, J. Org. Chem. 2020, 85, 10293. doi:10.1021/acs.joc.0c01287.
- [2] Y. Ishihara, P. S. Baran, Synlett 2010, 12, 1733. doi:10.1055/s-0030-1258123.
- [3] (a) R. A. Shenvi, D. P. O’Malley, P. S. Baran, Acc. Chem. Res. 2009, 42, 530. doi:10.1021/ar800182r. (b) S. A. Green, S. W. M. Crossley, J. L. M. Matos, S. Vaśquez-Ceśpedes, S. L. Shevick, R. A. Shenvi, Acc. Chem. Res. 2018, 51, 2628. doi: 10.1021/acs.accounts.8b00337.
- [4] R. A. Rodriguez, C. Pan, Y. Yabe, Y. Kawamata, M. D. Eastgate, P. S. Baran, J. Am. Chem. Soc. 2014, 136, 6908. doi: 10.1021/ja5031744.
- [5] (a) Sibi, M. P. Manyem, S. Tetrahedron 2000, 56, 8033. doi: 10.1016/S0040-4020(00)00618-9. (b) Woodward, S. Chem. Soc. Rev. 2000, 29, 393. doi: 10.1039/B002690P. (c) B. Breit, Y. Schmidt, Chem. Rev. 2008, 108, 292. doi: 10.1021/cr078352c.
- [6] (a) F. E. S. Souza, H. S. Sutherland, R. Carlini, R. A. Rodrigo, J. Org. Chem. 2002, 67, 6568. doi: 10.1021/jo020081c. (b) S. Stavber, M. Jereb, M. Zupan, Synthesis 2008, 2008, 1487. doi: 10.1055/s-2008-1067037.
- [7] J. S. Yadav, D. C. Bhunia, K. V. Krishna, P. Srihari, Tetrahedron Lett. 2007, 48, 8306. doi: 10.1016/j.tetlet.2007.09.140.
- [8] (a) N. L. Magann, E. Westley, M. J. Sowden, M. G. Gardiner, M. S. Sherburn, J. Am. Chem. Soc. 2022, 144, 19695. doi: 10.1021/jacs.2c09804. (b) A. R. Healy, K. M. Wernke, C. S. Kim, N. R. Lees, J. M. Crawford, S. B. Herzon, Nat. Chem. 2019, 11, 890. doi: 10.1038/s41557-019-0338-2.
- [9] (a) S. Quideau, L. Pouysegu, D. Deffieux, Synlett 2008, 467. doi: 10.1055/s-2008-1032094. (b) M. N. Aziz, R. P. Singh, D. Gout, C. J. Lovely, Tetrahedron Lett. 2021, 72, 153054. doi: 10.1016/j.tetlet.2021.153054.
- [10] Y. Huang, T. Iwama, V. H. Rawal, J. Am. Chem. Soc. 2000, 122, 7843.doi: 10.1021/ja002058j.
- [11] M. J. Burk, N. B. Johnson, J. R. Lee, Tetrahedron Lett. 1999, 40, 6685. doi: 10.1016/S0040-4039(99)01376-3.
- [12] Y. Huang, T. Iwama, V. H. Rawal, J. Am. Chem. Soc. 2002, 124, 5950. doi: 10.1021/ja026088t.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载














No comments yet.