概要
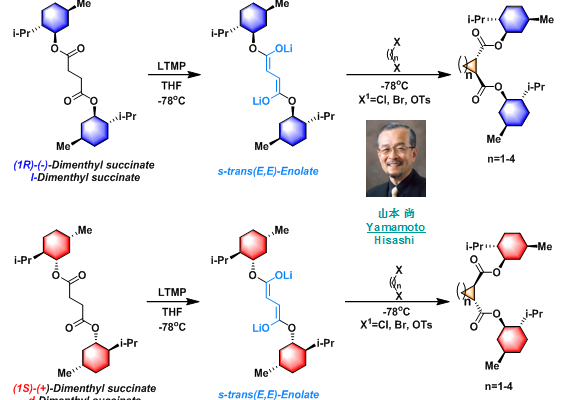
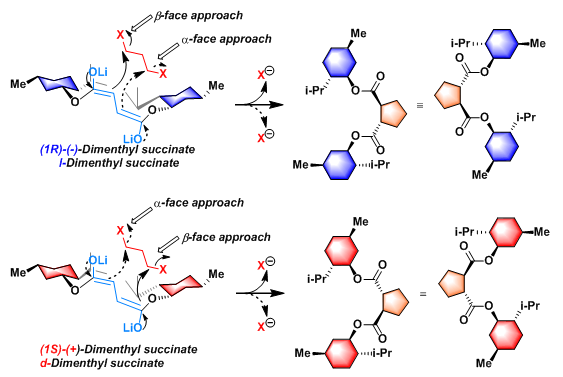
Yamamoto不对称碳环化(Yamamoto asymmetric carbocyclization)是(1S)-(+)-琥珀酸二薄荷酯( (1S)-(+)-Dimenthyl succinate, d-Dimenthyl succinate)或(1R)-(-)-琥珀酸二薄荷酯( (1R)-(−)-Dimenthyl succinate, l-Dimenthyl succinate)与1 ,ω-二卤代烷在LTMP作用下发生的不对称碳环化过程,形成3-6元环的反应。该反应在1985年由日本名古屋大学(Nagoya Univeisity)应用化学系的山本尚( Hisashi Yamamoto)研究组首次报道。采用(1R)-(-)-琥珀酸二薄荷酯,将获得S,S-构型的环化产物(84%-99% de);采用(1S)-(+)-琥珀酸二薄荷酯,将获得R,R-构型的环化产物(84%-99% de)。该反应具有优良的对映及非对映选择性,已广泛应用于各类天然产物的全合成及各类手性配体的合成。
基本文献
- [1] A. Misumi, K. Iwanaga, K. Furuta, H. Yamamoto, J. Am. Chem. Soc. 1985, 107, 3343. doi: 10.1021/ja00297a048.
- [2] K. Furuta, A. Misumi, A. Mori, H. Yamamoto, Tetrahedron Lett. 1984, 25, 669. doi: 10.1016/S0040-4039(00)99967-2.
- [3] A. Misumi, K. Furuta, H. Yamamoto, Tetrahedron Lett. 1984, 25, 671. doi: 10.1016/S0040-4039(00)99968-4.
- [4] K. Furuta, N. Ikeda, H. Yamamoto, Tetrahedron Lett. 1984, 25, 675. doi: 10.1016/S0040-4039(00)99969-6.
反应机理
反应实例
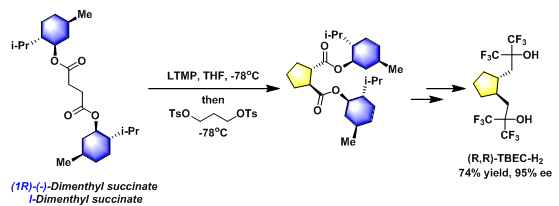
手性配体(R,R)-TBEC-H2的合成[1]
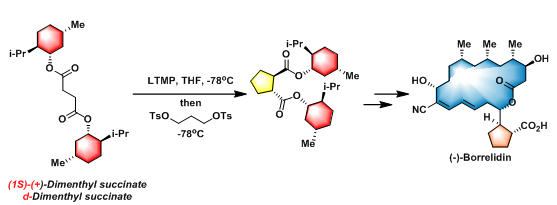
(−)-Borrelidin的全合成[2]
实验步骤
在-20 °C,氩气气氛下,将2,2,6,6-四甲基哌啶(2.5 eq.)的无水THF(0.7 M)溶液滴加至正丁基锂的正己烷(1.6 M, 2.5 eq.)溶液中,并将上述反应混合物搅拌20 min。后将上述反应液冷却至-78 °C,再加入光学纯度的琥珀酸二薄荷酯 (1.2 eq.)的无水THF (1.01 M)溶液,并维持在-78 °C下搅拌1 h。将产生的双烯醇负离子溶液滴加到1,3-丙二醇二对甲苯磺酸酯(1 eq.)的无水THF (0.85 M)溶液中。将上述反应液在-78oC下搅拌3 h后,加入2-甲基丙醛(3.6 mL)淬灭过量的烯醇负离子。再将上述反应液中加入用冰冷却的1 M HCl淬灭反应,并采用乙醚萃取。合并的乙醚相采用无水硫酸镁干燥,真空除去溶剂。将浓缩液通过短硅胶柱除去极性副产物(正己烷/EtOAc 40/1 v/v),再将滤液浓缩,并进一步通过硅胶柱色谱(230-400目,正己烷/EtOAc 40/1 v/v)进行分离纯化,获得最终目标产物。
实验技巧
参考文献
- [1] O. Fujimura, F. J. de la Mata, R. H. G rubbs, Organometallics 1996, 15, 1865. doi: 10.1021/om950724x.
- [2] T. Nagamitsu, D. Takano, T. Fukuda, K. Otoguro, I. Kuwajima, Y. Harigaya, S. Ōmura, Org. Lett., 2004, 6, 1865. doi: 10.1021/ol049356w.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.