本文作者:杉杉
导读
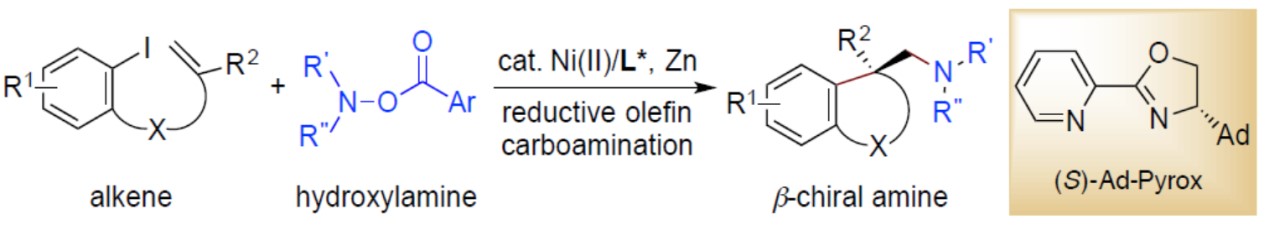
近日,南京大学朱少林教授课题组在Angew发表论文,通过使用手性吡咯-镍配合物作为催化剂,实现烯烃系的芳基碘化物和邻苯甲酰基羟胺的对映选择性还原1,2-碳氨化反应,合成多种高收率、高对映选择性的芳基取代β-手性胺。此外,与Pd和Cu催化文献相比(合成α-手性胺),该反应作为合成手性胺的互补方法。文章链接 DOI:10.1002/anie.201913743
正文
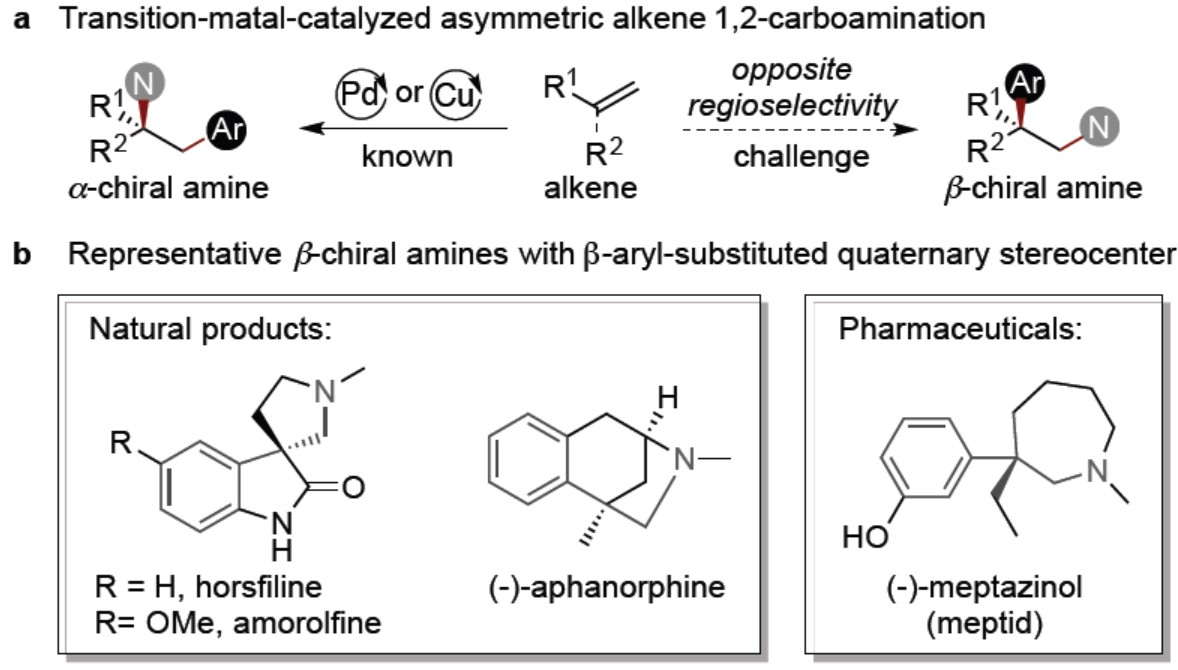
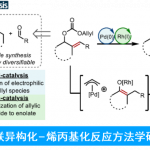
烯烃常作为各类化学反应中起始原料,如氢化、加氢官能化、双官能化等。过渡金属催化烯烃的不对称双官能化反应(同时将两个官能团以对映选择性的方式引入C=C双键上),是作为合成复杂分子和手性结构单元的有效手段。Pd和Cu催化不对称烯烃1,2-碳氨基化已被文献报道,但仅以高区域选择性产生α-手性胺。相反的,通过其它催化剂,实现不对称碳氨化反应获取β-手性胺仍具有挑战(Figure 1a)。最近,通过Pd与Cu催化烯烃合成β-手性胺也被报道,但仅获得中等ee的手性胺,同时烯烃仅限于二氢呋喃和环丙烯两个底物。此外,β-手性胺常存在一些药物和天然产品中,而β-位具有芳基取代的季碳也作为一类代表,通过对映选择性烯烃1,2-碳氨化反应,同时引入芳基和氨基基团成合成β-手性胺有待开发(Figure 1b)。
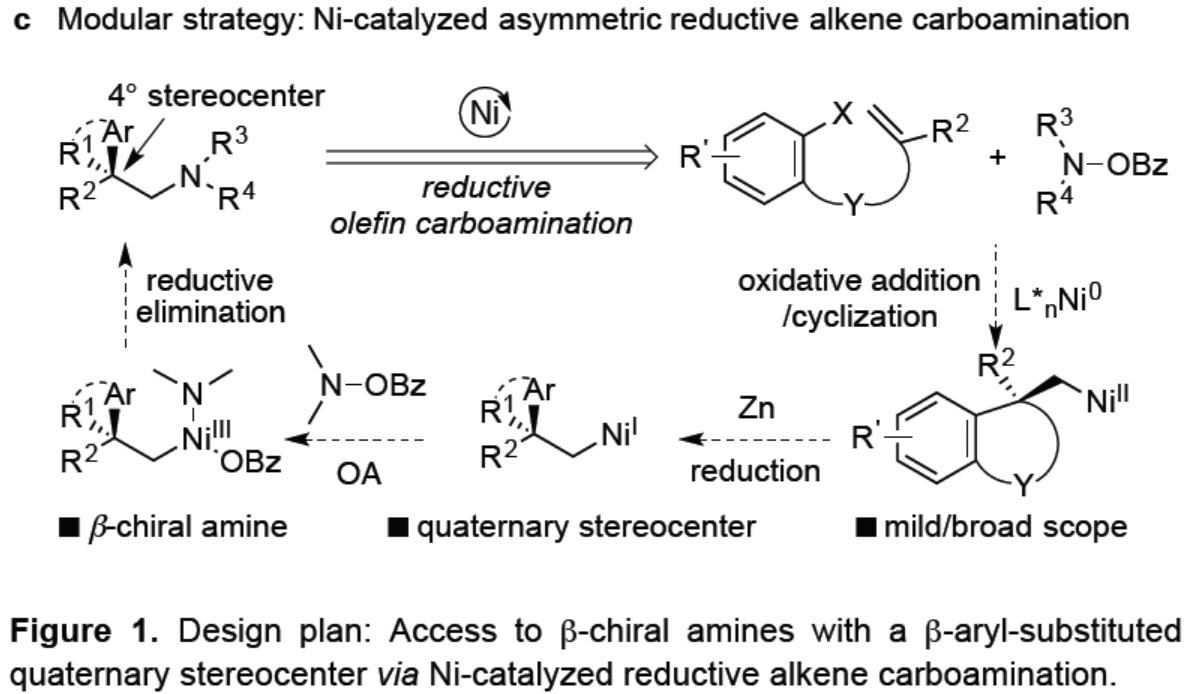
尽管在过去十年中,镍已在交叉偶联反应中得到广泛应用,但很少报道了Ni催化对映选择性的烯烃双官能化反应。为了实现不对称1,2-碳氨化反应,作者假设亲电子氮源(O-苯甲酰基-羟胺)可与另一种亲电子芳基卤一起使用,进行还原性烯烃碳氨化反应,生成β-芳基取代的手性胺。作者设想,首先通过用镍催化实现芳基碘化物的氧化加成生成芳基镍(II)中间体,随后进行分子内不对称的环化反应,在邻位具有四碳中心的烷基镍(II)物种,通过Zn还原得到烷基镍(I)中间体,再经亲电子胺化反应,还原消除即可引入所需的胺(Figure 1c)。O-苯甲酰基-羟胺应满足两个要求:①分子内环化必须快速;②O-苯甲酰基-羟胺必须足够稳定以免在还原条件下分解。
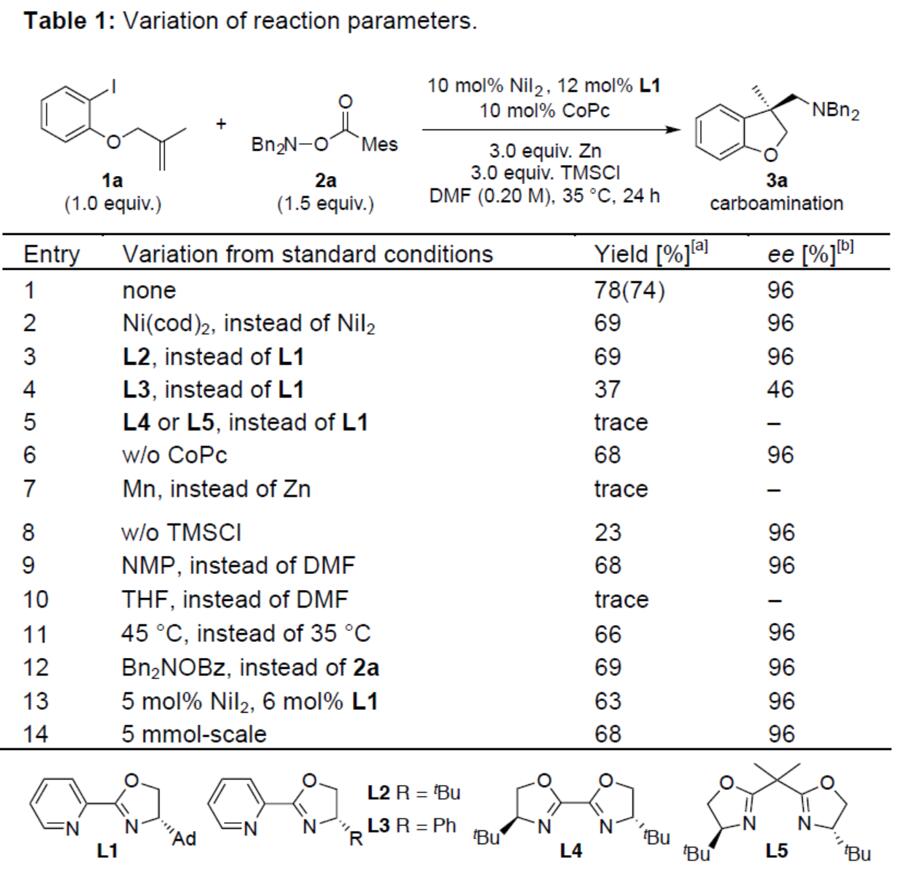
首先,作者以1a与2a作为模型底物,经过大量的条件筛选发现(镍源、配体、还原剂、添加剂、溶剂、温度等),在温和条件下,使用Ni/pyrox催化剂,获得74%分离产率和96%ee的β-手性胺(3a)(entry 1)。而使用其他镍催化剂(如Ni(cod)2),产量略有降低,ee不变(entry 2)。结构相似的L2和L3配体收率较低,L4或L5配体只能获得痕量的产物(entries 3-5)。助催化剂酞菁钴(II)(CoPc)的使用(entry 6)以及TMSC1作为添加剂时(entry 8),收率明显提高,而使用Mn代替还原剂Zn仅获得少量产物(entry 7)、NMP和THF作为溶剂时(entries 9-10)、温度的改变(entry 11)、其他胺化试剂的使用(entry 12),收率都有所降低。最后,作者对催化量进行优化,发现降低催化剂摩尔量,产量略有下降,但ee不变(entry 13)。此外,将底物放大至5mmol,依据取得较好的结果(entry 14)。
在获得上述最佳反应条件后,作者开始对底物进行了扩展(Table 2)。首先,作者对各种烷基醚化芳基碘化物1进行研究,芳基环上含有给电子(1b–1e)和吸电子(1f–1i)基时,均获得高收率和高对映选择性的手性胺产物。此外,芳基溴(1g)的底物同样能够实现上述结果,可用于进一步衍生化反应。而使用直链(1j–1l和1n–1p)和支链(1m)的烷基取代的烯烃时,由于位阻导致ee略低。一些包含多种官能团的烯烃底物也同样适用于此体系,如呋喃(1n)、醚(1o,1p)和烯烃(1p)。此外,全碳链(1q–1t)的烯烃也取得了预期的结果。
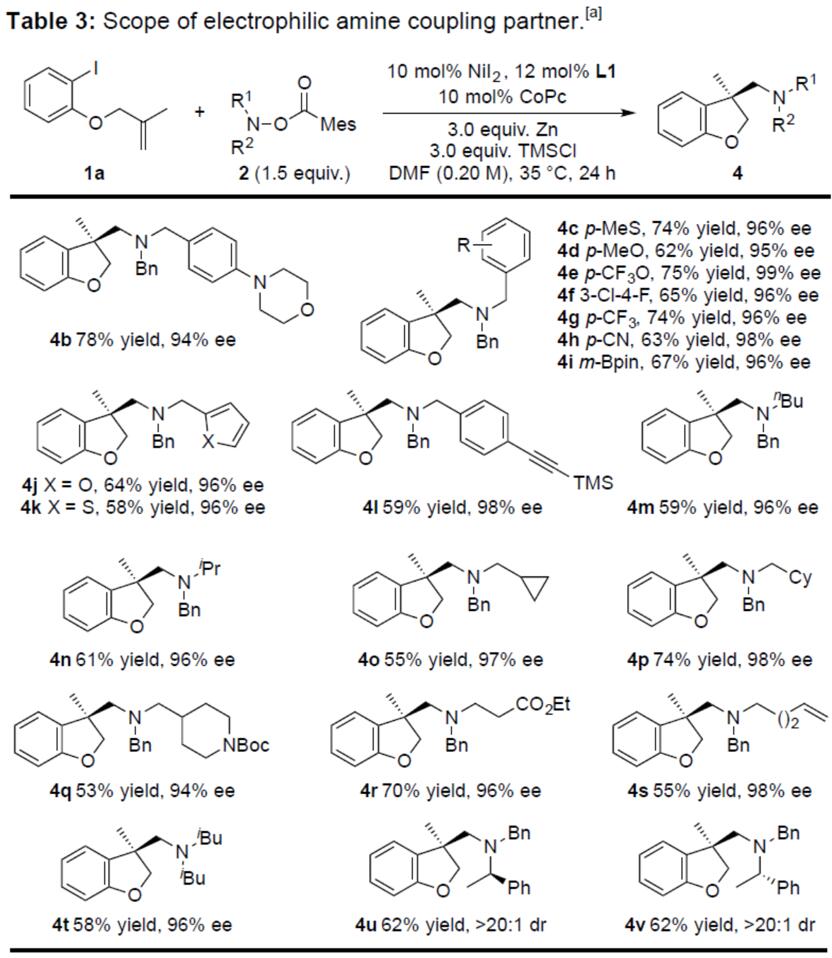
随后,作者对羟胺酯底物进行了研究(Table 3)。在大多数情况下,使用苄基保护的羟胺酯,可在后期很容易脱保护得到相应的伯胺和仲胺。一些常见的官能团,如苯胺(4b)、醚(4b,4d和4e)、硫醚(4c)、腈(4h)、硼酸频哪醇酯(4i)、呋喃(4j)、噻吩(4k)、炔烃(4l)、Boc氨基甲酸酯(4q)、酯(4r)、烯烃(4s)等均与体系兼容。这些产物中,4i和4f能够保持基团的完整性,可用于进一步衍生化反应。值得注意的是,具有位阻更大的胺化试剂,如4u、4v,
同样具有良好的耐受性,并且胺化试剂中邻位立体中心不受影响(4v)。
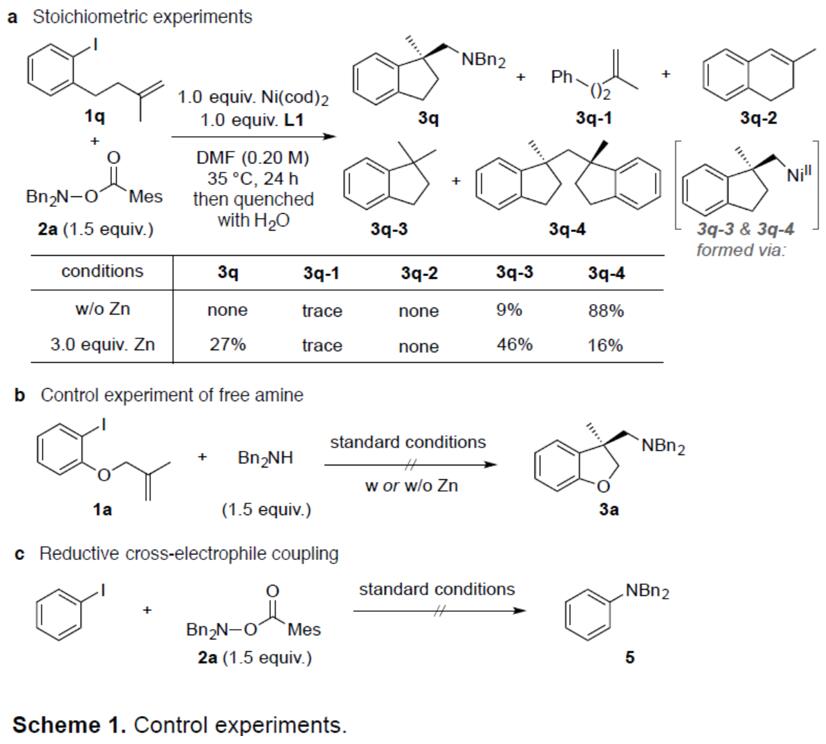
最后,作者对反应机理进行了进一步的研究(Figure 1c),并通过相关的对照实验进一步证明机理的正确性。当使用化学计量的Zn0时,已知芳基镍(II)和烷基配合物都还原为相应的镍(I)物质,作者试图确定,该还原过程发生在环化之前或之后(Scheme 1a)。因此,化学计量的的镍(0)也被应用。此外,在没有锌还原剂时,氨化过程中烷基镍(I)中间体和环化副产物(3q–3和3q–4)也能被观察到。因此,锌还原剂对于形成所需的碳氨化产物至关重要。最后,作者提出了芳基镍(II)的分子内迁移插入链烯和还原过程,发生在环化之后。为了进一步了解胺化过程,作者使用游离仲胺时,未观察到所需的碳氨化产物(3a),因此排除仲胺对潜在烷基碘中间体的SN2亲核取代反应(Scheme 1b)。此外,在标准条件下,使用O-苯甲酰基-羟胺与芳基碘化物在标准条件下反应时,未观察到苯胺产物(5)(Scheme 1c),这表明该系统中未形成芳基镍(I)。
总结
南京大学朱少林教授课题组报道了一种实用且有效的还原性1,2-碳氨化方法,合成多种高收率、高对映选择性的芳基取代β-手性胺。此外,与Pd和Cu催化文献相比(合成α-手性胺),该反应作为合成手性胺的互补方法。同时该方法具有底物适用性广泛、条件温和、产率优良等优点。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.