译自Chem-Station网站日本版 原文链接:O-脱メチル化・脱アルキル化剤 基礎編
翻译:炸鸡 校对: 肥猫
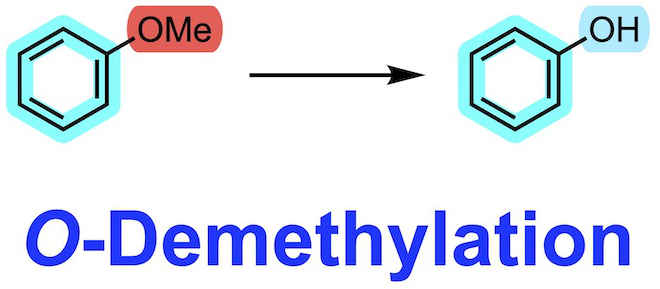
如何将甲氧基转化成羟基一直是合成化学上的一个难题。虽然甲氧基和烷氧基作为保护基来说并不能算是很便利的保护基,但如果是想用相对廉价的试剂进行合成工作的话,甲氧基和烷氧基保护基不失为一个好选择,那么这样的话就必须得考虑甲氧基和烷氧基的脱除了。
甲氧基虽然是个廉价的保护基,但脱甲基化反应尽量在合成路线的初级阶段进行,尽量用其他的保护基替换比较好。
01. 三溴化硼BBr3
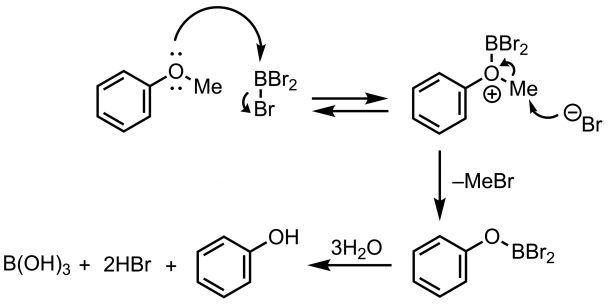
路易斯酸经常被用于脱烷基反应。其中路易斯酸三溴化硼BBr3是首选。BBr3是酸性很强的路易斯酸,O原子上的孤对电子进入到B原子的空轨道上形成络合物,O原子也变为正电性了。接下来,上一步中从BBr3脱除的溴负离子进攻甲基,生成甲基溴和烷氧基二溴硼烷。烷氧基二溴硼烷再水解成硼酸﹑溴化氢和相应的羟基化合物。反应过程如图1所示。
图1 用BBr3为苯甲醚进行脱烷基
因为BBr3实在太活泼了,所以反应一开始要在低温下 (–78˚C ~ 0˚C)进行,随后再慢慢地升温。并且BBr3会与水发生剧烈的反应,所以淬灭反应(quench)加水的时候一定要特别小心。
即使反应在二氯甲烷溶液中进行也会有冒烟现象,所以初次做这个反应的同学可能心理上会有些许害怕。此外,隔膜会变成烧焦的红黑色,看起来很不舒服。另外,溶液状的试剂效果虽不错但也有不足,100 mL的(相当于 0.1 mol BBr3)售价高达近600块人民币。由于添加量超过了当量,所以消耗还是挺快的。
02. 氯化铝AlCl3
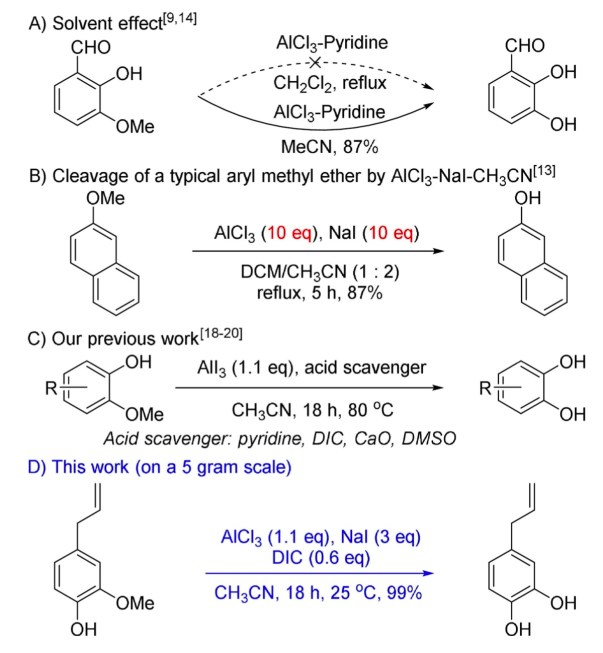
氯化铝AlCl3与三溴化硼BBr3一样都属于强路易斯酸,但氯化铝AlCl3的反应活性较三溴化硼BBr3来说要低很多。市面上售卖的氯化铝有无水氯化铝和氯化铝的六水合物这两种,但是如果作为路易斯酸使用的话是无水氯化铝。Friedel-Crafts酰化反应中经常可以看到无水氯化铝的身影。氯化铝还有一个优点:它比三溴化硼要便宜。将无水氯化铝与底物溶于二氯甲烷中,混合加热就可以得到脱烷氧基的产物了,操作方法十分简便,也有许多改良反应法。在乙腈溶液中反应结果较好[1]。
图2 几种使用AlCl3的脱烷基反应(引用自文献[1])
使用AlCl3进行脱烷基反应的时候,有几点需要注意:在打开反应瓶的时候切记要带上面罩并且要在通风橱里操作因为反应会产生盐酸气体(HCl),另外因为氯化铝具有潮解性,暴露在空气中久了就会在表面形成一层氧化膜从而变得不活泼所以在称取AlCl3后要尽早在乳钵中碾碎。
03. 47%的溴化氢HBr
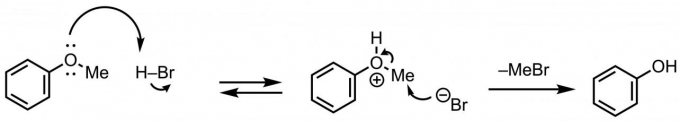
除了路易斯酸被用于脱烷氧基,布朗斯特酸(即Brønsted酸)也可以被用于脱烷氧基。反应机理如下:氧原子被质子化,随后溴负离子进攻甲基,最后生成脱烷基产物和甲基溴(图3)。反应方法:向底物中加入47%的HBr水溶液,加热至130℃。如果底物难溶无法反应,可以将溶剂换成羧酸。也有脱烷基用溴化锂LiBr[2]或Aliquat 336[3](甲基三辛基氯化铵)的。
图3 使用溴化氢的脱烷基反应
如果反应底物没有对酸或热敏感的官能团的话,反应会进行的相当顺利。当反应不顺利的时候,试试减少布朗斯特酸(即Brønsted酸)的用量试试看。市售的HBr不仅有水溶液还有醋酸溶液(https://www.tcichemicals.com/JP/ja/p/H0182)。
04. 烷基硫醇
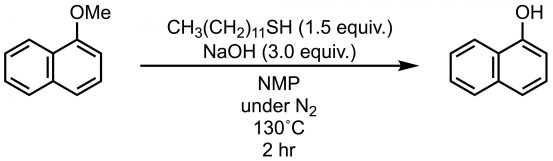
以上说的三种脱烷基反应都是在强酸条件下进行的,也有不需要强酸的反应条件:烷基硫醇。经典反应条件是在NaOH等碱性条件下使用乙基硫醇EtSH,但是这个反应有个缺点那就是低级碳链的硫醇的气味太难闻了。长碳链的硫醇则没有难闻的气味,故改良的反应改用长碳链硫醇。Chae等人报道了使用没有难闻气味的十二烷硫醇CH3(CH2)11SH(图4)[4]。
图4 用十二烷硫醇的脱烷基反应
这个反应在THF中或1,4-二噁烷的回流条件下根本不反应,所以要用NMP或DMSO这样的高沸点溶剂并在130℃条件下加热,反应收率可高达90%以上。DMSO作溶剂时多少会有副产物,所以相较而言NMP是最佳溶剂。不过该反应有一个不足之处:需要在氮气下进行以及不适用于不耐热化合物。
也有的反应将乙基硫醇与氯化铝AlCl3等路易斯酸联用,这种反应即使在冰浴条件下也能进行。
总结
本文一共介绍了四种最基本的脱烷氧基/脱甲氧基的反应条件。Greene“s Protective Group列举有各类反应条件,大多数反应都有用到亲核试剂如路易斯酸,布仑斯惕酸和硫醇。根据你的底物的特点和位置选择性选择适合的脱烷基反应条件,但是请不要忘记我们前文所讲的,烷氧基并不是一个好用的保护基,最好是在合成路线的初始阶段就用本文介绍的这四种基本的脱烷基反应,然后转换成其他保护基。
参考文献
- Sang, D.; Tu, X.; Tian, J.; He, Z.; and Yao, M., “Anchimerically Assisted Cleavage of Aryl Methyl Ethers by Aluminum Chloride-Sodium Iodide in Acetonitrile”, ChemistrySelect, 2018, 3, 10103-10107, DOI; 1002/slct.201802565.
- Li, Z.; Sutandar, E.; Goihl, T.; Zhang, X.; Pan, X., “Cleavage of ethers and demethylation of lignin in acidic concentrated lithium bromide (ACLB) solution”, Green Chem., 2020,22, 7989-8001, DOI: 1039/d0gc02581j.
- Waghmode, S.B.; Mahal, G.; Patil, V.P.; Renalson, K.; Singh, D., “Efficient Method for Demethylation of Aryl Methyl Ether Using Aliquat-336”, Commun, 2013, 43, 3272-3280, DOI: 10.1080/00397911.2013.772201.
- Chae, J., “Practical Demethylation of Aryl Methyl Ethers using an Odorless Thiol Reagent”, Pharm. Res. 2008, 31, 305-309. DOI: 10.1007/s12272-001-1156-y.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.