大家都知道杂环化合物在医药和有机材料中有着广泛的应用。如果在杂环化合物引入硅基团R3Si-的话(硅基化反应),一定不单单是让杂环的性质发生变化,引入的硅基后续也能够衍生出多样的官能团化合物,因此合成硅基化物具有很高的应用前景。
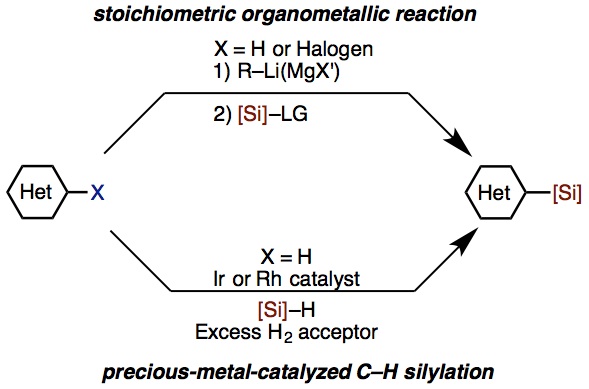
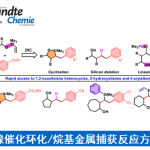
杂环硅基化反应是、将杂环用有机金属试剂金属化后,加入亲电硅基化试剂([SI]-LG),这也是最常用的合成手法。(图1上)。
但是这样的手法会用到很活泼、遇空气容易引起火灾的有机锂反应试剂(R–Li)及格利雅反应试剂(R–MgX),并且反应中要是用化学当量的金属有机试剂,反应中由于这些活性金属试剂有较强的亲核性,对底物官能团适用范围有所限制。
近年来、用金属铱(Ir)及铑(Rh)等过渡金属催化的碳氢键活化直接硅基化反应的研究也有所报道,但是用到这些高价的贵金属,使得工业大规模生产依然困难重重。(图1下)[1]。
针对上述两种代表性的硅基化反应中存在的问题,最近、Nature杂志发表了来自加州理工的Stoltz和Grubbs的研究组的工作,被称为“第三类”硅基化反应。
“Silylation of C–H bonds in aromatic heterocycles by an Earth-abundant metal catalyst”
Toutov, A. A.; Liu, W.-B.; Betz, K. N.; Fedorov, A.; Stoltz, B. M.; Grubbs, R. H. Nature2015, 518, 80–84.
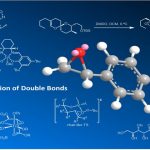
这次报道的反应、是催化的杂环C–H键与[Si]–H直接硅基化反应。反应中起关键作用的催化剂的竟然是常见碱金属盐叔丁醇钾(KOt-Bu)。KOt-Bu一般都是作为强碱在反应中使用,这一次,我们就来看一看它作为催化剂,在这一反应中是如何起作用的。
由副反应开始的研究
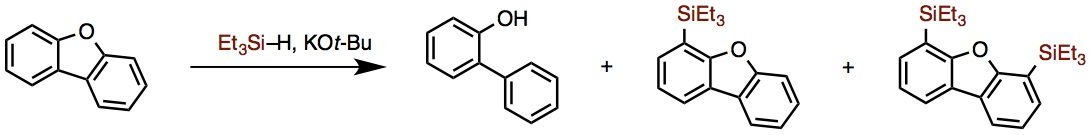
这一反应发现的契机是在2013年Grubbs等开发的芳基醚的还原断裂反应[2]。二苯并呋喃、三乙基氢化硅(3〜5当量)并加入当量的KOt-Bu、加热后发现醚键(C–O键)被切断,生成了酚类衍生物(图2)。
在这个反应中却得到了意想不到的副产物,这个副产物是富电子的芳香环C–H键直接硅基化的化合物。由此想到,如果KOt-Bu作为催化剂,副生成物的収率说不定会提高,催化的C–H键硅基化应该可以实现。之后,他们选定了富电子的芳香杂环作为底物,并尝试优化这一副反应。
新型C-H键硅基化反应和反应机理
反应优化的結果、使用催化量(20 mol%)的KOt-Bu与3当量的三乙基氢化硅(3当量)实现了吲哚C2位的C–H键硅基化转化。除此以外,还尝试了40种以上的芳香杂环化合物的C–H硅基化反应、发现只要是较富电子的芳香杂环,该反应都能适用。然后使用Glorius的手法[3],研究这一反应的官能团适应性(关于这一部分请详见论文)。
不过,对于这一新型反应,让人陷入思考的是它的反应机理,到底这个反应时如何进行的呢?
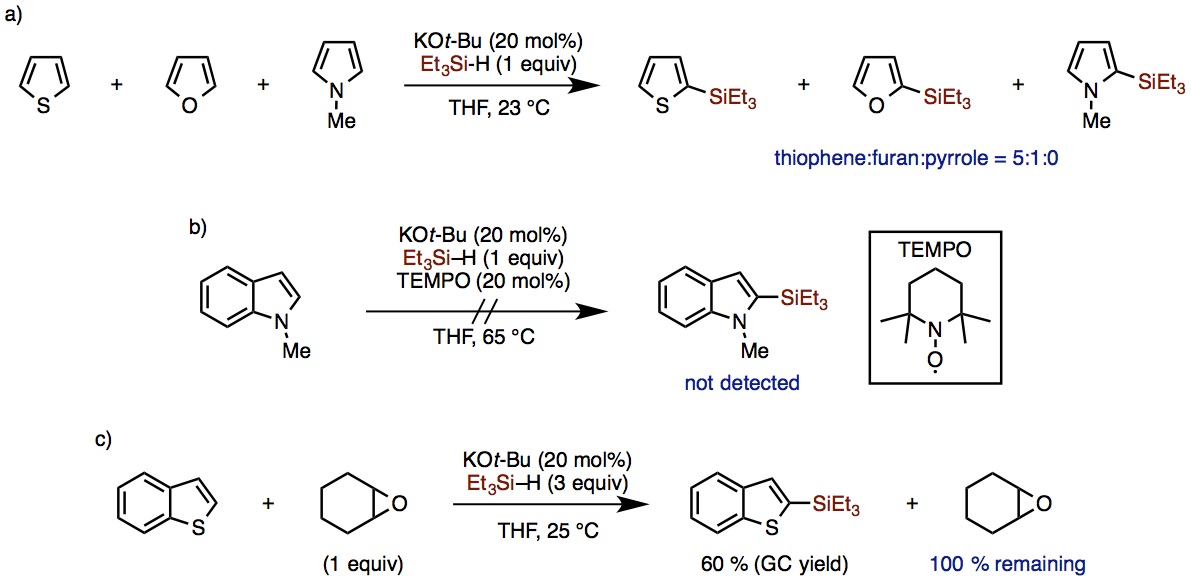
研究者们通过不同芳香杂环底物的竞争实验(图3a),发现噻吩的反应活性高于呋喃,呋喃又高于吡咯,推断该反应性与亲电取代反应相辅。
然后,又通过加入自由基清扫剂TEMPO,由于反应不发生,推断该反应是自由基过程(图3b)。不过吡啶不能发生该反应,所以推测这一反应机理并非芳香杂环的自由基加成反应(minisci反应)机理。
另外、反应中加入环氧化物作为添加剂后,不影响反应进行说明反应中也不太可能有硅负离子参与的可能性,(图3c)。
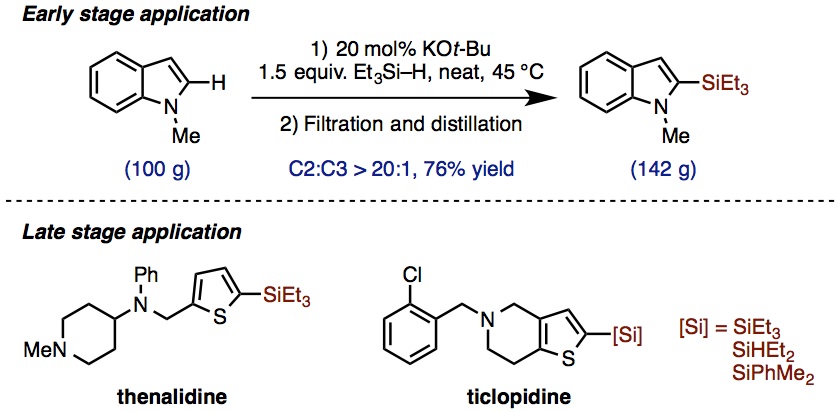
大量合成及最终阶段合成都能用到的反应
那么、这一机理不明的反应的实用性如何呢?研究者们通过各种各样的尝试,不能一一赘述,以下就简单介绍一两点吧:
这个反应对100 g的底物也能反应、只要通过过滤和简单蒸馏就能得到大量获得硅基取代杂环化合物(图4上)。
另外、抗组胺药thenalidine及抗血小板药ticlopidine的合成最终阶段的衍生化也可以用到该反应。(图4下)。
这一研究的实用性如上所述,虽然该反应机理还一时无解,却给大家留下了思考和探索的空间,我们就期待研究者们继续深入这一研究,尽快解明该反应的机理吧!
参考文献
- (a)Cheng, C.; Hartwig, J. F. Science 2014, 343, 853-857. DOI:10.1126/science.1248042 (b)Lu, B.; Falck, J. R. Angew. Chem. Int. Ed. 2008, 47, 7508–7510. DOI:10.1002/anie.200802456
- Fedorov, A.; Toutov, A. A.; Swisher, N. A.; Grubbs, R. H. Chem. Sci. 2013, 4, 1640–1645. DOI:10.1039/c3sc22256j
- Collins, K. D.; Glorius, F. Nat. Chem. 2013, 5, 597–601. DOI:10.1038/NCHEM.1669




















No comments yet.