译自Chem-Station网站日本版 原文链接:紅麹問題に進展。混入物質を「プベルル酸」と特定か!?
翻译:炸鸡
2024年3月22日,日本曝光了一起保健品中毒案。日本著名药企小林制药生产的一款含”红曲”的保健品造成大量服用者出现身体不适或住院甚至死亡的事故。截止2024年4月,涉事保健品服用者中,已有5人死亡,逾200人送医住院,上千人因身体不适求医。
随后,导致小林制药公司的含有红曲成分的产品出现问题的”元凶”被确认是”软毛青霉酸”。
近日,日本厚劳省称已确认软毛青霉酸对肾脏有负面影响。那么这个软毛青霉酸究竟是个什么化合物呢?又是怎么生成的呢?
读者请猜猜下面哪个是软毛青霉酸。
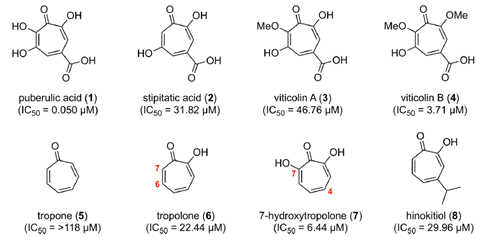
软毛青霉酸是由北里大学的大村、砂冢等人分离和合成的一种抗疟活性化合物,属于环庚三烯酮类物质。[1][2]
1932年,Birkinshaw和Raistrick等人首次从P. puberulum Bainier中分离出软毛青霉酸。[3] 这是一种环庚三烯酮类化合物,同属环庚三烯酮类化合物有桧木醇。
让我们先来比较一下软毛青霉酸和云片柏香气来源的桧木醇在分子结构上有什么差异。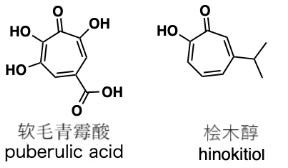
软毛青霉酸的骨架虽然与桧木醇的骨架类似,但不同的是软毛青霉酸具有抗疟疾活性。
大村・砂塚等人的研究小组还研究了软毛青霉酸对人类MRC-5细胞株(来自肺细胞)的细胞损伤能力,并发现软毛青霉酸的IC50值为288.7 μM。
全合成研究
关于软毛青霉酸的简要介绍到此为止。现在,笔者将介绍大村研究团队的人工合成(并非生物合成)软毛青霉酸的方法。
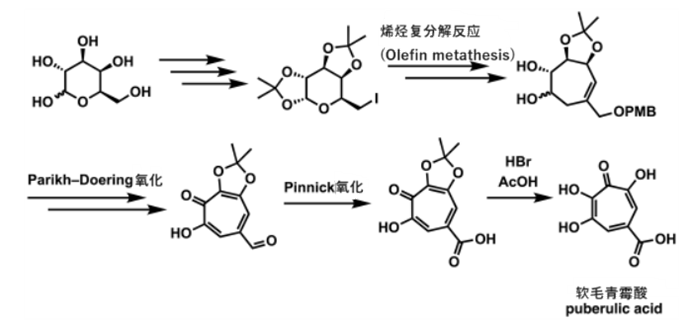
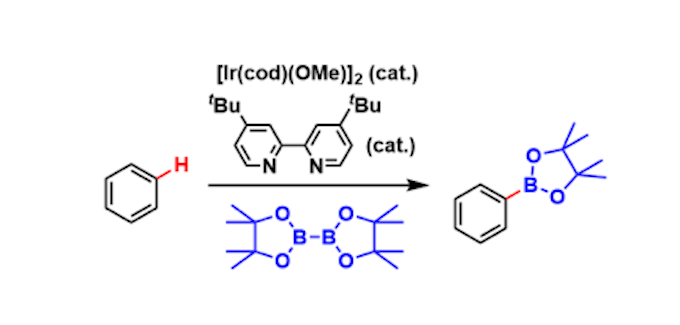
大村・砂塚等人全合成软毛青霉酸的路径简图
大村・砂塚等人以D-半乳糖为出发原料进行了全合成。
他们以氧化的五碳基元作为建构块,通过还原性的碳增加反应和随后的烯烃转移反应,构建了七元环。
随后,通过Parikh–Doering氧化,将其氧化为芳香环,并经过 Pinnick(Kraus) Oxidation将其转化为羧酸。
最后,通过酸将acetonide部分去除,得到了软毛青霉酸。
大村・砂冢等人随后以合成具有抗疟活性的化合物为目标,进行了基于大村天然产物的抗疟疾药物开发的结构活性相关研究。[4]通过这项研究,他们发现了比软毛青霉酸具有更高抗疟活性的化合物,活体实验证明新发现的化合物兼具有效性和低毒性。
需要指出的是,部分文献中称因为软毛青霉酸具有很高的抗疟疾活性所以也相应地有毒性,这种把抗疟疾活性和毒性描述成一种直接的因果关系的措辞是不正确的。
像大村・砂冢等人的研究一样,合成出具有高抗疟活性且在体外(in vitro)和体内(in vivo)都安全无毒/低毒的化合物,才能称得上是真正的药物研究。
生物合成路线
已经看过软毛青霉酸的全合成方法或者思考过红曲霉菌如何合成类似于他汀类药物的人当然会对软毛青霉酸的生物合成产生兴趣。
根据我的调查结果,目前为止没有一篇文献详细地报道过软毛青霉酸的生物合成路线。
但我找到了其他环庚三烯酮类化合物的生物合成路线。
(1)有使用HPLC分析等方法进行研究并提出由细菌进行生物合成的论文[5]
(2)以及使用13C取代实验提出由真菌进行生物合成的论文[6]。以下介绍两篇代表性的论文。
- Tao等人报告的基于HPLC分析的由细菌生物合成环庚三烯酮类化合物的途径[5]。
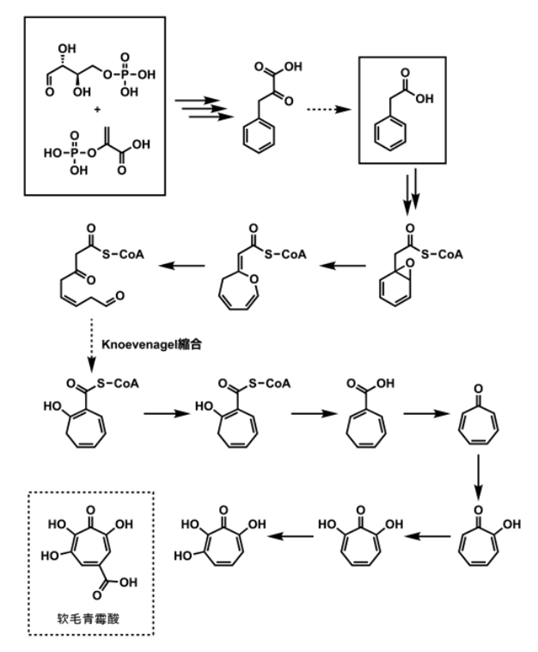
Tao等人报告的基于HPLC分析的由细菌生物合成环庚三烯酮类化合物的途径(图片来自并改编自文献5)
实线部分是参考文献的作者通过分析实验实际验证过的反应,虚线部分是为了连接实际验证的反应。
环庚三烯酮通常是以苯乙酸为原料生物合成的。苯乙酸的苯环先被氧化成环氧化物,然后经过重排反应变成七员环烯醇醚。
随后七员环烯醇醚短暂地水解为醛酮化合物,然后经过Knoevenagel缩合反应再次闭环生成七员环环庚三烯。
环庚三烯随后变成了非苯系芳香族化合物环庚三烯酮。经过各种酶的氧化生成各种氧化环庚三烯酮类化合物。
混入红曲保健品的软毛青霉酸的化学结构式显示有羰基和一定数量的碳原子。但目前还不清楚软毛青霉酸是从碳原子数少的化合物开始一步步生成的的还是像刚刚的生物合成途径一样从碳原子数多的化合物开始生成的。
- Cox等人用13C取代实验来验证真菌生物合成的假说[6]
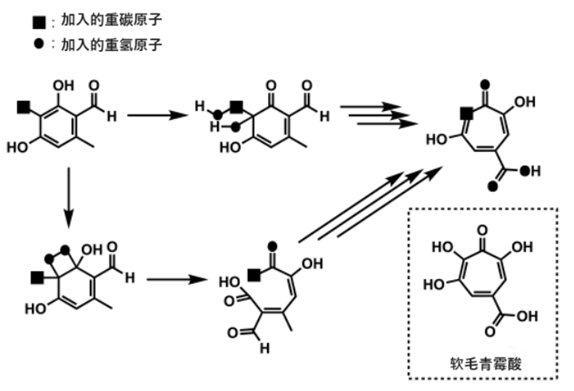
Cox等人利用13C取代实验提出的真菌合成软毛青霉酸的合成路径(来自并改编自参考文献[6])
接下来介绍Cox等人提出的生物合成猜想。
根据Cox等人提出的猜想,存在一种不经过七元环醚的生物合成路径。在这条路径中,可能存在两种方式:一种是直接重排的路径,另一种是如前所述的开环路径。在第二种开环路径下,几乎与(1)所述的路径一致。在这条路径中,软毛青霉酸的衍生物被预先以甲基的形式引入到苯环上,最后被氧化成羧基。
那么以上两种猜想哪个更合理一些呢?
在实验中,科学家们发现软毛青霉酸有以下两种行为:
(A)后来被氧化的青霉酸和软毛青霉酸可以同时被分离出来
(B)青霉酸脱羧后变为软毛青霉酸
将两个猜想与两个发现相结合会得出一个结论:软毛青霉酸的最可能生成路径为:先照(2)的路线预先导入两个甲基,随后照(1)的最后一步的氧化反应合成青霉酸,然后脱羧生成软毛青霉酸。
各位读者们,看完了软毛青霉酸的可能的生物合成路线,能推测出这次红曲保健品里的软毛青霉酸是怎么生成的吗?
从分离到确定结构
那么软毛青霉酸最开始是怎么被分离出来并被确定分子结构的呢?
根据本文开头所述,早在1932年报道了软毛青霉酸的成功的分离[3],但当时分子结构还不明朗。
大村老师们早期关于软毛青霉酸的论文中简要提到过结构,我一直很疑惑是在哪儿决定的结构。查了一下,发现结构背后的历史竟然相当悠久,所以决定单拎出来作为一个单独的部分写在下面。(写的深入会比较困难,但如果过于深入的话,会写的太复杂,因此本文只概述大致的过程。)
如文章开头所讲的那样,1932年Birkinshaw和Raistrick等人从P. puberulum Bainier分泌的化合物中分离出了软毛青霉酸,自此开辟了软毛青霉酸的历史。[3]
然而,1950年Todd等人进行了分解实验,发现生成的化合物应该是苯甲酸衍生物,但实验结果显示它与此前报道的任何一种羟基苯甲酸衍生物都不相符。除此之外,通过其他实验得知,软毛青霉酸具有三个酚羟基,结合pH信息和红外光谱信息,Todd等人提出虽然它是芳香族化合物,但并不是含有苯环的化合物[7]。之后,一连串的论文相继发表发现了如下的几点现象
(1)具有不表现出羰基特有反应性的惰性羰基
(2)在与溴的反应中生成的是取代产物而非加成产物
(3)青霉酸通过脱羧生成软毛青霉酸
结合多篇论文的观点,软毛青霉酸的结构才被确定下来。
值得一提的整个结构确定过程中都没有使用NMR。(Todd等人还同时提出了青霉酸的结构,但提出的结构是错误的)。
由于软毛青霉酸的NMR的谱图过于简单,曾引发人们争论它的结构是如何被确定的。实际上,结构的确定过程算不上十分曲折,确定过程就如这里所述。虽然对笔者来说这是一个意外的结局,不知读者们怎么看呢?
今后的展望
通过生物合成软毛青霉酸是可以的,但在当大量需要时,可以使用本文介绍的人工合成方法合成化合物。
经过这次的风波,我们始终需要牢记:药和毒是表里一体的,毒和药也是表里一体的(请注意笔者特意颠倒顺序重复两次)。制造作用于人体的物质的人们需要极其慎重地研究混入的不纯物会产生什么样的作用。
结束语
感谢读者们的耐心阅读和深入的思考。
在此笔者向红曲事件中的受害者致以最深切的哀悼。
笔者衷心希望今后不再发生类似的事件。
参考文献
- Sennari, G.; Saito, R.; Hirose, T.; Iwatsuki, M.; Ishiyama, A.; Hokari, R.; Otoguro, K.; Ōmura, S.; Sunazuka, K. Antimalarial troponoids, puberulic acid, and viticolins; divergent synthesis and structure–activity relationship studies. Rep.2017, 7, 7259.DOI: 10.1038/s41598-017-07718-3
- Sennari, G.; Hirose, T.; Iwatsuki, M.; Ōmura, S.; Sunazuka, T. A Concise Total Synthesis of Puberulic Acid, a Potent Antimalarial Agent. Commun.2014, 50 (63), 8715–8718. DOI: 10.1039/C4CC03134B.
- Birkinshaw, J. H.; Raistrick, H. Studies in the Biochemistry of Micro-Organisms. J.1932, 26 (2), 441–453.DOI: 10.1042/bj0260441.
- Saito, R.; Sennari, G.; Nakajima, A.; Kimishima, A.; Iwatsuki, M.; Ishiyama, A.; Hokari, R.; Hirose, T.; Sunazuka, T. Discoveries and Syntheses of Highly Potent Antimalarial Troponoids. Chem. Bull.2021, 69, 564–572.DOI: 10.1248/cpb.c21-00132
- Chen, X.; Xu, M.; Lu, J.; Xu, J.; Wang, Y.; Lin, S.; Deng, Z.; Tao, M. Environ. Microbiol., 2018, 84, e00349-18.DOI: 10.1128/AEM.00349-18
- Davisona, J.; al Fahada, A.; Caib, M.; Songa, Z.; Samar, S.; Yehiac, S. Y.; Lazarusd, C. M.; Baieyd, A. M.; Simpsona, T. J.; Coxa, R. J. Genetic, molecular, and biochemical basisof fungal tropolone biosynthesis. Natl. Acad. Sci. USA2012, 109, 7642–7647.
- Corbett, R. E.; Hassall, C. H.; Johnson, W.; Todd, A. R. Puberulic and puberulonic acids. Part I. The molecular formula of puberulonic acid and consideration of possible benzenoid structures for the acids. Chem. Soc.1950, 1950, 1–6.
- Corbett, R. E.; Johnson, W.; Todd, A. R. Puberulic and puberulonic acids. Part II. Structure. Chem. Soc.1950, 1950, 6–9.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.





















No comments yet.