本文作者:杉杉
导读
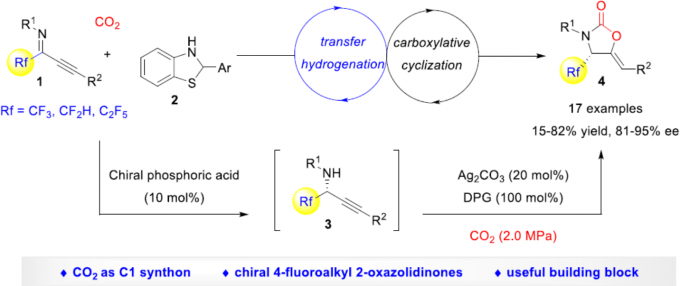
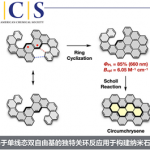
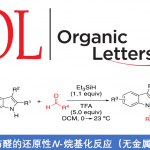
近日,华东师范大学周锋课题组在Organic Letters上发表论文,报道了一种不对称转移氢化(transfer hydrogenation)-羧基化环化(carboxylative cyclization)反应,以高对映选择性合成手性4-氟烷基2-恶唑烷酮衍生物。同时,通过后期的修饰可直接合成具有价值的手性β-氟代烷基β-氨基醇。此外,该反应使用CO2作为C1合成子以及α-氟代烷基炔丙基胺进行羧基环化不对称串联反应,这是非常罕见的。
Catalytic Enantioselective Transfer Hydrogenation-Carboxylative Cyclization to 4‑Fluoroalkyl 2‑Oxazolidinone with CO2 as the C1 Synthon
Zheng Zhang, Zhi-Hao Zhang, Feng Zhou,* and Jian Zhou
Org. Lett. 2021, 23, 2726-2730. DOI: 10.1021/acs.orglett.1c00632
正文
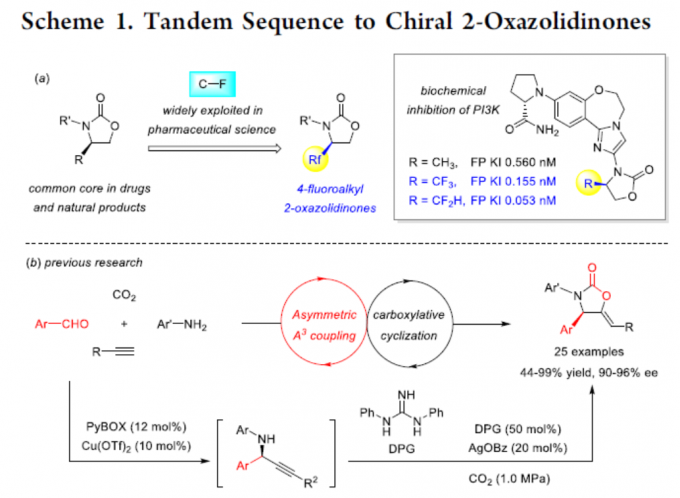
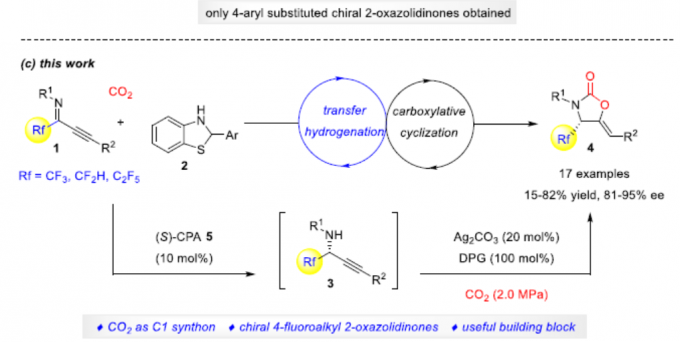
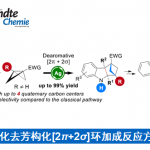
从经济角度考虑,以CO2作为碳合成子的策略极具吸引力。目前,已开发出多种不对称催化策略[1],可将CO2引入到不对称串联反应中,从而有效地构建各种具有价值的手性化合物。2-恶唑烷酮(Oxazolidinones)是最重要的杂环之一,广泛存在于天然产物、药物和生物活性化合物中。同时,若将氟取代基选择性地引入生物活性化合物中,可有效地改善理化和药代动力学性质。因此,若将氟取代基引入2-恶唑烷酮中,也具有一定的意义。如通过将4-氟烷基引入手性2-恶唑烷酮骨架中,可以显着增加PI3K的生化抑制作用[2](Scheme 1a)。尽管已报道多种合成2-恶唑烷酮的方法[3,4],但对于4-氟烷基2-恶唑烷酮的构建仍未实现。此外,也有文献报道关于手性2-恶唑烷酮的不对称催化策略[5],但对于CO2参与不对称串联反应的例子却很少。早在2017年,本课题组开发了一种串联不对称A3偶联-羧基化环化的策略[6],可在温和的条件下由简单的醛、炔烃、胺和CO2直接合成手性2-恶唑烷酮,但此反应的底物范围有限,只能获得4-芳基取代的2-恶唑烷酮(Scheme 1b)。在此,本文将介绍一种将不对称转移氢化-羧基化环化反应相结合,同时以CO2作为C1合成子,从而以高对映选择性合成手性4-氟烷基2-恶唑烷酮衍生物(Scheme 1c)。
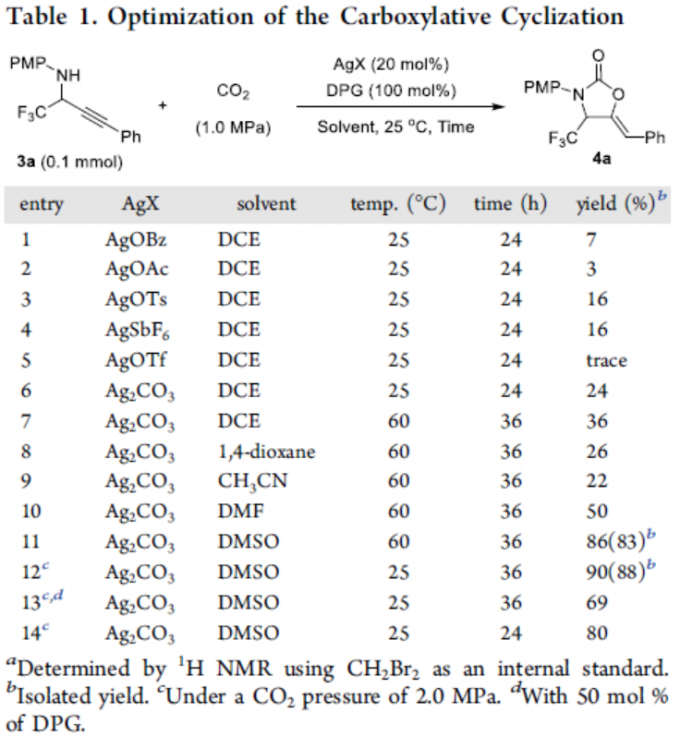
首先,作者以α-三氟甲基炔丙基胺3a和CO2(1.0 Mpa)作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:在2.0 MPa 的CO2气体中,以20 mol%的Ag2CO3为银盐,DMSO为溶剂,并使用100%的DPG,可25℃下反应36h,即可获得90%收率的产物4a。
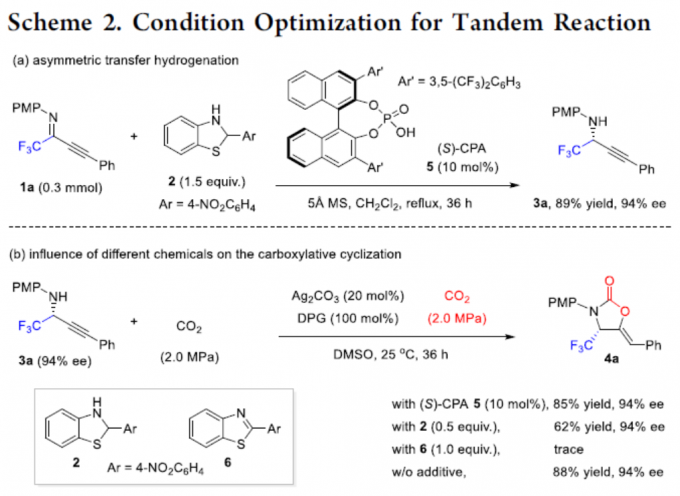
同时,作者对不对称催化体系进行了研究(Scheme 2)。当使用10 mol%的(S)-CPA 5,可实现1a和2的不对称转移氢化,从而获得89%收率和94% ee的产物3a。随后,将3a于2.0 MPa的CO2气体中反应,可获得88%收率和94%ee的手性4-三氟甲基2-恶唑烷酮4a。
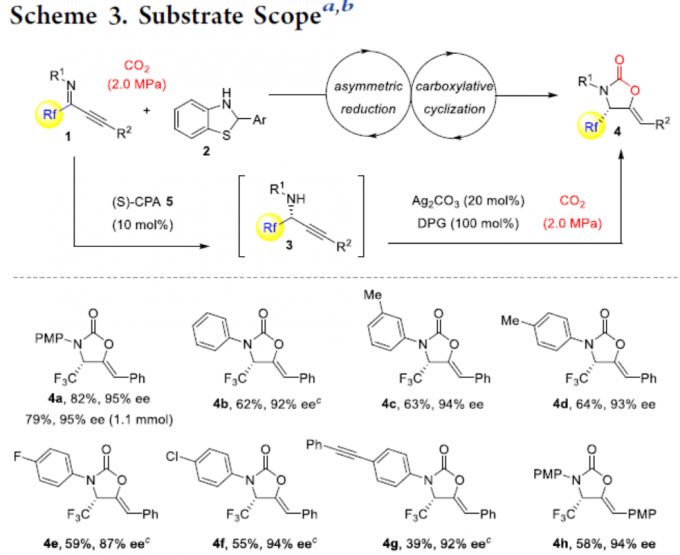
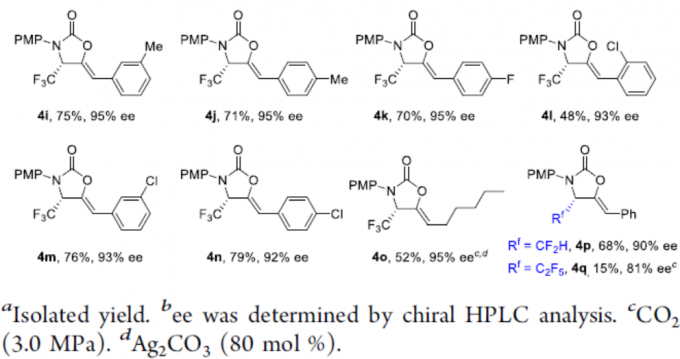
在获得上述最佳反应条件后,作者开始对底物1进行了扩展(Scheme 3)。首先,当R1取代基为苯基、取代苯基时,反应均可顺利进行,获得相应的产物4b–4g,收率为39-64%,ee为87-94%。同时,当苯基的取代含有炔基时,可能由于两个炔基的竞争配位作用,导致4g的收率略低。其次,当R2取代基为芳基、烷基时,反应也可顺利进行,获得产物4h–4n,收率为48-79%,ee为92-95%。当R2取代基为正戊基时,也与体系兼容,获得52%收率和95%ee的产物4o。此外,当使用α-二氟甲基或α-五氟乙基的底物,分别获得产物4p(收率68%,ee为 90%)和4q(收率15%,ee为 81%),可能是由于空间效应和电子效应导致4q收率低。
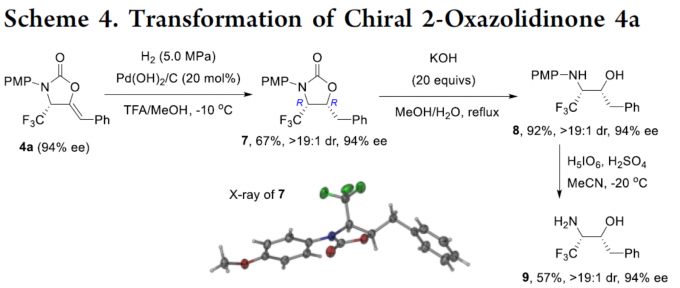
最后,作者对产物进行了后期衍生化实验(Scheme 4)。以4a为底物,可通过三步反应,从而合成具有价值的手性β-三氟甲基β-氨基醇9,反应过程中ee不受影响。
总结
华东师范大学周锋课题组报道了一种新型催化不对称转移氢化-羧基化环化的策略,以CO2作为C1合成子,从而高效地构建具有4-三氟甲基、二氟甲基以及五氟乙基取代基的手性2-恶唑烷酮。同时,通过后期衍生化可合成具有价值的手性氟烷基氨基醇。
参考文献
[1] (a) Vaitla, J.; Guttormsen, Y.; Mannisto, J. K.; Nova, A.; Repo, T.; Bayer, A.; Hopmann, K. H. Enantioselective incorporation of CO2: status and potential. ACS Catal. 2017, 7, 7231−7244. (b) Guo, X.; Wang, Y.-Z.; Chen, J.; Li, G.-Q.; Xia, J.-B. Recent advances of CO2 fixation via asymmetric catalysis for the direct synthesis of optically active small molecules. Chin. J. Org. Chem. 2020, 40, 2208−2220.(c) Ran, C.-K.; Chen, X.-W.; Gui, Y.-Y.; Liu, J.; Song, L.; Ren, K.; Yu, D.-G. Recent advances in asymmetric synthesis with CO2. Sci. China: Chem. 2020, 63, 1336−1351. (d) Shi, Y.; Pan, B.-W.; Zhou, Y.; Zhou, J.; Liu, Y.-L.; Zhou, F. Catalytic enantioselective synthesis using carbon dioxide as a C1 synthon. Org. Biomol. Chem. 2020, 18, 8597−8619.
[2] Braun, M.-G.; Hanan, E.; Staben, S. T.; Heald, R. A.; MacLeod, C.; Elliott, R. Benzoxazepin oxazolidinone compounds and methods of use. US 2017/0002022A1, 2017. [3] Zappia, G.; Gacs-Baitz, E.; Monache, G. D.; Misiti, D.; Nevola, L.; Botta, B. Oxazolidin-2-one ring, a popular framework in synthetic organic chemistry: part 1. The construction of the oxazolidin-2-one ring. Curr. Org. Synth. 2007, 4, 81-135. [4] For review of CO2-participated construction of 2-oxazolidinone: (a) Pulla, S.; Felton, C. M.; Ramidi, P.; Gartia, Y.; Ali, N.; Nasini, U. B.; Ghosh, A. Advancements in oxazolidinone synthesis utilizing carbon dioxide as a C1 source. J. CO2 Util. 2013, 2, 49−57. (b) Liu, X.-F.; Wang, M.-Y.; He, L.-N. Heterogeneous catalysis for Oxazolidinone synthesis from aziridines and CO2. Curr. Org. Chem. 2017, 21, 698−717. (c) Zhang, W.-Z.; Zhang, N.; Guo, C.-X.; Lu, X.-B. Recent progress in the cyclization reactions using carbon dioxide. Chin. J. Org. Chem. 2017, 37, 1309−1321. (d) Zhang, Z.; Ye, J.-H.; Wu, D.-S.; Zhou, Y.-Q.; Yu, D.-G. Synthesis of oxazolidin-2-one from unsaturated amines with CO2 by using homogeneous catalysis. Chem. – Asian J. 2018, 13, 2292−2306. (e) Wang, S.; Xi, C.-J. Recent advances in nucleophile-triggered CO2-incorporated cyclization leading to heterocycles. Chem. Soc. Rev. 2019, 48, 382−404. [5] (a) Overman, L. E.; Remarchuk, T. P. Catalytic asymmetric intramolecular aminopalladation: enantioselective synthesis of vinylsubstituted 2-oxazolidinones, 2-imidazolidinones, and 2-pyrrolidinones. J. Am. Chem. Soc. 2002, 124, 12−13. (b) Li, W.; Wollenburg, M.; Glorius, F. Enantioselective synthesis of 2-oxazolidinones by ruthenium(II)−NHC−catalysed asymmetric hydrogenation of 2-oxazolones. Chem. Sci. 2018, 9, 6260−6263. (c) Liu, Y.-H.; Yi, Z.-Y.; Yang, X.-L.; Wang, H.; Yin, C.-C.; Wang, M.-Y.; Dong, X.-Q.; Zhang, X.-M. Efficient access to chiral 2-oxazolidinones via Ni-catalyzed asymmetric hydrogenation: scope study, mechanistic explanation, and origin of enantioselectivity. ACS Catal. 2020, 10, 11153−11161. [6] Gao, X.-T.; Gan, C.-C.; Liu, S.-Y.; Zhou, F.; Wu, H.-H.; Zhou, J. Utilization of CO2 as a C1 building block in a tandem asymmetric A3 coupling-carboxylative cyclization sequence to 2-oxazolidinones. ACS Catal. 2017, 7, 8588−8593.






















No comments yet.