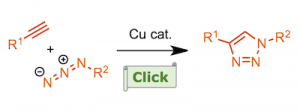
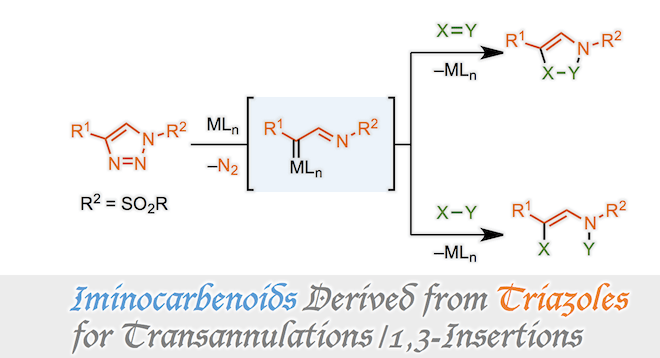
N-磺酰基-1,2,3-三唑在羧酸铑催化剂作用下、能够产生含有亲核性的imine基团的卡宾中间体。该imina-carbenoid中间体可以进而发生跨环或者1,3-插入反应。
基本文献
Review
- Davies, H. M. L.; Alford, J. S. Chem. Soc. Rev. 2014, 43, 5151. DOI:10.1039/C4CS00072B
- Chattopadhyay, B.; Gevorgyan, V. Angew. Chem., Int. Ed. 2012, 51, 862. DOI:10.1002/anie.201104807
背景: 从三唑转化为卡宾活性中间体
1,2,3-三唑可以通过叠氮与炔烃的click反应进行合成、是一种芳香族化合物[3]。
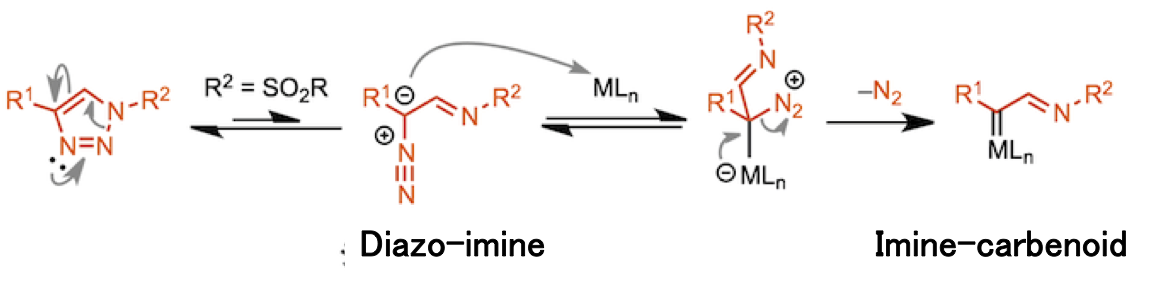
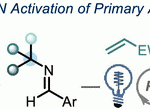
芳虽然芳香族化合物具有固有的稳定性,但在N-原子上具有吸电子基团的三唑通过开环-闭环平衡反应得到微量的开环重氮亚胺[4]。与一般的重氮化合物类似,微量的开环重氮亚胺在金属催化剂的作用下可以产生金属卡宾化合物。也就是说碳原子对向金属提供 σ 孤对电子、然后再从金属方提供 π 电子,进而以离去氮气的形式形成下图所示的Imine-carbenoid活性中间体[5]。这种由N-取代三唑形成的卡宾中间体由于含有亚胺基团,因此被称为亚胺-卡宾中间体。
反应机理: “捕捉卡宾”→亚胺氮亲核进攻
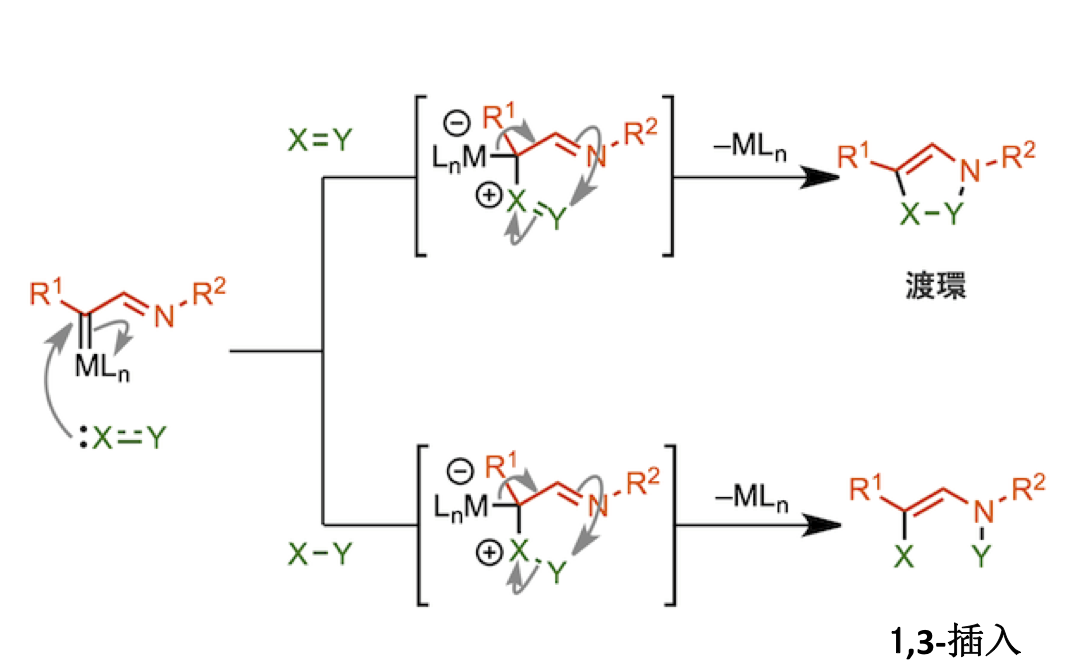
亚胺-卡宾是一个含有强亲电子的卡宾部位与亲核性的亚胺氮部位的活性中间体。由于其氮原子参与反应,可以发生跨环与1,3-插入反应[6]。如下图所示,首先金属卡宾部位被富电子化合物或基团捕捉。然后 C—M σ 结合电子导向亚胺基团,使得亚胺的氮原子发生亲核进攻。
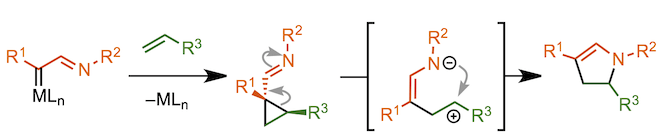
如果底物 X—Y 间具有多重结合键,那么发生跨环反应形成含氮杂环化合物。如果X—Y 间是单键那么发生1,3-插入反应得到链状胺产物。
反应实例
跨环反应
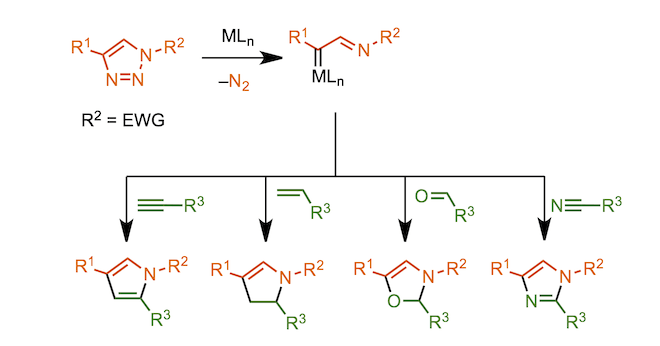
关于含氮杂环化合物的合成有许多报道[2]。具体的有以末端烯烃[7]、富电子烯烃[8, 9]、醛[10]、氰基[11]等为底物分别合成吡咯,二氢吡咯,恶唑啉,咪唑。
1,3-插入反应
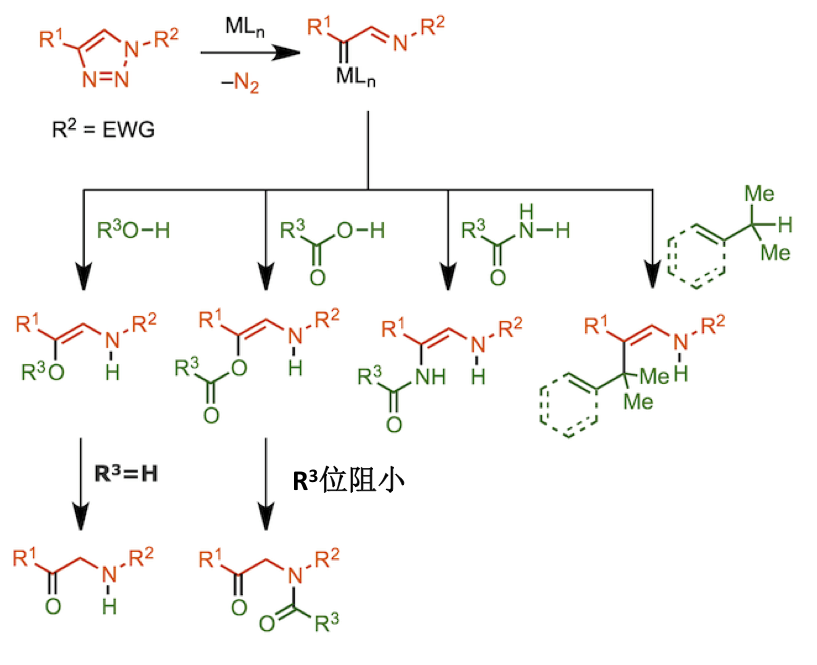
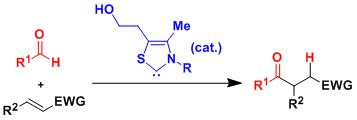
单纯的例子有,对底物醇,羧酸,一级酰胺进行的 X—H 键插入[12]与烯丙基或苄基化合物的C—H 插入[13]。然而,在许多情况下,这些1,3-插入产物随后会经历互变异构或重排反应。例如在与水发生1,3-插入生成的烯胺发生互变异构最终得到氨基酮(上图左端, R3=H)[14]。另外,当与羧酸反应时,羧酸底物的取代基 R3 立体位阻较小的情况,会发生分子内缩合反应,酰基会重排到N上 (上图从左开始第二个反应, 反应机理参考下图)[12]。
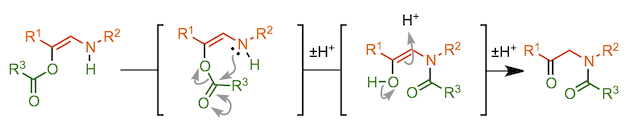
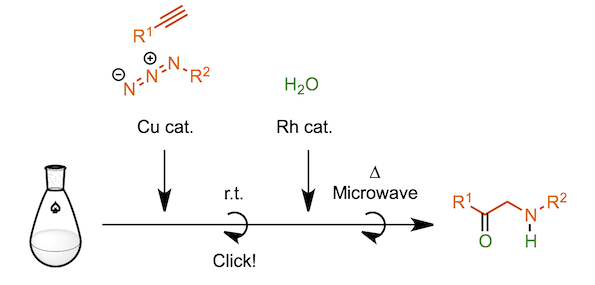
变体:叠氮化物和炔烃的一锅反应
叠氮化物和炔烃的点击反应后,不后处理直接加入催化剂和另一种反应底物、利用该one-pot反应可以用来合成氨基酮[14]。
实验技巧
三唑的合成原料叠氮具有爆炸性,取用时候要注意。
三唑由于结晶性比较高,虽然可以在冷暗处保存,但是容易在空气中发生微量的水解,因此在grove-box里面操作更佳。另外其水解物容易对金属卡宾的生成起阻碍作用,在使用前最好进行重结晶纯化。
关联反应
- Huisgen Cycloaddition
- Dimroth Rearrangement via A Conjugated 1,3-Dipole
- C—H Insertion of Metal Carbenoid
参考文献
- Davies, H. M. L.; Alford, J. S. Chem. Soc. Rev. 2014, 43, 5151. DOI:10.1039/C4CS00072B
- Chattopadhyay, B.; Gevorgyan, V. Angew. Chem., Int. Ed. 2012, 51, 862. DOI:10.1002/anie.201104807
- Raushel, J.; Fokin, V. V. Org. Lett. 2010, 12, 4952. DOI: 10.1021/ol102087r
- [a] Harmon, R. E.; Stanley, F. Jr.; Gupta, S. K.; Johnson, J. J. Org. Chem. 1970, 35, 3444. DOI: 10.1021/jo00835a057 [b] L’abbé, G. Bull. Soc. Chim. Belg. 1990, 99, 281–290. DOI: 10.1002/bscb.19900990410
- Nakamura, E.; Yoshikai, N.; Yamanaka, M. J. Am. Chem. Soc. 2002, 124, 7181.DOI: 10.1021/ja017823o
- 跨环是Transannulation的中译
- Chattopadhyay, B.; Gevorgyan, V. Org. Lett. 2011,13, 3746. DOI: 10.1021/ol2014347
- Kwok, S. W.; Zhang, L.; Grimster, N. P.; Fokin, V. V. Angew. Chem., Int. Ed. 2014, 53, 3452. DOI: 10.1002/anie.201306706
- 从烯烃得到二氢吡咯的反应,详细参考文献[8].
- Zibinsky, M.; Fokin, V. V. Angew. Chem., Int. Ed. 2013, 52, 1507. DOI: 10.1002/anie.201206388
- Horneff, T.; Chuprakov, S.; Chernyak, N.; Gevorgyan, V.; Fokin, V. V. J. Am. Chem. Soc. 2008, 130, 14972. DOI; 10.1021/ja805079v
- Chuprakov, S.; Worrell, B. T.; Selander, N.; Sit, R. K.; Fokin, V. V. J. Am. Chem. Soc. 2014, 136, 195. DOI: 10.1021/ja408185c
- Kubiak, R. W. II; Mighion, J. D.; Wilkerson-Hill, S. M.; Alford, J. S.; Yoshidomi, T.; Davies, H. M. L. Org. Lett. 2016, 18, 3118. DOI: 10.1021/acs.orglett.6b01298
- Miura, T.; Biyajima, T.; Fujii, T.; Murakami, M. J. Am. Chem. Soc. 2012, 134, 194. DOI: 10.1021/ja308285r
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.